Receptor Fas
From Wikipedia, the free encyclopedia
O receptor Fas, tamén chamado Fas, FasR, antíxeno da apoptose 1 (APO-1 ou APT), CD95 ou membro 6 da superfamilia do receptor do factor de necrose tumoral (TNFRSF6), é unha proteína da superficie celular que nos humanos está codificada no xene FAS do cromosoma 10.[1][2] Fas foi identificado primeiramente usando un anticorpo monoclonal xerado ao inmunizar ratos coa liña celular FS-7, polo que o nome Fas deriva do inglés FS-7-associated surface antigen (antíxeno de superficie asociado a FS-7).[3]
| FAS | |||
|---|---|---|---|
 | |||
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB | ||
| Identificadores | |||
| Nomenclatura | Outros nomes
| ||
| Identificadores externos | |||
| Locus | Cr. 10 q23.31 | ||
| Padrón de expresión de ARNm | |||
 | |||
 | |||
 | |||
| Máis información | |||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
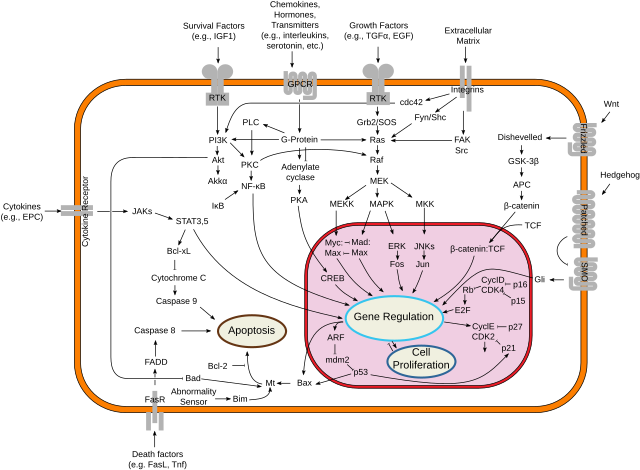
O receptor Fas é un receptor de morte situado na superficie das células que causa a morte celular programada (apoptose) unha vez que se une ao seu ligando, chamado ligando de Fas (FasL). A vía de Fas é unha das dúas vías da apoptose, xunto coa vía mitocondrial.[4]
Xene
O xene do receptor Fas, denominado FAS está localizado no brazo longo do cromosoma 10 (10q24.1) en humanos e no cromosoma 19 en ratos. É un xene de 25255 bases organizado en nove exóns codificantes da proteína. Secuencias similares relacionadas evolutivamente (ortólogos)[5] encóntranse na maioría dos mamíferos.
Proteína
Os informes previos identificaron oito variantes de empalme, que se traducían a sete isoformas de proteínas. O receptor Fas indutor da apoptose era a isoforma 1 e é unha proteína transmembrana de tipo 1. A maioría das outras isoformas son haplotipos raros, que adoitan estar asociados a enfermidades. Porén, dúas das isoformas, a forma unida a membrana indutora da apoptose e a forma soluble, son produtos normais, cuxa produción por empalme alternativo está regulada pola proteína de unión ao ARN citotóxica TIA1.[6]
A proteína Fas madura ten 319 aminoácidos e un peso molecular predito de 48 kDa e está dividida en 3 dominios: un dominio extracelular, un dominio transmembrana e outro citoplasmático. O dominio extracelular ten 157 aminoácidos e é rico en residuos de cisteína. Os dominiso transmembrana e citoplasmático teñen 17 e 145 aminoácidos, respectivamente. Os exóns do 1 ao 5 codifican a rexión extracelular. O exón 6 codifica a rexión transmembrana. Os exóns 7 a 9 codifican a rexión intracelular.
Función
O Fas forma o complexo de sinalización indutor de morte (DISC) unha vez que se liga o seu ligando. O ligando de Fas (un trímero) ancorado a membrana situado na superficie de células adxacentes causa a oligomerización de Fas. Outros modelos suxeriron a oligomerización de 5 a 7 moléculas Fas en DISC.[7] Este evento tamén se pode imitar pola unión dun anticorpo agonista de Fas, aínda que algunhas evidencias indican que o sinal apoptótico inducido polo anticorpo non é fiable para o estudo da sinalización de Fas. Para este fin foron empregadas varias maneiras intelixentes de trimerizar o anticorpo para as investigacións in vitro.
Ao asegurar a agregación do dominio de morte (DD, death domain), o complexo receptor é internalizado utilizando endosomas. Isto permite que a molécula adaptadora FADD se una ao dominio de morte de Fas por medio do seu propio dominio de morte.[8]
FADD tamén contén un dominio efector de morte (DED) preto do seu extremo amino terminal,[9] que facilita a unión ao DED do encima FLICE (encima convertedor de interleucina-1 beta similar a FADD), máis comunmente denominado caspase-8. FLICE pode despois autoactivarse por clivaxe proteolítica dando subunidades p10 e p18, dúas das cales forman o encima heterodímero activo. A caspase-8 activa é despois liberada de DISC e pasa ao citosol, onde cliva outras caspases efectoras, e finalmente causa a degradación do ADN, a formación de ampolas na membrana e outros indicadores de apoptose.
Recentemente, viuse que Fas está implicado no crecemento de tumores, xa que durante a progresión dos tumores está frecuentemente regulado á baixa ou as células convértense en resistentes á apoptose. As células cancerosas en xeral, independentemente da súa sensibilidade á apoptose por Fas, dependen da actividade constitutiva de Fas. Isto é estimulado polo ligando de Fas producido polo cancro para o seu óptimo crecemento.[10]
Aínda que Fas promove o crecemento tumoral nos modelos de ratos, a análise de bases de datos xenómicas de cancros humanos revelaron que FAS non está significativamente amplificado focalmente nun conxunto de datos de 3131 tumores (FAS non é un oncoxene), pero está significativamente eliminado focalmente no conxunto de datos completo deses 3131 tumores,[11] o que suxire que FAS funciona como un supresor de tumores en humanos.
En células cultivadas, FasL induce varios tipos de apoptose de células de cancro por medio do receptor Fas. En modelos de ratos de carcinoma de colon inducido por AOM-DSS e no sarcoma inducido por MCA, viuse que Fas actúa como un supresor de tumores.[12] Ademais, o receptor Fas tamén media na citotoxicidade antitumoral de linfocitos T citotóxicos (CTL) específicos de tumores.[13]
Papel na apoptose
Algúns informes suxeriron que a vía Fas extrínseca é suficiente para inducir unha apoptose completa en certo tipo de células por medio da ensamblaxe de DISC e a subseguinte activación da caspase-8. As células nas que observou isto denomináronse células de tipo 1 e están caracterizadas pola incapacidade de seren protexidas polos membros da familia Bcl-2 (concretamente Bcl-2 e Bcl-xL) da apoptose mediada por Fas. Entre as células de tipo 1 caracterizadas están: H9, CH1, SKW6.4 e SW480, todas as cales son liñaxes de linfocitos agás a última, a cal é unha liñaxe de adenocarcinoma de colon. Porén, hai evidencias de interferencias entre as vías extrínseca e intrínseca na fervenza de sinais de Fas. Na maioría dos tipos celulares a caspase-8 cataliza a clivaxe da proteína proapoptótica Bid de só BH3 (que conteñen un só dominio BH-3) á súa forma truncada tBid. Os membros da familia Bcl-2 de só BH-3 só se relacionan con membros antiapoptóticos da familia (Bcl-2, Bcl-xL), permitindo que Bak e Bax se transloquen á membrana mitocondrial externa, o que permeabiliza esta e facilita a liberación de proteínas proapoptóticas como o citocromo c e Smac/DIABLO, un antagonista de proteínas inhibidoras da apoptose (IAPs).
Interaccións
O receptor Fas presenta interaccións con:
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
