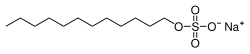
O dodecil sulfato de sodio (ou SDS, do inglés sodium dodecyl sulfate) é un composto orgánico sintético coa fórmula CH3(CH2)11SO4Na. Tamén se pode denominar dodecilsulfato sódico, sodio dodecil sulfato, lauril sulfato de sodio e outras variantes.[1] É un surfactante aniónico usado en moitos produtos de limpeza e hixiene. Esta molécula é un organosulfato e un sal. Consta dunha cola de 12 carbonos unida a un grupo sulfato, é dicir, é o sal sódico do dodecil hidróxeno sulfato, ou o éster do dodecil alcohol e o ácido sulfúrico. A súa cola hidrocarbonada combinada co seu grupo de cabeza polar danlle a este composto propiedades anfifílicas, o que fai que sexa un útil deterxente.[2] Pode ser un compoñente de mesturas producidas a partir de aceites baratos de coco e de palma. O SDS é un compoñente común de moitos limpadores domésticos, de hixiene persoal e cosméticos, así como de produtos alimenticios, e de formulacións de limpeza industriais e produtos industriais.[1]
| Lauril sulfato de sodio | |
|---|---|
 | |
 | |
Sodio dodecil sulfato | |
Outros nomes Sodio monododecil sulfato; Sodio lauril sulfato; Sodio monolauril sulfato; Sodio dodecanesulfato; Sodio coco-sulfato; dodecil alcohol; hidróxeno sulfato, sal de sodio; n-dodecil sulfato de sodio; Ácido sulfúrico monododecil éster sal de sodio; | |
| Identificadores | |
| Número CAS | 151-21-3 |
| PubChem | 3423265 |
| ChemSpider | 8677 |
| DrugBank | DB00815 |
| ChEBI | CHEBI:8984 |
| ChEMBL | CHEMBL23393 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | NaC12H25SO4 |
| Masa molecular | 288,372 g/mol |
| Aspecto | sólido branco ou cor crema |
| Olor | inodoro |
| Densidade | 1,01 g/cm3 |
| Punto de fusión | 206 °C; 403 °F; 479 K |
| Índice de refracción (nD) | 1,461 |
| Perigosidade | |
| LD50 | 1288 mg/kg (rata, oral) |
| Compostos relacionados | |
| Outros anións | Sodio lauril éter sulfato Sodio miristil éter sulfato |
| Outros catións | Amonio lauril sulfato Potasio lauril sulfato |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
Estrutura e propiedades
Estrutura
O SDS pertence á familia dos compostos organosulfatos,[3] e ten a fórmula CH3(CH2)11SO4Na. Consta dunha cola hidrocarbonada de 12 carbonos unida a un grupo sulfato, polo que é o sal sódico dun alcohol de 12 carbonos esterificado ao ácido sulfúrico. Unha descrición alternativa é que é un grupo alquilo cun grupo sulfato terminal unido. Como resultado de ter unha cola hidrocarbonada e unha "cabeza" aniónica é un composto anfipático que pode formar micelas, e así actúa como deterxente.
Propiedades fisicoquímicas

A súa concentración micelar crítica (CMC) en auga pura a 25 °C é de 8,2 mM,[4] e o número de agregación a esta concentración é xeralmente considerado de aproximadamente 62.[5] A fracción de ionización de micelas (α) é de 0,3 (ou 30%).[6]
Produción
O SDS é sintetizado tratando o lauril alcohol con gas trióxido de xofre, ácido sulfúrico fumante, ou ácido clorosulfúrico para producir hidróxeno lauril sulfato.[7] O produto resultante é despois neutralizado coa adición de hidróxido de sodio ou carbonato de sodio.[Cómpre referencia] O lauril alcohol pode utilizarse en forma pura ou pode derivarse a partir de aceites de coco ou aceite de palma por hidrólise (o cal libera os seus ácidos graxos), seguido de hidroxenación.[Cómpre referencia] Cando se produce a partir destas fontes, as mostras comerciais deste produto "SDS" non son realmente SDS puro, senón unha mestura de varios alquil sulfatos de sodio no que o SDS é o principal compoñente.[8] Por exemplo, o SDS é un compoñente, xunto con outros anfífilos de cadea longa, cando se produce a partir de aceite de coco e coñécese como sodio coco sulfato (SCS).[9] O SDS está dispoñible comercialmente en pos, pellets e outras formas (cada unha das cales difire nas súas taxas de disolución), e tamén en solucións acuosas de varias concentracións.[1]
Aplicacións
Limpeza e hixiene
O SDS utilízase principalmente en deterxentes para lavar a roupa e ten moitas aplicacións na limpeza.[2] É un surfactante moi efectivo e pode utilízarse en calquera tarefa que consista en quitar manchas e residuos de aceite; por exemplo, encóntrase en altas concentracións en produtos industriais como desengraxantes de motores, limpadores de chans, e limpadores da carrocería de coches.[1][10]
En baixas concentracións atópase en xabóns, pasta de dentes, xampús, cremas de barbear e formulacións de baños de burbullas, pola súa capacidade de crear escuma, polas súas propiedades surfactantes e en parte polo seu efecto espesante.[1][11]
Aditivo alimentario
O SDS aparece co seu nome sinónimo sodio lauril sulfato (SLS) como compoñente engadido a alimentos como aditivo, que se considera seguro en países como os Estados Unidos,[12] pero o SLS non se permite na Unión Europea.[13] Utilízase como axente emulsificante e de axuda para facer batidos.[14] Informouse que o SLS fai diminuír temporalmente a percepción da dozura.[15] Como aditivo alimentario dáselle o código E487.[16]
Aplicacións nos laboratorios
Aplicacións principais
O lauril sulfato de sodio en ciencia adoita denominarse dodecil sulfato de sodio (SDS), e uilízase en procedementos de limpeza,[17] e como compoñente para a lise de células durante a extracción de ARN ou de ADN, así como para desnaturalizar proteínas para preparalas para unha electroforese na técnica SDS-PAGE.

No caso da aplicación na SDS-PAGE, este composto aplícase a temperatura elevada a unha concentración de 1,4 gramos de SDS por cada gramo de proteína, e o procedemento funciona alterando os enaces non covalentes das proteínas, o que causa a súa desnaturalización, é dicir, as proteínas perden a súa forma ou conformación nativa.[18][19][20] Ao unirse ás proteínas con alta afinidade e en altas concentracións, o deterxente cargado negativamente fai que todas as proteínas adquiran a mesma carga neta e que, por tanto, teñan unha proporción corga/masa similar. Deste modo, a diferenza de mobilidade das cadeas polipeptídicas no xel de poliacrilamida vai depender só do seu tamaño en vez de da súa forma ou carga.[21] Facer a separación das proteínas da mestura baseándose no tamaño da cadea polipeptídica simplifica a análise das moléculas proteicas e isto conséguese grazas á desnaturalización causada polo deterxente SDS.[21] Unha molécula de SDS ten dúas cargas negativas ao pH utilizado na electroforese, isto fai que a carga neta dos polipéptidos recubertos polo deterxente sexa moito máis negativa que na proteína nativa.[21] A proporción carga/masa é esencialmente idéntica para diferentes proteínas, porque o recubrimento de SDS é o que predomina na creación da carga.[21]
Outras aplicacións de laboratorio
O SDS utilízase como unha técnica de mellora para preparar tecidos cerebrais para o seu estudo con microscopio óptico. A técnica, que se denomina comercialmente CLARITY, é resultado do traballo de Karl Deisseroth e colegas na Universidade Stanford, e implica a infusión do órgano con solución de acrilamida para que se una ás macromoléculas do órgano (proteínas, ácidos nucleicos etc.), seguido da polimerización térmica para formar un "hidroxel cerebral" (unha rede dispersa entre o tecido para fixar espacialmente as macromoléculas e outras estruturas), e despois retíranse os lípidos usando SDS para eliminar a dispersión da luz cunha mínimaperda de proteínas, facendo o tecido case transparente.[22][23][24]
Xunto co sodio dodecilbenceno sulfonato e o Triton X-100, as solucións acuosas do SDS son moi usados para dispersar ou suspender nanotubos, como os nanotubos de carbono.[25]
Outros usos
Propúxose o uso do SDS como microbicida tópico efectivo para uso intravaxinal, para inhibir e posiblemente impedir as infeccións por varios virus con envoltura e sen envoltura, como o virus herpes simplex, o VIH e o virus Semliki Forest.[26][27]
Nos experimentos de formación de hidratos de gas, o SDS utilízase como un promotor do crecemento dos hidratos de gas.[28][29] Os investigadores pretenden que isto facilita a aplicación industrial dos hidratos de gas para procesos de desalinización,[30] almacenamento de gas e tecnoloxias de separación de gases.[31]
As membranas líquidas formadas con SDS en auga demostraron funcionar como separadores de partículas pouco comúns.[32] Estes dispositivos actúan como un filtro inverso, permitindo que pasen as partículas grandes, mentres que capturan as partículas máis pequenas.
Tamén se aproveitaron as propiedades do SDS para o seu uso como herbicida e praguicida de tipo "xabón".[33][1]
O SLS é un excipiente en produtos medicinais con diversos usos funcionais como axente emulsificante, axente modificador da liberación, potenciador da penetración, axente solubilizante e lubricante de tabletas e cápsulas. Os produtos medicinais autorizados conteñen SLS en concentracións que van desde o 0,2% w/w (por exemplo en cremas) ao 25% w/v (en xampús medicinais). O SLS non se usa en produtos parenterais.[13] O SLS ou os seus derivados úsanse como compoñentes dalgúns enemas laxantes.[34]
Toxicoloxía
Carcinoxenicidade
O SDS non é carcinóxeno cando se consome ou aplica directamente, incluso en cantidades e concentracións que exceden as cantidades usadas en produtos comerciais estándar.[35][36] Os exames iniciais do Panel de Expertos do programa Cosmetic Ingredient Review (CIR) en 1983 informaron que o SDS (aquí abreviado SLS, sodio lauril sulfato) en concentracións de ata o 2%, en estudos dietarios orais dun ano de duración en cans, non produciron evidencias de tumorixenicidade ou carcinoxenicidade, e que non se observaron aberracións cromosómicas ou efectos clastoxénicos en ratas alimentadas con 1,13% de sodio lauril sulfato nas súas dietas durante 90 días, respecto aos que estaban baixo unha dieta control.[35]:157, 175 O exame de 2005 feito polo mesmo grupo indicou que ulteriores datos dispoñibles non suxerían tampouco que o SDS ou o seu sal de amonio relacionado fosen carcinoxénicos, afirmando que "Malia as afirmacións sobre o contrario en Internet, a carcinoxenicidade destes ingredientes é só un rumor;" ambos os estudos conclúen que o SDS parece "ser seguro nas formulacións deseñadas para uso breve e descontinuo seguido do completo lavado da superficie da pel. En produtos pensados para un contacto prolongado coa pel, as concentracións non deberían exceder o 1%."[36]:89ff
Sensibilidade
Como todos os deterxentes, o SDS quita os aceites da pel e pode causar irritación na pel e ollos.[37] Pode irritar a pel da face cunha exposición prolongada e constante (máis dunha hora) en adultos xoves.[38] O SDS pode empeorar os problemas da pel en individuos con hipersensibilidade cutánea crónica, e algunhas persoas son máis afectadas que outras.[39][40][41]
Uso oral
O baixo custo do SDS,[42] o feito de que non afecta ao sabor,[42] o seu impacto potencial sobre os compostos do xofre volátiles, que contribúen ao mal alento,[43] e a súa desexable acción como axente escumante levaron a que o SDS se usase nas formulacións de pastas de dentes.[42] Unha serie de pequenos estudos (de 25 a 34 pacientes) apoiaron a eficacia do SLS na redución dos compostos de xofre volátiles e o seu impacto positivo sobre o mal alento, aínda que estes estudos foron xeralmente criticados por teren defectos técnicos no control das variables deseñadas do estudo.[43] Aínda que as fontes primarias do grupo de Irma Rantanen na Universidade de Turku, Finlandia concluíron que había unha mellora sobre a sequidade de boca (xerostomia) das pastas que contiñan SLS, unha revisión Cochrane de 2011 destes estudos, e da área máis xeral, concluíron que "non hai fortes evidencias… de que ningunha terapia tópica sexa efectiva para aliviar os síntomas da boca seca."[44] Indicáronse algunhas preocupacións sobre a seguridade baseándose nalgúns estudos sobre o efecto do SDS das pastas de dentes sobre a estomatite aftosa, as coñecidas como aftas ou carouquexas.[42] En 2016 non se chegara a ningún consenso sobre esta práctica (ou a necesidade do seu cambio) como resultado destes estudos.[45] Como sinala Lippert, en 2013, "moi poucas… pastas dentíficas comercializadas conteñen un surfactante distinto do SLS [SDS]," e os principais fabricantes continúan formulando os seus produtos con SDS.[42]
Interacción cos fluoruros
Algúns estudos indicaron que o SLS en pastas detíficas pode facer diminuír a efectividade do fluoruro engadido para previr a carie dental. Isto pode deberse a que o SLS interacciona coa deposición de fluoruro no esmalte dental.[46]
Notas
Véxase tamén
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.