Zenbaki atomikoa 41 duen elementu kimikoa. Metal gris, distiratsu, xaflakor eta harikorra, naturan ez oso ugaria From Wikipedia, the free encyclopedia
Niobioa (edo kolunbioa) elementu kimiko bat da, Nb ikurra eta 41 zenbaki atomikoa dituena. Trantsizio-metala da, harikorra, grisa, biguna eta ez oso arrunta. Niobita mineralean ageri da eta aleazioetan erabiltzen da. Normalean altzairuak egiteko erabiltzen da, erresistentzia handiagoa izan dezaten.
| Niobioa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 41 Zirkonioa ← Niobioa → Molibdenoa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ezaugarri orokorrak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izena, ikurra, zenbakia | Niobioa, Nb, 41 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie kimikoa | trantsizio-metalak | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Taldea, periodoa, orbitala | 5, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomikoa | 92,90638(2) g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurazio elektronikoa | [Kr] 4d4 5s1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroiak orbitaleko | 2, 8, 18, 12, 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate fisikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egoera | solidoa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dentsitatea | (0 °C, 101,325 kPa) 8,57 g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Urtze-puntua | 2.750 K (2.477 °C, 4.491 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Irakite-puntua | 5.017 K (4.744 °C, 8.571 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Urtze-entalpia | 30 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Irakite-entalpia | 689,9 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bero espezifikoa | (25 °C) 24,60 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lurrun-presioa
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietate atomikoak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristal-egitura | kubikoa, aurpegietan zentratua | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidazio-zenbakia(k) | 5, 4[1], 3, 2[2], 1[3] (oxido azido ahula) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatibotasuna | 1,6 (Paulingen eskala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizazio-potentziala | 1.a: 652,1 kJ/mol 2.a: 1.380 kJ/mol 3.a: 2.416 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio atomikoa (batezbestekoa) | 145 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio atomikoa (kalkulatua) | 198 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Erradio kobalentea | 137 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Datu gehiago | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eroankortasun termikoa | (300 K) 53,7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soinuaren abiadura | 3.480 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopo egonkorrenak | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Niobioaren isotopoak
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Niobioa Charles Hatchett kimikari ingelesak identifikatu zuen 1801ean.[4][5][6] Elementu berri bat aurkitu zuen Connecticutetik Ingalaterrara bidalitako mineral batean. 1734 urtean bidali zuen John Winthropek (John Winthrop Youngeren biloba) eta Charlesek mineralari columbite izena eta elementuari columbium izena jarri zion, Ameriketako Estatu Batuetako izen poetiko Columbiaren omenez.[7][8][9] Hatchettek aurkitutako kolonbioa ziurrenik elementu berriaren eta tantaloaren arteko nahasketa bat zen.
Hori dela eta, nahasketa handia izan zen[10] columbium (niobioa) eta erlazioa handia duen tantalioaren artean. 1809an William Hyde Wollaston kimikari ingelesak kolonbio-kolonbita eta tantalio-tantalitatik deribatutako oxidoen dentsitateak alderatu zituen. Lehenak 5.918 g/cm3-ko dentsitatea zuen eta bigarrenak, 8 g/cm3-koa. Nahiz eta dentsitateen artean horrelako ezberdintasuna egon, bi oxidoak berdin-berdinak zirela ondorioztatu zuen eta beraz tantalio izena mantendu zuen bientzat.[10] 1846. urtean Heinrich Rose kimikari alemaniarrak ondorio honen aurka eztabaidatu zuen. Bere argudio nagusia tantalitaren laginean bi elementu ezberdin zeudela zen eta hori dela eta, Tantaloren haurren izenak erabiliz izendatu zituen: niobioa (Niobetik) eta pelopioa (Pelopetik).[11][12] Tantalo eta niobioaren artean behatu ziren desberdintasun minimoek sortu zuten nahasmen hau. Pelopium, ilmenium, eta dianium ustezko elementu berriak[13], azkenean, niobioaren edo niobio eta tantaloaren nahasketen berdinak zirela frogatu ziren.[14]

Tantalo eta niobioaren arteko ezberdintasunak 1864an Christian Wilhelm Blomstrand[14] eta Henri Etienne Sainte-Claire Devillek, baita Louis J. Troostek 1865ean, frogatu zituzten definitiboki. Hainbat konposatuen formulak zehaztu zituen azken honek[14][15]. Azkenik, 1866an, Jean Charles Galissard de Marignac kimikari suediarrak azkeneko ebidentziak aurkitu zituen.[16] Lau kimikari hauen lanek bi elementu bakarrik zeudela frogatu zuten. Hala ere, ilmenium elementua aipatzen zuten artikuluak 1871 urtera arte jarraitu ziren ateratzen.[17]
De Marignac izan zen metala prestatu zuen lehenengoa 1864 urtean. Horretarako, niobio kloruroa erreduzitu zuen hidrogenoa zuen atmosfera batean berotuz.[18] Nahiz eta de Marignac 1866. urterako tantalio gabeko niobioa eskala handian ekoizteko gai baldin bazen ere, XX. mendearen hasierara arte niobioa ez zen komertzialki erabili. Komertzialki izan zuen lehen aplikazioa bonbillen filamentuetan izan zen.[15] Erabilera hori azkar ordezkatua izan zen, tungstenoa erabiltzen hasi baitzen niobioaren ordez. Izan ere, tungstenoak urtze-puntu handiagoa du. Niobioak altzairuaren gogortasuna hobetzen duela 1920ko hamarkadan aurkitu zen lehenengo aldiz, eta aplikazio honek niobioaren erabilera nagusia izaten jarraitzen du gaur egun ere.[15] 1961. urtean, Eugene Kunzler fisikari estatubatuarrak eta Bell Laborategietako bere lankideek aurkitu zuten niobio-eztainu aleazioak supereroankortasuna erakusten jarraitzen duela korronte elektriko eta eremu magnetiko indartsuak dauden egoeretan.[19] Propietate honek bere erabilera zabaldu zuen: lehen materiala zen indar handiko iman eta elektrizitatea sortzeko tresnek behar dituzten korronte eta eremu altuak jasateko gai zena. Aurkikuntza honek, bi hamarkada beranduago, bobinetan bildutako hainbat haritako kable luzeen produkzioa ahalbidetu zuen. Era honetan, elektroiman indartsuak sortu ahal ziren, makina birakarietan, partikula azeleragailuetan eta partikula detektagailuetan erabiltzeko.[19][20]
Columbium (Cb ikurra "Cb")[21] izan zen Hatchettek eman zion izena 1801. urtean metala aurkitu zuenean.[5] Izenak islatzen zuen elementua aurkitu zuen mea motaren alea Amerikatik (Columbia) zetorrela[22]. Izen hori Amerikako aldizkarietan erabiltzen jarraitu zen. Izenburuan Columbium izena erabiltzen zuen azken ikerketa 1953an argitaratu zuen Amerikako Kimikako Elkartea.[23] Niobio izena berriz, Europan erabiltzen zen. Nahasmenarekin amaitzeko, niobio izena aukeratu zen 41. elementua izendatzeko 1949an Amsterdamen ospatu zen Kimikaren Batasunaren XV. Biltzarrean.[24] Urtebete beranduago, izen hori Kimika Puru eta Aplikatuaren Nazioarteko Batasunak (IUPAC) ofizialki onartu zuen. Era honetan amaiera eman zitzaion 100 urte irauten zuen polemikari. Erakunde honek niobio izena aukeratu zuen, nahiz eta columbium izena kronologikoki lehena izan zen erabiltzen elementu hau izendatzeko.[24] Baliteke aukera hau alde guztiak pozik uzteko egin izana[24], izan ere IUPACek 74. elementua izendatzeko tungsteno izen ipar-amerikarra aukeratu zuen Europan erabiliagoa zen wolfram izenaren ordez, eta ondoren, Europan gehiago erabiltzen zen niobio izena columbiumaren ordez. Estatu Batuetako kimikako sozietate eta gobernu erakunde askok normalean IUPAC erakundeak jarritako izen ofiziala erabiltzen duten arren, metalurgiako kide eta metalaren inguruko elkarte batzuek jatorrizko izen amerikarra erabiltzen dute oraindik, "columbium".[25][26][27]
Niobioa metal distiratsu, gris, harikor eta paramagnetiko bat da, taula periodikoaren 5. taldekoa. Hala ere, kanpoaldeko geruzetan duen elektroien konfigurazioa atipikoa da 5. talde honetarako.
Uste zabalduenen arabera, bere egitura kristal kubikoez osatua dago (zehazki, gorputzean zentratutako kuboez) zero absolututik bere urtze punturaino. Ala ere, azken aldian egin diren erresoluzio handiko neurketen arabera, hiru ardatz kristalografikoen artean dagoen hedadura termalak anisotropiak erakusten ditu, eta datu hauek ez lirateke bateragarriak estruktura kubiko batekin.[28] Hori dela eta, ikerketa eta aurkikuntza gehiago espero dira arlo honetan.
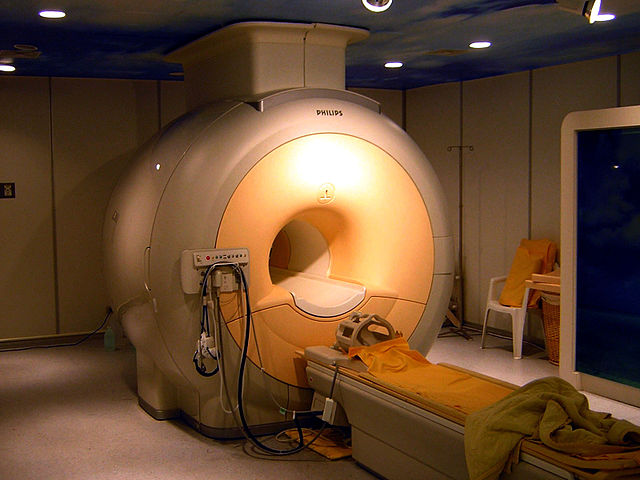
Niobioa supereroale bihurtzen da tenperatura kriogenikoetan. Presio atmosferikoan, oinarrizko supereroaleen artean tenperatura kritiko altuena du: 9.2 K.[29] Niobioak, elementu guztien artean, penetrazio magnetiko sakonena dauka[29]. Gainera, oinarrizko II motako supereroalea da. Mota honetako hiru elementu daude bakarrik: niobioa, banadioa eta teknezioa. Propietate supereroale hauek oso lotuak daude niobio metalaren purutasunarekin.[30]
Oso purua denean, konparatiboki biguna eta harikorra da, baina ezpurutasunek gogorragoa egiten dute.[31] Metalak neutroi termikoetarako harrapaketa txikia du[32], eta hori dela eta neutroien gardentasun egiturak nahi dituzten industrietan nuklearretan erabiltzen dira.[33]
Metalak urdin kolore bat hartzen du airearekin kontaktuan badago giro-tenperaturan denbora luze batean zehar.[34] Nahiz eta bere oinarrizko forman urtze puntu altua (2.468 ° C) duen arren, beste metal errefraktore batzuek baino dentsitate txikiagoa du. Gainera, korrosioarekiko erresistentea da, supereroaleen propietateak erakusten ditu eta oxido dielektriko geruzak sortzen ditu.
Taula periodikoan aurrean duen elementuarekin, zirkonioarekin, alderatuta, niobioak elektropositibotasun apur bat txikiagoa du eta trinkoagoa da. Astunagoak diren tantalo atomoekin alderatuta berriz, birtualki tamaina berdinekoa da, lantanoen kontrakzioaren ondorioz.[31] Ondorioz, niobioaren propietate kimikoak tantaloaren oso antzekoak dira, taula periodikoan justu niobioaren azpian dagoen elementua.[15] Nahiz eta korrosioarekiko erresistentzia ez den tantaloarena bezain altua, niobioaren prezio baxuagoak eta erabilgarritasun handiagoak erakargarria bihurtzen dute hain eskaera handiak ez dituzten aplikazioetarako. Adibidez, instalazio kimikoetako ontzien estalduretan erabiltzen da.[31]
Lurraren lurrazalean niobioaren isotopo egonkor bat dago, 93Nb.[35] 2003. urterako, gutxienez 32 isotopo erradiaktibo sintetizatu dira, 81 eta 113 bitarteko masa atomikoa dutenak. Horien artean egonkorrena 92Nb da eta 34,7 milioi urteko semi-desintegrazio periodoa dauka. Egonkortasun txikiena duenetako bat 113Nb da, 30 milisegundoko semi-desintegrazio periodoa duela kalkulatzen dena. Egonkorra den 93Nb isotopoa baino arinagoak direnak, β+ desintegrazioan desintegratu ohi dira, eta astunagoak direnak berriz, β-desintegrazioa jasaten dute desintegratzen direnean. Hala ere, badaude salbuespen batzuk: 81Nb, 82Nb eta 84Nb isotopoek atzeratutako β + protoi emisio desintegrazioa dute, 91Nb isotopoaren desintegrazioa elektroi harrapaketa eta positroi emisio bidez gertatzen da, eta 92Nb isotopoak β + eta β- desintegrazioak jasaten ditu.[35]
Gutxienez 25 isomero nuklear deskribatu dira, 84 eta 104 bitarteko masa atomikoak dituztenak. Sorta horretan, soilik 96Nb, 101Nb eta 103Nb isotopoek ez dute isomerorik. Niobioaren isomero egonkorrena 93mNb da eta 16,13 urteko semi-desintegrazio periodoa du. Niobioaren isomero guztiak isomero trantsizioaren edo beta desintegrazioaren eraginez desintegratzen dira, 92m1Nb izan ezik. Honek elektroi harrapaketa jasaten du.[35]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.