Lehekülg ei ole veel valmis - palun oodake parandustega! |
|---|
| Aineklassid | ||||||||
|---|---|---|---|---|---|---|---|---|
| Aineklass | Valem | Näited | Nimetus | Eesliide | Järelliide | Graafiline kujutis | Märkused | Inglise Viki |
| Alkaanid | CnH2n+2 | CH3–CH3 CH3–CH2–CH3 |
etaan propaan |
- | -aan |  |
Alkane | |
| Alkeenid | CnH2n | CH2=CH2 CH2=CH–CH3 |
eteen propeen |
- | -een |  |
||
| Alküünid | CnH2n-2 | CH2≡CH2 CH2≡CH–CH3 |
etüün propüün |
- | -üün | |||
| Halogeeniühendid | RHal | CH3–CH2Cl CH3–CH2Na CHBr3 |
 |
Haloalkane | ||||
| Alkoholid | ROH | CH2–OH CH3–CH2–OH |
metanool etanool |
hüdroksü- | -ool | Alcohol | ||
| Alkoholaadid | ROMe | oksido- | -olaat | |||||
| Amiinid | -NH2 | -amiin |  |
Amine | ||||
| Amiidid | R-CO-NH2 | CH3CONH2 | etaanamiid | amino- | -amiid | 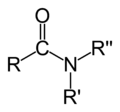 |
||
| Imiinid | imino- | -imiin |  |
Imine | ||||
| Eetrid | R–O–R' | (R)oksü- | RR'eeter | |||||
| Ketoonid | RCOR' | okso- | -oon |  |
Ketone | |||
| Aldehüüdid | RCHO | okso- formüül- |
-aal -karbaldehüüd |
 |
Aldehyde | |||
| Karboksüülhapped | RCOOH | – karboksü- |
-hape -karboksüülhape |
 |
Carboxylic acid | |||
| Estrid | RCOOR' |  |
Ester | |||||
| Soolad | RCOOMe | Salt | ||||||
| Tioolid | -SH | sulfanüül- | -tiool | 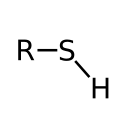 |
Thiol | |||
| Keemiliste reaktsioonide tüübid | ||
|---|---|---|
| Reaktsiooni tüüp | Skeem | Näide |
| Ühinemisreaktsioon | A+B→AB | 2CO+O2→2CO2 |
| Lagunemisreaktsioon | AB→A+B | H2CO3→H2O+CO2 |
| Asendusreaktsioon | AB+C→AC+B | CaO2+2NaCl→2NaO+CaCl2 |
| Vahetusreaktsioon | AB+CD→AD+CB | CaO+2HCl→CaCl2+H2O |
Molaarne kontsentratsioon näitab, mitu mooli ainet on lahustatud 1 liitris lahustis.
- mõõtühik
- 1M = 1mol / l -> ühe molaarne = üks mool ainet / ühes liitris
- Molaarse kontsentratsiooni leidmine
- c-lahuse molaarne kontsentratsioon [M -molaarne]
- n-aine moolide arv [mol]
- V-lahuse ruumala [l - liiter]

| 1 | 1 | ||||
|---|---|---|---|---|---|
| 2 | 2 | 3 | |||
| 3 | 4 | 5 | 7 | ||
| 4 | 6 | 8 | 10 | 13 | |
| 5 | 9 | 11 | 14 | 17 | 21 |
| 6 | 12 | 15 | 18 | 22 | |
| 7 | 16 | 19 | 23 | ||
| 8 | 20 | 24 |
| Nimetus | Märge | Vahemik | Märkused |
|---|---|---|---|
| peakvantarv | n | 1, 2, 3, jne | |
| magnetkvantarv | l | 0, 1, 2, jne. n-1 | |
| orbitaalkvantarv | m | -l kuni -l+1 ( 0 kaasaarvatud) | |
| spinn | s | +½ või -½ | |
| Tabel ei pruugi olla täiesti korrektne | |||
| Näiteid eelneva tabeli põhjal | ||||
|---|---|---|---|---|
| Kiht | Alamkiht | Orbitaalid | Elekrtonid | |
| n = 5 | l = 0 | m = 0 | → 1 (s orbitaali tüüp) | → max 2 elektroni |
| l = 1 | m = -1, 0, +1 | → 3 (p orbitaali tüüp) | → max 6 elektroni | |
| l = 2 | m = -2, -1, 0, +1, +2 | → 5 (d orbitaali tüüp) | → max 10 elektroni | |
| l = 3 | m = -3, -2, -1, 0, +1, +2, +3 | → 7 (f orbitaali tüüp) | → max 14 elektroni | |
| l = 4 | m = -4, -3 -2, -1, 0, +1, +2, +3, +4 | → 9 (g orbitali tüüp) | → max 18 elektroni | |
| Kokku: max 50 elektroni | ||||
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pt, Au
Hape on keemiline aine, mis vesilahustes dissotsieerudes annab lahusesse vesinikioone.
| Happed | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Aineklass | Triviaalnimetus(ed) | Valem | Tugevus | Sulamis °t | Keemis °t | Tihedus g/cm3 | Mol. mass g/mol | Pilt | Eng. Viki |
| Väävelhape | - | H2SO4 | tugev | 10 | 336 | 1,84 | 98 |  |
|
| Väävlishape | - | H2SO3 | 82 | 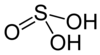 |
|||||
| Fosforhape | - | H3PO4 | 42.35 | 158 | 1,685 | 98 |  |
||
| Süsihape | - | H2CO3 | nõrk | 1,0 | 62 | 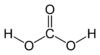 |
|||
| Vesinikkloriidhape | Soolhape | HCl | -26[2] | 48[2] | 36,5 |  |
|||
| Lämmastikhape | varem: salpeeterhape kontsentreerituna: suitsev lämmastikhape |
HNO3 | tugev | -42 | 83 | 1,522 | 63 |  |
|
| Lämmastikkushape | HNO2 | 47 | |||||||
| Boorhape | H3BO3 | ||||||||
| Vesinikbromiidhape | HBr | tugev | |||||||
| Kloorhape | HClO3 | 84,5 |  |
||||||
| Vesinikjodiidhape | tugev | ||||||||
| Hüpokloorishape | HClO | 52 |  |
||||||
| Vesiniktsüaniidhape | Sinihape[3] | HCN | -13.4 | 26 | 0,687 | 27 | |||
| Etaandihape | Oblikhape | HOOC-COOH | tugev orgaaniline hape |
 |
|||||
| Metaanhape | Sipelghape | HCOOH | 8,4 | 100,7 | 1,227 |  |
|||
| Etaanhape | Äädikhape | CH3-COOH | 16,6 | 118,1 | 1,049 |  |
|||
| Heksadekaanhape | Palmithape | C15H31-COOH | 64,6[1] | 272[1] | 0,849 | ||||
| Heptadekaanhape | Margariinhape | C16H33-COOH | 60,6[1] | 277[1] | 0,858 | ||||
| Oktaandihape | Korkhape | HOOC-(CH2)6-COOH | 140 | ||||||
| Propeenhape | Akrüülhape | CH2=CH-COOH | 13 | 141 | 1,051 | 72 |  |
||
| Kroomhape | CH2CrO4 | 117 | - | ||||||
| Dikroomhape | C2Cr2O7 | ||||||||
| [1] Rõhul 100 mg Hg; [2] 38% lahus; [3] 2-3 mg organismi kohta on surmav (sinihape peatab hingamisahela tegevuse juba väga väikeses konsentratsioonis) | |||||||||

Karboksüülhapped
Karboksüülhapped on orgaanilises keemias happed, mis sisaldavad karboksüülrühma (COOH).
Aminohapped
Keemilise reaktsiooni kiirust näitab ajaühikus ruumalaühiku kohta tekkinud või reageerinud ainehulk (moolides).
Reaktsiooni kiirendavad:
- temperatuuri tõstmine
- kontsentratsiooni suurendamine
- gaaside korral rõhu suurendamine
- tahkete ainete peenestamine
- katalüsaatori kasutamine
Alus on keemiline aine, mis vesilahustes dissotsieerudes annab lahusesse hüdroksiidioone (-OH).
| Happed | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Aineklass | Triviaalnimetus(ed) | Valem | Tugevus | Sulamis °t | Keemis °t | Tihedus g/cm3 | Mol. mass g/mol | Pilt | Eng. Viki |
| Naatriumhüdroksiid | Sooda | NaOH | |||||||
| Kaaliumhüdroksiid | KOH | ||||||||
| Kaltsiumhüdroksiid | Kustutatud lubi | Ca(OH)2 | |||||||
| Alumiiniumhüdroksiid | Al2(OH)3 | ||||||||
| Baariumhüdroksiid | Ba(OH)2 | ||||||||
| Liitiumhüdroksiid | LiOH | ||||||||
| [[]] | |||||||||
| [[]] | |||||||||
| [1] ???; | |||||||||
pH ehk Vesinikeksponent
| Aine | pH |
|---|---|
| Vesinikkloriidhape, 10M | |
| Pliiaku hape | |
| Maohape | |
| Sidrun | |
| Coca-cola | |
| Äädikhape | |
| Apelsini või õuna mahl | |
| Õlu | |
| Happevihm | |
| Kohv | |
| Tee või normaalne nahk | |
| Piim | |
| Puhas vesi | |
| Inimese sülg | |
| Veri | |
| Merevesi | |
| Seep | |
| Ammoniaak | |
| Pesuvalgendi | |
| Naatriumhüdroksiid | |
| Sooda - NaOH |
Vesinikeksponent ehk pH on negatiivne logaritm lahuse vesinikioonide kontsentratsioonist (mol/l).
Matemaatiliselt näeb pH arvutamise valem välja järgmine:
pH = -log [H+], kus [H+] on lahuse vesinikioonide kontsentratsioon (mol/l).
pH arvutamise näide:
Oletame, et vihmavee vesinikioonide kontsentratsioon on 1,5 10-4 M
Vastavalt valemile pH = - log 1,5 10-4 = 3,82
3,82 on normaalse vihmavee kohta liiga happeline, mis tähendab seda, et tegemist on happevihmaga.
Amiinid on ammoniaagi asendusderivaadid, mis on saadud ühe või mitme vesiniku asendamisel alküülrühmaga.
Joove
- Kerge: 0,5-2‰ (veres); liigutuste elavnemine, meeleolu kõrgenemine
- Keskmine: 2-3 ‰; loidus, liikumis-, kõne- ja mäluhäired
- Raske: 3-4 ‰; hingamis- ja vereringehäired, eluohtlik
- Surmav kogus on 6-8 ml etanooli 1kg kehakaalu kohta
Tärklis
Tärklis on puhtal kujul on vees lahustumatu, lõhnatu ja maitsetu valge pulber.
Struktuur
- Amüloos - n kuni 6000 glükoosi jääki, spiraalne, hargnemata ahel (1-4 sidemed)
- Amülopektiin - n kuni 1 miljon glükoosi jääki, hargnenud ahel (1-4 sidemed, hargnemiskohtades 1-6 sidemed)
Omadused:
- Hügroskoopne; vees ei lahustu, vaid pundub
- Soojendamisel tekib kliister
Hüdrolüüs:
- tärklis --> dekstriinid --> maltoos --> glükoos
Tärklis on energeetiline varuaine.
Tselluloos
Struktuur - -glükoosi jäägid
- n kuni 10 000
- hargnemata ahelad, mis ühinevad omavahel vesiniksidemete abil
Omadused:
- Hüdrofiilne, ei lahustu vees
Hüdrolüüs: tselluloos --> lühemad ahelad --> glükoos
Tselluloos on levinuim polüsahhariid Maal.
Kasutamine:
- paber, looduslikud ja tehiskiud, etanool, lõhkeained jt.
Valgud on lämmastikku sisaldavad kõrgmolekulaarsed orgaanilised ained, mida iseloomustab komplitseeritud struktuur ja bioloogiline spetsiifilisus.
"Valkude" kõrval on kasutusel olnud ka nimetus "proteiinid" (kreeka protos 'esimene, tähtsaim'), mille võttis 1839. aastal kasutusele G. J. Mulder.
Valkude tüübid
Valkude tüübid: (tinglik valkude paigutus erinevatesse rühmadesse)
- Struktuursed valgud on tüüpilised ehitusained loomorganismides, mis moodustavad rakke, kudesid ja organeid ühenduses süsivesinike ja lipiididega. Tähtsamad on kollageenid, elastiinid ja keratiinid.
- Ensüümvalgud on valgud, mida iseloomustab suur katalüütiline aktiivsus. Väga olulisel kohal näiteks maksas (kus võivad luua ja väljastada suures koguses seedeensüüme) ja ajus.
- Transportvalgud on valgud, mis paiknevad põhiliselt vedelates kudedes (kehavedelikes) ja rakumembraanides. Näiteks hemoglobiin, mis kannab edasi hapnikku, lipoproteiinid, mis kannavad edasi rasvhappeid ja transferriinid, mis kannavad edasi rauaioone.
- Kaitsevalgud on valgud mis moodustuvad organismi kaitseks infektsiooni korral.
- Kontraktiilsed valgud on valgud, mis rakendavad lihaste kontraktsiooni. On võimelised keemilist energiat mehhaaniliseks energiaks muutma. Näiteks aktiin ja müosiin.
- Retseptoorsed valgud on organretseptorites (loe: meeleelundites) paiknevad valgud, millede ülessandeks on informatsiooni vastuvõtmine välismaailmast. Näiteks: rodopsiin.
- Regulatoorsed valgud on organite ja organisüsteemide talituse kooskõlastamisest osavõtvad valgud. Polüpeptiid- ja valkhormoonid (glükagoon, insuliin, hüpofüüsi eessagara hormoonid jt.)
- Depoovalgud on mõningaid spetsiifilisi aineid ladestavad valgud.
- Eksporditavad valgud on näiteks munavalgud, piimavalgud ja spermavalgud.
Valkude keemiline koostis
| Valkude keemiline koostis | ||
|---|---|---|
| süsinik | 48 - 55 % | |
| hapnik | 20 - 34 % | |
| lämmastik | 15 - 19,5 % | |
| vesinik | 5 - 7,5 % | |
| väävel | 0,3 - 2,5 % | |
Märkus: Lisaks paljusid teisi elemente, mis võimaldavad valgul täita mingit ülessannet aga nende ainete protsentuaalne sisaldus on väga madal. Näiteid: hemoglobiin ja raud, kilpnäärme hormoonid ja jood.
Valkude molekulmasse
| Näiteid valkude molekulmassidest | ||
|---|---|---|
| Valk | Molekulmass | |
| Ribonukleaas | 13 700 | |
| Hobuse müoglobiin | 16 900 | |
| Pepsiin | 45 000 | |
| Hobuse hemoglobiin | 68 000 | |
| Sea türeoglobuliin | 630 000 | |
| Taimne viirus | 10 600 000 | |
Valkude klassifikatsioon
Proteiinid ehk lihtvalgud
- Albumiinid
- Globuliinid
- Histoonid
- Prolamiinid ja gluteliinid
- Protamiinid
- Skleroproteiinid
Proteiidid ehk lihtvalgud
- Fosfoproteiidid
- Kromoproteiidid
- Lipoproteiidid
- Mukoproteiidid
- Nukleoproteiidid
Alkaloidid

Alkaloidid (< araabia al-qālī 'leelis' + kreeka eidos 'välimus, kuju') on lämmastikku sisaldavad, vees lahustumatud, aluseliste omadustega ja hapetega vees lahustavaid sooli moodustavad keemilised ained.
Alkaloide sisaldavaid taimi on inimkond kasutanud juba väga kaugel ajal joovastavate ainete või ravimitena.
Esimese puhta alkaloidi, morfiini, eraldas oopiumist 1806. aastal saksa apteeker Friedrich Sertürner. Esimese sünteesitud alkaloidi, koniini, valmistas 1886. aastal Albert Ladenburg.
- Leiduvad taimedes (~3000)
- Moodustavad hapetega lahustuvaid sooli
- Tugev füsioloogiline toime: väikeses koguses avaldavad ravivat toimet, suures koguses väga mürgised

Alkaloide:
- Nikotiin (C10H14N2; puhtal kujul vees hästi lahustuv õlijas vedelik; keskmisele mehele on surmav kogus nikotiini 40 mg; on leitav maavitsa perekonna taimedest (Solanaceae), eriti tubakast ja vähemal määral tomatist, kartulist, baklažaanist, rohelisest piprast ning kokapõõsa lehtedest)
- Kokaiin (C17H21NO4; saadakse kokapõõsa lehtedest; toimid kesknärvisüsteemi stimulandina (ergutina) ning söögiisu vähendajana, mis loob tarbides eufoorilise heaolutunde ning kõrgenenud energiatunde)
- Kofeiin (taimedes mõjub kofeiin pestitsiidina, tappes putukad, kes seda taime söövad; leidub kohvipuu ubades, teepuu lehtedes ja väheses koguses kakaos)
- Kuraare
- Atropiin (C17H23NO3; saadakse karumustikast ehk belladonnast; atropiin lõõgastab silelihaseid, kiirendab südametegevust, laiendab veresooni ja silmapupille; nimi tuleneb sellest, et teda kasutati omal ajal daamide poolt silmade suurendamise vahendina (bella donna 'kena daam'); väga mürgine)
- Hiniin
- Morfium (C17H19NO3; nimi tuleb Vana-Kreeka unejumala Morpheuse nimest; meditsiinis kasutatav valuvaigistina; suured kogused on surmavad (tekib hingamiskeskuse paralüüs); kergesti tekib sõltuvus)
- Heroiin
- Kodeiin
- Solaniin (C45H73NO15; põhiliselt kartulis esinev mürgine alkaloid)
- Hüostsüamiin (väga mürgine, koera-pöörirohule omane, keemiliselt lähedane atropiinile)
- Akoniitiin (C34H47NO11; sisaldub käokinga (Aconitum) liikides; inimesele surmav koguses 1-2 mg (kahjustab südametegevust ja hingamist))
- jne... (jeroiin, protoveratrin, tšakoniin, koniin , skopolamiin, teofelliin, teobromiin, efedriin , meskaliin, lobeliin, hüdriin, anabasiin, papaveriin jt.)
Allotroopia on kui üks element esineb mitme lihtainena. Vastavad lihtained nimetatakse allotroobideks e. allotroopseteks teisenditeks.
Põhjused:
- Erinev arv aatomeid molekulis. Näiteks hapnik (O2) ja osoon (O3).
- Erinev aine ehitus. Näiteks teemant ja grafiit koosnevad mõlemad 100% süsinikust aga ainete omadused erinevad väga suurel määral kuna süsinikuaatomid on ainetes erinevalt paigutatud.
- Kasutaja:Iffcool/Keemilised elemendid
- Keemia
- Keemikute loend
- Kategooria:Keemikud
- Keemiliste elementide loend
- Keemiliste ainete loend
- Kategooria:Keemia loendid
- Keemilised elemendid
- Keemia mõisteid
- Orgaaniline keemia
- Sulamite loend
- Kategooria:Sulamid
- Termodünaamika
- Füüsikaline keemia
- Geokeemia
- Biokeemia
- Kolloidkeemia
- Keskkonnakeemia
- Kodukeemia
- Materjaliteadus
| Pildid, videod ja helifailid Commonsis: Orgaaniline keemia |
| Pildid, videod ja helifailid Commonsis: Keemia |
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.




 ,
,  ...
...


