Υδροξείδιο του ασβεστίου
From Wikipedia, the free encyclopedia
Το υδροξείδιο του ασβεστίου (Calcium hydroxide), που συνήθως ονομάζεται σβησμένη άσβεστος, είναι ανόργανη ένωση με τον χημικό τύπο Ca(OH)2. Είναι άχρωμη κρυσταλλική ή λευκή σκόνη και λαμβάνεται όταν αναμειγνύεται το οξείδιο του ασβεστίου με νερό. Έχει αρκετά ονόματα μεταξύ των οποίων σβησμένη άσβεστος, γάλα ασβέστου, καυστική άσβεστος, ένυδρη άσβεστος. Το υδροξείδιο του ασβεστίου χρησιμοποιείται σε πολλές εφαρμογές που περιλαμβάνουν και την προετοιμασία του φαγητού.
 | |
| Ονόματα | |
|---|---|
| ΟνοματολογίαIUPAC
Υδροξείδιο του ασβεστίου | |
| ΆλλαΟνόματα
Σβησμένη άσβεστος Γάλα ασβέστου Καυστική άσβεστος Ένυδρη άσβεστος Σβησμένος ασβέστης | |
| Αναγνωριστικά | |
| 1305-62-0 | |
| ChEBI | CHEBI:31341 |
| ChemSpider | 14094 |
| Αριθμός_EC | 215-137-3 |
| 846915 | |
InChI=1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 Key: AXCZMVOFGPJBDE-UHFFFAOYSA-L InChI=1/Ca.2H2O/h;2*1H2/q+2;;/p-2 Key: AXCZMVOFGPJBDE-NUQVWONBAD | |
| Jmol 3Δ Πρότυπο | Image Image |
| KEGG | D01083 |
| PubChem | 14777 |
| Αριθμός RTECS | EW2800000 |
[Ca+2].[OH-].[OH-] [OH-].[OH-].[Ca+2] | |
| UNII | PF5DZW74VN |
CompTox Dashboard (EPA) |
|
| Ιδιότητες | |
| Ca(OH)2 | |
| Μοριακή μάζα | 74,093 g/mol |
| Εμφάνιση | Λευκή σκόνη |
| Οσμή | Άοσμο |
| Πυκνότητα | 2,211 g/cm3, στερεό |
| Σημείο τήξης | 580 °C (1,076 °F; 853 K) (χάνει νερό, αποσυντίθεται) |
| Διαλυτότητα στο νερό | 0,189 g/100 mL (0 °C) 0,173 g/100 mL (20 °C) 0,066 g/100 mL (100 °C) |
Γινόμενο διαλυτότητας (Ksp) |
5,5 × 10−6 |
| Διαλυτότητα | Διαλυτό σε γλυκερίνη και οξέα. Αδιάλυτο σε αλκοόλες. |
| Οξύτητα (pKa) | 12,4 |
| Βασικότητα (pKb) | 2,37 |
Δείκτης διάθλασης (nD) |
1,574 |
| Θερμοχημεία | |
Πρότυπη μοριακή εντροπία (S |
83 J·mol−1·K−1[1] |
Πρότυπη ενθαλπία σχηματισμού (ΔfH |
−987 kJ·mol−1[1] |
| Κίνδυνοι | |
| Δελτίο δεδομένων ασφάλειας | [2] |
| Φράσεις-R | R22, R34 |
| Φράσεις-S | S2, S24 |
| Σημείο ανάφλεξης | Μη αναφλέξιμο |
| Θανάσιμη δόση ή συγκέντρωση (LD, LC): | |
LD50 (μέση θανατηφόρα δόση) |
7340 mg/kg (στοματικά, επιμύες) 7300 mg/kg (ποντίκι) |
| Όρια έκθεσης υγείας ΗΠΑ (NIOSH): | |
PEL (Επιτρεπτό) |
TWA 15 mg/m3 (total) 5 mg/m3 (resp)[3] |
REL (Συνιστώμενο) |
TWA 5 mg/m3[3] |
IDLH (Άμεσος κίνδυνος) |
N.D.[3] |
| Σχετικές ενώσεις | |
Άλλα Κατιόντα |
Υδροξείδιο του μαγνησίου Υδροξείδιο του στροντίου Υδροξείδιο του βαρίου |
| Οξείδιο του ασβεστίου | |
| (verify) Τι είναι /?) | |
Ιδιότητες
Το υδροξείδιο του ασβεστίου είναι σχετικά διαλυτό στο νερό, με γινόμενο διαλυτότητας Ksp 5,5 × 10−6. Το γινόμενο διαλυτότητας είναι αρκετά μεγάλο ώστε να διαλύσει μερικώς το υδροξείδιο του ασβεστίου και να ελευθερώσει ανιόντα υδροξειδίου (OH-) σε διάλυμα σύμφωνα με την παρακάτω αντίδραση:
- Ca(OH)2 → Ca2+ + 2 OH-
Σε θερμοκρασία περιβάλλοντος, το υδροξείδιο του ασβεστίου (πορτλαντίτης) μπορεί να διαλυθεί σε καθαρό νερό για να παραγάγει ένα αλκαλικό διάλυμα με pH περίπου 12,4. Τα διαλύματα του υδροξειδίου του ασβεστίου μπορούν συνεπώς να προκαλέσουν σοβαρά χημικά εγκαύματα. Η διαλυτότητα του υδροξειδίου του ασβεστίου εξαρτάται πολύ από την τιμή του pH. Σε υψηλές τιμές pH, παρουσία αλκαλικών υδροξειδίων (NaOH, KOH), όπως στο πρόσφατο μείγμα τσιμέντου-νερού, η διαλυτότητα του υδροξειδίου του ασβεστίου πέφτει δραστικά.
Το αιώρημα λεπτά διαμερισμένου υδροξειδίου του ασβεστίου σε νερό ονομάζεται γάλα ασβέστου. Το διάλυμα λέγεται ασβεστόνερο και είναι μέτριας ισχύος βάση που αντιδρά με οξέα και μπορεί να προσβάλει μερικά μέταλλα όπως το αργίλιο (αμφοτερικό υδροξείδιο που διαλύει σε υψηλά pH), ενώ προστατεύει άλλα μέταλλα από τη διάβρωση όπως ο σίδηρος και ο χάλυβας με παθητικοποίηση των επιφανειών τους. Το ασβεστόνερο γίνεται γαλακτώδες παρουσία διοξειδίου του άνθρακα λόγω του σχηματισμού ανθρακικού ασβεστίου:
- Ca(OH)2 + CO2 → CaCO3 + H2O
Όταν θερμανθεί στους 512 °C, η μερική πίεση του νερού σε ισορροπία με το υδροξείδιο του ασβεστίου φτάνει τα 101 kPa (κανονική ατμοσφαιρική πίεση), που αποσυνθέτει το υδροξείδιο του ασβεστίου σε οξείδιο του ασβεστίου και νερό.[4]
- Ca(OH)2 → CaO + H2O
Δομή, παρασκευή, εμφάνιση

Το υδροξείδιο του ασβεστίου υιοθετεί μια πολυμερική δομή, όπως κάνουν και τα αντίστοιχα υδροξείδια των αλκαλικών γαιών. Η δομή μοιάζει με τη δομή του ιωδιούχου καδμίου με στρώματα από οκταεδρικά κέντρα Ca. Υπάρχουν ισχυροί δεσμοί υδρογόνου μεταξύ των στρωμάτων.[5]
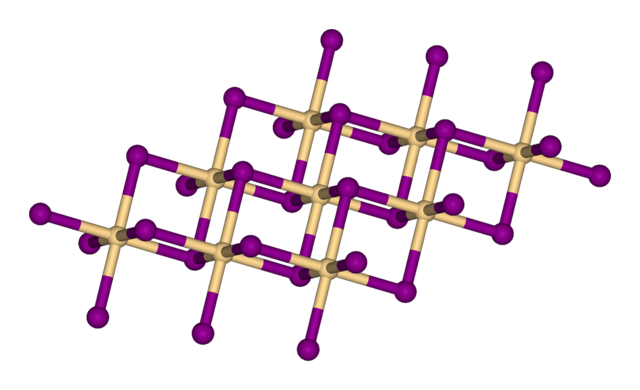
Το υδροξείδιο του ασβεστίου παράγεται εμπορικά με επεξεργασία της ασβέστου με νερό:
- CaO + H2O → Ca(OH)2
Στο εργαστήριο μπορεί να προετοιμαστεί με ανάμειξη υδατικών διαλυμάτων χλωριούχου ασβεστίου και υδροξειδίου του νατρίου. Η ορυκτή μορφή, ο πορτλαντίτης, είναι σχετικά σπάνιος, αλλά μπορεί να βρεθεί σε μερικά ηφαιστειογενή, πλουτωνικά και μεταμορφωσιγενή πετρώματα. Είναι επίσης γνωστό ότι εμφανίζεται σε χώρους απόθεσης καύσης άνθρακα. Υδροξείδιο του ασβεστίου έχει ανιχνευθεί επίσης στην ατμόσφαιρα των αστέρων τύπου S.[6]
Χρήσεις
Μια σημαντική εφαρμογή του υδροξειδίου του ασβεστίου είναι ως κροκιδωτής, στο νερό και στην επεξεργασία λυμάτων. Σχηματίζει ένα φορτισμένο στερεό που βοηθά στην αφαίρεση μικρότερων σωματιδίων από νερό, καταλήγοντας σε ένα πιο καθαρό προϊόν. Αυτή η εφαρμογή χαρακτηρίζεται από μικρό κόστος και τη χαμηλή τοξικότητα του υδροξειδίου του ασβεστίου. Χρησιμοποιείται επίσης στην επεξεργασία πρόσφατου νερού για την αύξηση του pH του νερού, έτσι ώστε οι σωλήνες να μην διαβρώνονται όπου το νερό είναι όξινο, επειδή είναι αυτορρυθμιζόμενη και δεν αυξάνει υπερβολικά το pH.
Χρησιμοποιείται, επίσης στην παρασκευή της αέριας αμμωνίας, ως εξής:
Ca(OH)2 + 2NH4Cl → 2NH3 + CaCl2 + 2H2O
Μια άλλη εφαρμογή είναι στη χαρτοβιομηχανία, όπου είναι ένα ενδιάμεσο προϊόν στην αντίδραση παραγωγής του υδροξειδίου του νατρίου. Αυτή η μετατροπή είναι ένα τμήμα του βήματος της καυστικοποίησης στη μέθοδο Κραφτ για παραγωγή πολτού. [5] Στη διεργασία καυστικοποίησης προστίθεται μη εσβεσμένη άσβεστος στο πράσινο διάλυμα που είναι ένα διάλυμα που αποτελείται κυρίως από ανθρακικό νάτριο και θειικό νάτριο που παράγεται διαλύοντας το τήγμα, που είναι η λιωμένη μορφή αυτών των χημικών από τον φούρνο ανάκτησης.
Βιομηχανία τροφίμων
Λόγω της χαμηλής τοξικότητας του και της ηπιότητας των βασικών του ιδιοτήτων, η σβησμένη άσβεστος χρησιμοποιείται ευρέως στη βιομηχανία τροφίμων για:
- τον καθαρισμό του ακατέργαστου χυμού ζαχαροκάλαμου ή ζαχαρότευτλων στη βιομηχανία ζάχαρης
- την επεξεργασία του νερού για αλκοολούχα ποτά και αναψυκτικά
- αγγούρια σε τουρσιά και άλλα τρόφιμα
- την παρασκευή κινέζικων αβγών του αιώνα (century eggs)
- την παρασκεή τορτίγιας καλαμποκιού (βοηθά το καλαμποκάλευρο να δέσει)
- τον καθαρισμό της άλμης των ανθρακικών του ασβεστίου και του μαγνησίου στην παρασκευή άλατος για τρόφιμα και φαρμακευτικές χρήσεις
- ενίσχυση (συμπλήρωμα Ca) σε ποτά φρούτων, όπως στον χυμό πορτοκαλιού και τις βρεφικές τροφές
- βοήθεια στην πέψη (που ονομάζεται τσούνα (Choona) και χρησιμοποιείται στην Ινδία στο πάαν (paan), ένα μείγμα από αρέκα, υδροξείδιο του ασβεστίου και μια ποικιλία καρπών τυλιγμένων σε φύλλα ινδοκάρυδου (betel leaves))
- υποκατάστατο της μαγειρικής σόδας στην παρασκευή παπαντάμ (papadam).
Ιθαγενείς αμερικανικές χρήσεις

Στα ισπανικά το υδροξείδιο του ασβεστίου ονομάζεται cal. Το καλαμπόκι μαγειρεμένο με cal γίνεται hominy (nixtamal), που αυξάνει σημαντικά τη βιοδιαθεσιμότητα της νιασίνης και θεωρείται επίσης πιο γευστικό και εύπεπτο.
Στο μάσημα φύλλων κόκας, το υδροξείδιο του ασβεστίου μασιέται συνήθως μαζί τους για να διατηρήσει τους αλκαλοειδείς διεγέρτες χημικά διαθέσιμους για απορρόφηση στο λεπτό έντερο από το σώμα. Παρόμοια, ιθαγενείς Αμερικανοί μασούν παραδοσιακά φύλλα καπνού με υδροξείδιο του ασβεστίου που παράγεται από καμμένα κελύφη μαλακίων για να βελτιώσουν τα αποτελέσματα. Έχει επίσης χρησιμοποιηθεί από κάποιες ιθαγενείς αμερικάνικες φυλές ως συστατικό στο γιόπο (yopo), ένα ψυχεδελικό ταμπάκο που προετοιμάζεται από φασόλια κάποιων ειδών Anadenanthera.[7]
Ασιατικές χρήσεις
Το υδροξείδιο του ασβεστίου προστίθεται συνήθως σε μια δέσμη από καρύδια αρέκα και φύλλα μπέτελ για να κρατήσει τους αλκαλοειδείς διεγέρτες χημικά διαθέσιμους για να μπουν στο αίμα μέσω της υπογλώσσιας απορρόφησης.
Αφγανικές χρήσεις
Το υδροξείδιο του ασβεστίου χρησιμοποιείται στην παρασκευή naswar, ενός τύπου καπνού με εμβάπτιση που παρασκευάζεται από πρόσφατα φύλλα καπνού, υδροξείδιο του ασβεστίου (chuna) και τέφρα ξύλου. Καταναλώνεται κυρίως από τους Παστούν, στο Αφγανιστάν, στο Πακιστάν, στην Ινδία, στο Μπανγκλαντές καθώς και στη Σουηδία και τη Νορβηγία. Το υδροξείδιο του ασβεστίου χρησιμοποιείται επίσης από χωρικούς για να βάφουν τα σπίτια τους από λάσπη στο Αφγανιστάν, στο Πακιστάν και την Ινδία.
Κίνδυνοι υγείας
Απροστάτευτη έκθεση στο Ca(OH)2 μπορεί να προκαλέσει κινδύνους υγείας και συνεπώς πρέπει να είναι περιορισμένη. Μπορεί να προκαλέσει σοβαρό δερματικό ερεθισμό, χημικά εγκαύματα, τύφλωση ή πνευμονική βλάβη. Δείτε το MSDS.[2]
Παραπομπές
Εξωτερικοί σύνδεσμοι
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

