Redoxpotential
Messgröße bei Redoxreaktionen Aus Wikipedia, der freien Enzyklopädie
Das Redoxpotential (korrekte Bezeichnung nach DIN 38404-6 Redox-Spannung) bezeichnet eine Messgröße in der Chemie zur Beschreibung von Redoxreaktionen. Bei der Messgröße handelt es sich um das Reduktions-/Oxidations-Standardpotential eines Stoffes, gemessen unter Standardbedingungen gegen eine Standard-Referenz-Wasserstoffhalbzelle.
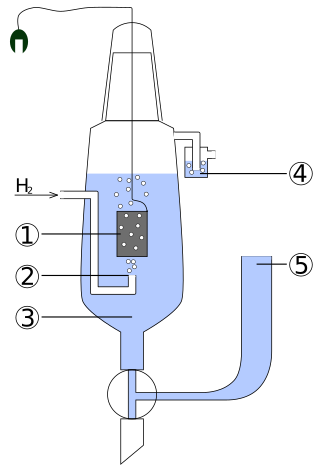
1 – Platinelektrode
2 – Wasserstoffeinstrom
3 – Lösung mit Säure (cH+ = 1 mol/l)
4 – Abschluss zur Vermeidung von Störungen durch Sauerstoff
5 – Reservoir
Es ist zu unterscheiden (s. Abschnitt Grundlagen) zwischen
- dem Redoxpotential Eo (bzw. Eo', s. u.) eines Stoffes / Halbelements / Redoxpaares und
- dem Redoxpotential einer Redoxreaktion, die immer aus zwei Redoxpaaren besteht:
In biochemischen Systemen ist das Standardredoxpotential definiert beim pH 7,0 gegen eine Standard-Wasserstoffelektrode und bei einem Partialdruck von Wasserstoff von 1 bar.[1]
Das Redoxpotential entspricht dem Elektronenunterschied an der Grenzoberfläche eines Stoffes innerhalb eines Lösungsmittels aus der Hydration gegensätzlich geladener Ionen.
Grundlagen
Zusammenfassung
Kontext
Allgemeines
Während bei Säure-Base-Reaktionen H+-Ionen (Protonen) von einem Partner zum anderen wechseln, wechseln bei Redox-Reaktionen Elektronen den Partner.
Jede Redoxreaktion kann in zwei Halbreaktionen und damit in zwei Redox-Paare aufgeteilt werden:
- der eine Partner (das Reduktionsmittel) gibt Elektronen ab, d. h. er wird oxidiert mit dem Oxidationspotential des anderen Partners als Triebkraft.
- der andere Partner (das Oxidationsmittel) nimmt Elektronen auf, d. h. er wird reduziert mit dem Reduktionspotential des anderen Partners als Triebkraft.
Redoxpotential eines Stoffes
- Das Reduktionspotential einer einzelnen Substanz (Element, Kation, Anion, Redoxpaar, Reduktionsmittel) beschreibt ihre Reduktionskraft: diese Größe ist ein Maß für die Bereitschaft, Elektronen abzugeben, damit in die oxidierte Form überzugehen und einem Reaktionspartner für seine Reduktion Elektronen zur Verfügung zu stellen. Je negativer ein Redoxpotential, desto höher die Reduktionskraft der Substanz. So ist z. B. das Metall Lithium mit einem Redoxpotential von −3,04 V ein sehr starkes Reduktionsmittel.
Und umgekehrt:
- Das Oxidationspotential einer einzelnen Substanz (Element, Kation, Anion, Redoxpaar, Oxidationsmittel) beschreibt ihre Oxidationskraft: diese Größe ist ein Maß für die Bereitschaft, Elektronen (aus der Oxidation eines Reaktionspartners) aufzunehmen und damit selbst in die reduzierte Form überzugehen. Je positiver ein Redoxpotential, desto höher die Oxidationskraft der Substanz. So ist z. B. das Nichtmetall Fluor mit einem Redoxpotential von +2,87 V das stärkste Oxidationsmittel.
Gemäß einer Konvention wird als Redoxpotential einer Substanz ihr Reduktionspotential (und nicht ihr Oxidationspotenial) bezeichnet.
Redoxpotential einer Redoxreaktion
Das Redoxpotential der beiden Partner bzw. der Gesamtreaktion ergibt sich als Summe von Oxidationspotential und Reduktionspotential. Je „leichter“ ein Partner oxidiert und der andere Partner reduziert wird, desto höher der Wert des gemeinsamen Redoxpotentials.[1]
Elektronen fließen vom Redoxpaar mit negativerem Potential zum Redoxpaar mit dem positiveren Potential Anschaulich entspricht das Redoxpotential dem Elektronenmangel- oder -überschuss an der Grenzoberfläche einer eingetauchten Elektrode in einem polaren Lösungsmittel; meist handelt es sich bei diesem Lösungsmittel um Wasser.
So werden z. B. an einer Zink-Oberfläche durch Wassermoleküle Zink-Kationen hydratisiert und herausgelöst, wodurch überschüssige Elektronen in der Elektrode zurückbleiben und ein negatives Redoxpotential bilden.[2] In einem Gesamtsystem wie einer Batterie können die überschüssigen Elektronen wiederum zur Gegenelektrode eines weniger negativen Redoxpotentials fließen.
Standardpotentiale

Da Redoxpotentiale von äußeren Bedingungen wie Druck, Temperatur oder dem pH-Wert abhängen, wurde zur besseren Vergleichbarkeit ein Standardzustand definiert, in dem sich die in der Elektrochemischen Spannungsreihe stehenden Halbelemente befinden. In diesem Zustand herrschen die Standardbedingungen:
Beispiel: Kaliumpermanganat ist ein starkes Oxidationsmittel; die Oxidationskraft und damit das Redoxpotential hängen aber beträchtlich vom pH-Wert ab. Wird Kaliumpermanganat mit einem Reduktionsmittel versetzt, so entstehen:
- bei pH = 1: Mangan(II)-Kationen
- bei pH = 7: Mangan(IV)-oxid (Braunstein)
- bei pH = 14 Manganat(VI)-Ionen.
Die Umrechnung vom Standardzustand zu jedem beliebigen anderen Zustand gelingt über die Nernst-Gleichung.
Messung und Quantifizierung
Zusammenfassung
Kontext
Neben der oben erwähnten Berechnung über die Nernst’sche Gleichung stehen noch verschiedene Messmethoden zur Bestimmung von Redoxpotentialen zur Verfügung:

Das Standard-Redoxpotential eines Halbelements lässt sich ermitteln durch Aufbau eines Galvanischen Elements mit der Wasserstoffelektrode und Messung der elektrischen Spannung. Dafür müssen aber beide Systeme im Standardzustand vorliegen.
Redoxpotentiale sind auch zugänglich durch Ermittlung der Spannung beim Zusammenschalten mit anderen Halbelementen, deren Redoxpotential bereits bekannt ist. Aus diesem Grund wird in der Praxis oft auf andere Halbelemente als Bezugselemente zurückgegriffen. Gängig ist z. B. die Kalomel-Elektrode, da mit ihr Potentialschwankungen durch Temperaturänderungen zu geringeren Messfehlern als bei der Wasserstoffelektrode führen.
| Temperatur | Potentialdifferenz |
|---|---|
| + 18 °C | + 0,2511 V |
| + 20 °C | + 0,2496 V |
| + 22 °C | + 0,2481 V |
Wie aus der Tabelle ersichtlich, schwanken die Redoxpotentiale an einer Kalomel-Elektrode bei Erhöhung oder Erniedrigung um 2 K jeweils nur um rund 0,6 %.
Redoxpotentiale in der Biochemie
Zusammenfassung
Kontext
Für biochemische Vorgänge rechnet man mit den auf pH 7 bezogenen Potentialen Eo'. Für Reaktionen, an denen Protonen beteiligt sind, ergibt sich somit eine Potentialdifferenz von 0,413 V, wie in der nachfolgenden Tabelle angegeben.
- Bitte beachten:
- Werden Redoxpotentiale als Eo oder Eo' angegeben (Tabelle), so bezeichnen sie formal das Potential relativ zur Normal-Wasserstoffelektrode.
- Das Redoxpotential eines Halbelements relativ zu einer anderen Bezugselektrode als Normalwasserstoff ergibt sich durch vorzeichenrichtige Addition bzw. Subtraktion zweier Werte aus nachstehender Tabelle:
- dem Wert für die betrachtete Halbzelle und
- dem Wert für die betrachtete Bezugselektrode.
- Das n bezeichnet die Anzahl der Elektronen, die während der Redoxreaktion übertragen werden.
- Nach allgemeiner Konvention bezieht sich das Formalpotential E0 bzw. E0' auf das Reduktionspotential. Daher steht auf der linken Seite der Tabelle die Reduktionsreaktion.
| Oxidierte Form / Reduzierte Form | Äquivalentzahl n | Eo in V bei pH 0 | Eo' in V bei pH 7 |
|---|---|---|---|
| Ferredoxin Fe3+/Fe2+ | 1 | −0,43 | −0,43 |
| 2 H+/ H2 | 2 | 0 | −0,413 |
| NAD+, 2H+/NADH,H + | 2 | +0,09 | −0,32 |
| Liponsäure: Lipons., 2 H+/Lipons.-H2 | 2 | +0,21 | −0,29 |
| Acetaldehyd 2 H+/Ethanol | 2 | +0,21 | −0,20 |
| Flavin-Nukleotide (FAD, FMN): F, 2H+/F–H2 | 2 | +0,22 | −0,19 1) |
| Glutathion: (GS)2, 2 H+/2GSH | 2 | +0,31 | −0,10 |
| Fumarat, 2 H+/Succinat | 2 | +0,38 | +0,03 |
| Dehydroascorbat/Ascorbat, 2 H+ | 2 | +0,35 | +0,08 |
| Ubichinon, 2 H+/Hydrochinon | 2 | +0,51 | +0,10 |
| ½O2, 2 H+/H2O | 2 | +1,23 | +0,82 |
| Häm-Eisen-Proteine | |||
| Katalase Fe3+/Fe2+ | 1 | −0,5 | −0,5 |
| Peroxidase Fe3+/Fe2+ | 1 | −0,2 | −0,2 |
| Cytochrom b562 Fe3+/Fe2+ | 1 | −0,1 | −0,1 |
| Cytochrom b Fe3+/Fe2+ (Mitochondrien) | 1 | +0,077 | +0,077 |
| Cytochrom b5 Fe3+/Fe2+ | 1 | +0 | +0 |
| Hämoglobin, Myoglobin Fe3+/Fe2+ | 1 | +0,1 | +0,1 2) |
| Cytochrom c1 Fe3+/Fe2+ | 1 | +0,22 | +0,22 |
| Cytochrom c Fe3+/Fe2+ | 1 | +0,235 | +0,235 |
| Cytochrom a Fe3+/Fe2+ | 1 | +0,29 | +0,29 |
| Cytochrom a3 Fe3+/Fe2+ | 1 | +0,385 | +0,385 |
- 1)Flavin-Nucleotide sind fest gebundene prosthetische Gruppen, deren genaues Redoxpotential vom Proteinpartner abhängt.2)Bemerkenswert ist die geringe Bereitschaft von Hämoglobin, Elektronen abzugeben: Dies würde zum Funktionsverlust führen.
Siehe auch
Weblinks
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

