elementu químicu de númberu atómicu 87 y símbolu Fr From Wikipedia, the free encyclopedia
El franciu[1] (d'antiguo conocíu como eka-cesiu y actiniu K)[nota 1] ye un elementu químicu que'l so símbolu ye Fr y el so númberu atómicu ye 87. El so electronegatividá ye la más baxa conocida y ye'l segundu elementu menos abondosu na naturaleza (el primeru ye l'astato). El franciu ye un metal alcalín altamente radiactivu y reactivu que se desintegra xenerando astato, radiu y radón. Como'l restu de los metales alcalinos, namái tien un electrón na so capa de valencia.

Marguerite Perey afayó esti elementu en 1939. El franciu foi l'últimu elementu químicu descubiertu na naturaleza enantes de ser sintetizáu.[2] Fora del llaboratoriu, el franciu ye desaxeradamente escasu, atopándose en traces en menas d'uraniu y de toriu, onde'l 223Fr ta de cutio formándose y desintegrándose. La cantidá de 223Fr na corteza terrestre nun momentu dau posiblemente nun entepase los 30 gramos; el restu de los isótopos son sintéticos. La mayor cantidá recuperada de cualesquier de los sos isótopos foi un clúster de 10.000 millones d'átomos (de 210Fr) sintetizáu como un gas ultra fríu en Stony Brook en 1996.[3]
El franciu ye menos estable que cualesquier otru elementu más llixeru que'l nobeliu (elementu 102);[3] el so isótopu más estable, el 223Fr, tien un periodu de semidesintegración menor de 22 minutos. El astato, que ye'l siguiente elementu menos estable, tien periodu de semidesintegración máximu de 8,5 hores.[4] Tolos isótopos del franciu se desintegran xenerando astato, radiu y radón.[4]
El franciu ye un metal alcalino que les sos propiedaes químiques son asemeyaes a les del cesiu.[3] Puesto que ye un elementu bien pesáu con un solu electrón de valencia,[5] tien el mayor pesu equivalente de tolos elementos químicos.[3] El franciu tien la más baxa electronegatividá de tolos elementos conocíos, con un valor de 0,7 na escala de Pauling.[6] Sígue-y el cesiu con un valor de 0,79.[7] El franciu líquidu, nel supuestu de poder ser llográu, tendría una tensión superficial de 0,05092 J·m–2 nel puntu de fusión.[8]
El franciu coprecipita, xunto con munches sales de cesiu, como'l perclorato de cesiu, formando pequeñes cantidaes de perclorato de franciu. Esta coprecipitación puede emplegase p'aisllar el franciu, afaciendo'l métodu de precipitación del radiocesiu de Glendenin y Nelson. Tamién coprecipita con otros sales de cesiu como'l yodatu, el picrato, el tartrato (tamién col tartrato de rubidiu), el cloroplatinato y el silicowolframato. Otres coprecipitaciones producir col ácidu silicowolfrámico y col acedu perclóricu, ensin necesidá de qu'otru metal alcalino tea presente como portador, lo que fai posible otros métodos de separación pal franciu.[9][10] Cuasi toles sales de franciu son solubles n'agua.[11]
Nun hai aplicaciones comerciales pal franciu por cuenta de la so escasez y a la so inestabilidá.[12][13][14][15][16] Namái foi usáu en xeres d'investigación, tantu nel campu de la bioloxía como nel de la estructura atómica. Pensóse que'l franciu podría sirvir d'ayuda pal diagnósticu d'enfermedaes rellacionaes col cáncer;[4] sicasí, finalmente esta aplicación consideróse impracticable.[14]
La capacidá pa sintetizar el franciu, atrapalo y esfrecelo, xunto cola so estructura atómica relativamente simple, convertir en suxetu d'esperimentación en espectroscopia especializada. Estos esperimentos conducieron al llogru d'información más específica sobre los niveles enerxéticos y les constantes d'acoplamientu ente partícules subatómiques.[17] Estudios realizaos sobre la lluz emitida por iones de 210Fr atrapaos por láser refundiaron datos precisos sobre les transiciones ente niveles enerxéticos atómicos. Comprobóse qu'estes resultaos esperimentales son bastante paecíos a los que prediz la Teoría Cuántica.[18]
Yá en 1870, los químicos pensaben que tenía d'esistir un metal alcalino más allá del cesiu, con un númberu atómicu de 87.[4] Denominábase-y col nome provisional de eka-cesiu.[19] Dellos equipos d'investigación intentaron alcontrar y aisllar l'elementu en cuestión y tiense constancia de siquier cuatro anuncios públicos falsos que proclamaben haber descubiertu dichu elementu primero que fuera realmente descubiertu.
El químicu rusu D. K. Dobroserdov foi'l primer científicu qu'aseguró haber descubiertu eka-cesiu. En 1925, reparó una débil radioactividá nuna muestra de potasiu, otru metal alcalino, y concluyó que'l eka-cesiu contaminaba la muestra.[20] Publicó una tesis sobre les sos predicciones de les propiedaes del eka-cesiu, na que nomaba al elementu col nome de russio, n'honor al so país de procedencia.[21] Poco tiempu dempués, empezó a centrase na so carrera docente nel Institutu Politéunicu d'Odessa, abandonando por completu los sos esfuerciu por aisllar el eka-cesiu.[20]
Al añu siguiente, en 1926, los químicos ingleses Gerald J. F. Druce y Frederick H. Loring analizaron una radiografía de rayos X del sulfatu de manganesu (II).[21] Repararon llinies espectrales que creyeron pertenecientes al eka-cesiu. Anunciaron el descubrimientu del elementu 87 y propunxeron el nome de alcalinio pal que sería'l metal alcalino más pesáu.[20]
En 1930, el profesor Fred Allison del Institutu Politéunicu d'Alabama anunció afayar l'elementu 87 analizando polucita y lepidolita usando la so máquina magnetu - óptica. Allison propunxo que fuera bautizáu como virginio, n'honor al so estáu natal, Virxinia, según que s'usaren los símbolos Vi y Vm.[21][22] En 1934, sicasí, el profesor MacPherson de la UC Berkeley desautorizó la efectividá del dispositivu de Allison y la validez del so falsu descubrimientu.[23]
En 1936, el químicu rumanu Horia Hulubei y la so colega francesa Yvette Cauchois analizaron tamién la polucita, esta vegada usando'l so aparatu de rayos X d'alta resolución.[20] Repararon delles llinies d'emisión débiles que supunxeron que sería debíes al elementu 87. Hulubei y Cauchois anunciaron el so descubrimientu y propunxeron el nome de moldavio, col símbolu Ml, n'honor a Moldavia, la provincia rumana onde llevaron a cabu'l so trabayu.[21] En 1937, el trabayu de Hulubei foi criticáu pol físicu americanu F. H. Hirsh Jr., que refugó los métodos d'investigación del químicu rumanu. Hirsh taba convencíu de que'l eka-cesiu nun podría ser atopáu na naturaleza, y que les llinies que reparara Hulubei yeren debíes al mercuriu o al bismutu. El químicu rumanu, sicasí, aportunó en que'l so aparatu de rayos X y los sos métodos yeren demasiáu precisos como pa cometer tales errores. Jean Baptiste Perrin, ganador del Premiu Nobel de Física y mentor de Hulubei, sofitó al moldavio como'l verdaderu eka-cesiu en llugar del recién descubiertu franciu de Marguerite Perey. Perey, sicasí, criticó de manera continua'l trabayu de Hulubei hasta qu'ella foi acreditada como la única descubridora del elementu 87.[20]
El eka-cesiu foi realmente afayáu en 1939 por Marguerite Perey, del Institutu Curie de París (Francia), cuando purificó una muestra de 227Ac que tenía una enerxía de desintegración de 220 keV. Sicasí, Perey alvirtió na desintegración partícules con un nivel enerxéticu per debaxo de los 80 keV. Pensó qu'esta actividá tenía de ser causada por un productu previu de desintegración ensin identificar, un productu separáu mientres la purificación, pero que volvía remanecer del 227Ac puru. Delles pruebes esaniciaron la posibilidá de que se fora de toriu, radiu, plomu, bismutu o taliu, tratándose por tanto d'un elementu desconocíu. El nuevu productu amosaba propiedaes químiques propies d'un metal alcalino (tal como la coprecipitación colos sales de cesiu), lo que llevó a Perey a pensar que s'atopaba frente al elementu 87, xeneráu pola desintegración alfa del 227Ac.[19] Perey intentó entós determinar la proporción ente la desintegración beta y la desintegración alfa del 227Ac. La so primer prueba indicaba que la desintegración alfa algamaba'l 0.6%, resultáu que foi revisáu hasta llegar al valor d'un 1%.[24]
Perey nomó al nuevu isótopu como actiniu K, que se refería a lo qu'agora conocemos como 223Fr,[19] y en 1946, propunxo'l nome de catio pal so recién descubiertu elementu, yá que creía que yera'l catión más electropositivo de tolos elementos químicos. Irène Joliot-Curie, una de los supervisores de Perey, oponer a esi nome pos paecía faer más referencia a "cat" (gatu n'inglés) qu'a catión.[19] Entós Perey suxirió'l nome de franciu como homenaxe al país onde lu afayó. Esti nome foi oficialmente adoptáu pola Unión Internacional de Químicos en 1949,[4] y asignóse-y el símbolu Fa, pero esta abreviatura foi camudada por Fr poco dempués.[25] El franciu ye'l postreru de los elementos que s'atopen na naturaleza en ser descubiertu, siendo l'anterior el reniu, en 1925.[19] Posteriores investigaciones sobre la estructura del franciu fueron llevaes a cabu por Sylvain Lieberman y el so equipu nel CERN nos años 70 y 80, ente otros.[26]

El 223Fr resulta de la desintegración alfa del 227Ac y puede atopase en traces nos minerales d'uraniu y de toriu.[3] Nuna muestra d'uraniu, envalórase qu'hai solo un átomu de franciu por cada 1×1018 átomos d'uraniu.[14][27] Dempués del astato, el franciu ye l'elementu menos abondosu na corteza terrestre.[4][14]
El franciu puede sintetizase na reacción nuclear:
Esti procesu, desenvueltu por Stony Brook Physics, xenera isótopos de franciu con mases 209, 210 y 211,[28] que pueden aisllase nuna trampa magneto-óptica (MOT).[29] La tasa de producción d'un isótopu en particular depende na enerxía del fexe d'osíxenu. El fexe del Stony Brook LINAC produz 210Fr nel oxetivu d'oru cola reacción nuclear 197Au + 18O → 210Fr + 5n. La producción rique de dalgún tiempu pa desenvolvese y entendese. Esto ye críticu pa operar l'oxetivu oru bien cercanu del so puntu de fusión y p'asegurase de que la so superficie tea bien llimpia. La reacción nuclear encualla de manera fonda los átomos de franciu coles mires d'oru, y débese quitar de manera eficiente. Los átomos espublícense rápido na superficie del oxetivu d'oru y llibérense en forma d'iones, sicasí, esto nun asocede tol tiempu. Los iones de franciu son empuestos poles lentes electrostáticas hasta qu'aterricen nuna superficie d'itriu caliente y conviértense en neutrales otra vegada. Entós el franciu inyectar nuna angüeña de vidriu. Los rayos láser y un campu magnético esfrecen y confinan a los átomos. Anque los átomos permanezan na trampa de namái unos 20 segundos enantes de de qu'escapen (o se descompongan), un fluxu constante d'átomos frescos reemplaza a los perdíos, calteniendo'l númberu d'átomos atrapaos aproximao constantes mientres dellos minutos o más tiempu. Primeramente, fueron atrapaos alredor de 1000 átomos de franciu nel esperimentu. Esto foi gradualmente ameyoráu y la instalación ye capaz d'atrapar más de 300.000 átomos neutros de franciu la vegada.[30] Anque se trata d'átomos neutrales "metálicos" ("metales francius"), tán nun estáu que nun se considera gaseosu. Atrápase l'abondu Franciu que la lluz emitida polos átomos puede ser prindada por una cámara de videu, yá que son fluorescentes. Los átomos apaecen como una esfera brillosa alredor de 1 milímetru de diámetru. Esta foi la primer vegada que daquién vio franciu. Los investigadores agora pueden faer midíes bien sensibles de la lluz emitío y absorbío polos átomos atrapaos, apurriendo asina les primeres resultaos esperimentales sobre diverses transiciones ente niveles d'enerxía atómica en francius. Les midíes iniciales amuesen bien bon alcuerdu ente los valores esperimentales y los cálculos basaos na teoría cuántica. Otros métodos de síntesis inclúin bombardiar radiu con neutrones, y bombardiar toriu con protones, deuterones o iones d'heliu.[24] El franciu nun foi, y probablemente nun va ser, sintetizáu en cantidaes lo suficientemente grandes como pa ser pesáu.[4][31][14]
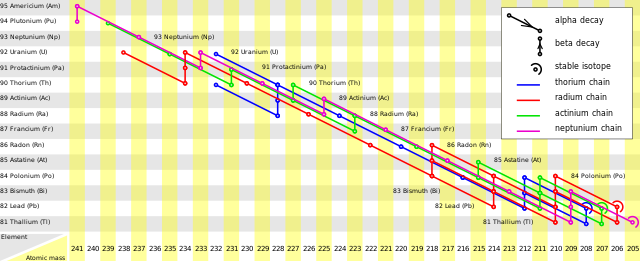
Conócense 34 isótopos del franciu qu'entienden un rangu de mases atómiques dende 199 hasta 232.[32] El franciu tien siete isómeros nucleares metaestables.[3] El 223Fr y el 221Fr son los únicos isótopos que se presenten na naturaleza, anque'l primeru ye muncho más común que'l segundu.[33]
El 223Fr ye l'isótopu más estable con un periodu de semidesintegración de 21,8 minutos,[3] y ye abondo improbable que dalguna vegada afayar o sintetice un isótopu de franciu con un periodu mayor.[24] El 223Fr ye'l quintu productu de la serie de desintegración del actiniu, procedente del 227Ac.[34] El 223Fr se desintegra dempués pa xenerar 223Ra por desintegración beta (enerxía de desintegración: 1149 keV), con una ruta menor (0,006%) de desintegración alfa que xenera 219At (enerxía de desintegración: 5,4 MeV).[35]
El 221Fr tien un periodu de semidesintegración de 4,8 minutos.[3] Ye'l novenu productu de la serie de desintegración del plutoniu, procedente del 225Ac.[16] El 221Fr se desintegra dempués pa xenerar 217At por desintegración alfa (enerxía de desintegración: 6,457 MeV).[3]
L'isótopu n'estáu fundamental menos estable ye'l 215Fr, con un periodu de semidesintegración de 0,12 μs (enerxía de desintegración hasta 211At: 9,54 MeV).[3] El so isómero metaestable, el 215mFr, ye entá menos estable, con un periodu de semidesintegración de 3,5 ns.[36]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.