一种主要由浆细胞分泌,被免疫系统用来鉴别与中和外来物质如细菌、病毒等病原体的大型Y形蛋白质,仅被发现存在于脊椎动物的血浆等细胞外液中,及其B细胞的细胞膜表面 来自维基百科,自由的百科全书
抗體(Antibody,Ab)又稱免疫球蛋白(Immunoglobulin,Ig)[1],是一種主要由漿細胞分泌,被免疫系統用來鑑別與中和外來物質如細菌、病毒等病原體的大型Y形蛋白質,僅被發現存在於脊椎動物的血漿等細胞外液中,及其B細胞的細胞膜表面[2][3]。抗體能通過其可變區唯一識別特定外來物的一個獨特特徵,該外來目標被稱為抗原。蛋白上Y形的其中兩個分叉頂端都有一被稱為互補位(抗原結合位)的鎖狀結構,該結構僅針對一種特定的抗原表位。這就像一把鑰匙只能開一把鎖一般,使得一種抗體僅能和其中一種抗原相結合。體液免疫系統的主要功能便是製造抗體[4]。抗體也可以與血清中的補體一起直接破壞外來目標。
此條目需要精通或熟悉相關主題的編者參與及協助編輯。 (2011年2月5日) |

抗體和抗原的結合完全依靠「非」共價鍵的交互作用,這些非共價鍵的交互作用包括:靜電力、氫鍵、疏水效應、凡得瓦力。這些交互作用可以發生在側鏈或者多肽主幹之間;這些力量雖然不比共價鍵強,但此多個非共價鍵加成的結果,能讓抗原與抗體緊密結合,卻又具可逆性。正因這種特異性的結合機制,抗體可以「標記」外來微生物以及受感染的細胞,以誘導其他免疫機制對其進行攻擊,又或直接中和其目標,例如通過與入侵和生存至關重要的部分相結合而阻斷微生物的感染能力等,就像通緝犯上了手銬和腳鐐一樣。針對不同的抗原,抗體的結合可能阻斷致病的生化過程,或者召喚巨噬細胞消滅外來物質。而抗體能夠與免疫系統的其它部分交互的能力,是通過其Fc區底部所保留的一個醣基化座實現的[5]。
抗體主要由一種B細胞所分化出來的叫做漿細胞的淋巴球所製造。抗體有兩種物理形態,一種是從細胞分泌到血漿中的可溶解物形態,另一種是依附於B細胞表面的膜結合形態。抗體與細胞膜結合後所形成的複合體又被稱為B細胞受體,這種複合體只存在於B細胞的細胞膜表面,是活化B細胞以及後續分化的重要結構。B細胞分化後成為生產抗體的工廠的漿細胞,或者長期存活於體內以便未來能迅速抵抗相同入侵物的記憶B細胞[6]。在大多數情況下,與B細胞進行互動的輔助型T細胞對於B細胞的完全活化是至關重要的,因為輔助型T細胞負責識別抗原,並促使B細胞能分化出能與該抗原相結合的抗體的漿細胞和記憶型B細胞[7]。而可溶性抗體則被釋放到血液等體液當中(包括各種分泌物),持續抵抗正在入侵的外來微生物。
抗體是免疫球蛋白超家族中的一種醣蛋白[5]。它們是血漿中丙種球蛋白的主要構成成分。抗體通常由一些基礎單元組成,每一個抗體包括:兩個長(大)的重鏈,以及兩個短(小)的輕鏈。而輕鏈和重鏈之間以雙硫鍵連接。輕鏈和重鏈又分為可變區和恆定區,而不同類型的重鏈恆定區,將會導致抗體種型的不同。在哺乳類動物身上已知的不同種型的抗體有五種,它們分別扮演不同的角色,並引導免疫系統對所遇到的不同類型外來入侵物產生正確的免疫反應[8]。
儘管所有的抗體大體上都很相似,然而在蛋白質Y形分叉的兩個頂端有一小部分可以發生非常豐富的變化。這一高變區上的細微變化可達百萬種以上,該位置就是抗原結合位。每一種特定的變化,可以使該抗體和某一個特定的抗原結合[2]。這種極豐富的變化能力,使得免疫系統可以應對同樣非常多變的各種抗原[1]。之所以能產生如此豐富多樣的抗體,是因為編碼抗體基因中,編碼抗原結合位(即互補位)的部分可以隨機組合及突變[8][9]。此外,在免疫種型轉換的過程中,可以修改重鏈的類型,從而製造出對相同抗原專一性的不同種型的抗體,使得同種抗體可以用於不同的免疫系統過程中。
表面免疫球蛋白通過跨膜部分附著在B細胞的細胞膜上,而分泌到血液等體液中的抗體則沒有該跨膜部分。這兩種抗體除了是否存在跨膜部分之外,結構是完全相同的。根據這一區別,抗體被分為兩種形態:可溶形態(分泌形態)及膜結合形態。
膜結合形態抗體可稱為「表面免疫球蛋白」(sIg)或者「膜免疫球蛋白」(mIg),是B細胞感受器的其中一部分。當體內存在某種抗原的時候,會與該蛋白結合,並活化B細胞[10]。B細胞感受器由表面免疫球蛋白(IgD或IgM),以及與之相連接的由Ig-α和Ig-β構成的異源二聚體所組成,其中後者負責傳遞抗原刺激信號[11]。人類B細胞表面所擁有抗體的典型數量為5萬至10萬左右[11]。這些抗體通常會聚集在每個直徑大約1微米的脂筏上,這些脂筏用於隔離細胞上的其它信號感受器[11],這種聚集方式可能可以提升細胞媒介性免疫的效率[12]。在人類B細胞的表面,這些B細胞感受器聚集的脂筏周圍幾百納米的範圍內沒有其它感受器,以避免互相競爭的影響[13]。
| 名稱 | 類型數 | 形狀 | 描述 | 抗體錯合物 |
| IgA | 2 | Y型、雙Y型 | 存在於黏膜組織,例如消化道、呼吸道以及泌尿生殖系統,以避免遭到病原的入侵[14],也存在於唾液、淚液以及乳汁當中,尤其是初乳,其IgA的含量相當高。 |  其中一些抗體複合體可以與多個抗原分子結合。 |
| IgD | 1 | Y型 | 主要出現在尚未遇到過抗原的B細胞上的抗原感受器[15],用於刺激嗜鹼性球及肥大細胞生產抗菌因子[16] | |
| IgE | 1 | Y型 | 與致敏原相結合,刺激肥大細胞和嗜鹼性球釋放組織胺。該種型與過敏反應有關,同時也保護機體免受寄生蟲的威脅[4]。 | |
| IgG | 4 | Y型 | 抵抗病原入侵的抗體相關免疫力,主要由該種型下的四種類型所提供[4],也是唯一一種可以穿過胎盤為胎兒提供被動免疫力的種型。 | |
| IgM | 1 | 五邊型 | 與B細胞表面結合的是單體形式,在分泌形態中則是由五個Y型單體排列而成的五聚體形式,具有極高的親和力。又因其分子量極大,因此在抗原凝集反應中非常有效。在B細胞介導(體液)免疫的早期階段IgG尚不充足,此時則主要由IgM來發揮清除病原的作用。同時為初次遭遇外來抗原後,最早回應出現的循環性抗體,但IgM在血液中的濃度會因清除作用迅速下降。因此,IgM通常可當做感染的指標。[4][15]。 |
抗體可以根據其重鏈恆定區的不同而分為不同的種型,不同的種型在免疫系統中有不同的作用。對於胎生哺乳類動物,存在5種種型,分別是IgA、IgD、IgE、IgG以及IgM,其中前面的"Ig"代表免疫球蛋白(Immunoglobulin,對抗體的另一種稱法)。這幾種種型在生物中的屬性、發揮功能的位置以及所能處理的抗原類型均有所不同,具體請參見上方的表格[17]。
B細胞的抗體種型會隨著B細胞的發育和活化而有所變化。從未接觸過任何抗原的未成熟B細胞(也稱為初始B細胞或處女B細胞)僅在細胞表面表現IgM種型的膜結合形態。當其成熟後,將會同時表現IgM和IgD兩種形式,這表明該B細胞已能夠對抗原產生響應,亦即「成熟」了[18]。
透過株係選擇抗原與某一株B細胞上抗體的結合,將會導致該株係的B細胞活化,並隨之分裂並分化成生產抗體的漿細胞(又稱效應B細胞、P細胞)及少量的記憶B細胞(Bm)。漿細胞這種活化形態的B細胞將會產生大量分泌形態的抗體,而不是膜結合形態的抗體。其中部分子代會發生免疫種型轉換,該機制將會導致生產的抗體從IgM或IgD種型,變成IgE、IgA或者IgG種型。
抗體是一種高分子球狀血液蛋白質,重量約為150kDa。由於在部分胺基酸殘基中含有糖鏈[19],抗體也是一種醣蛋白。能發揮功能的基本單位是一個免疫球蛋白單體。在分泌形態的抗體中包括:二聚體IgA、真骨附類魚的四聚體IgM以及哺乳動物的五聚體IgM[20]。
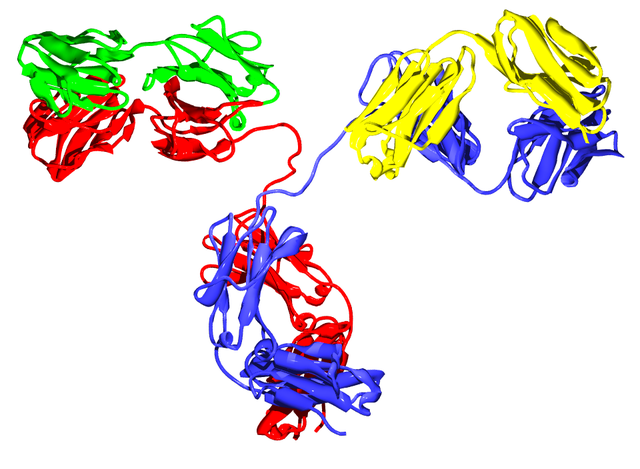
可發生變化的部分稱為V區(或變化區、可變區),而不變的部分稱為C區(或恆定區)。
抗體的單體是一個Y形的分子,有4條多肽鏈組成。其中包括兩條相同的重鏈,以及兩條相同的輕鏈,之間由雙硫鍵連接在一起[17]。每一條鏈均由稱為免疫球蛋白結構域的多個結構域所組成。每一個結構域大約包含70至110個胺基酸,並根據大小和功能分門別類。例如可變域IgV以及恆定域IgC)[21]。它們的摺疊方式很特別:通過兩次β摺疊將另一條鏈捲入其中形成三明治狀,互相之間通過半胱胺酸和其它帶電荷胺基酸緊密結合。
哺乳動物的免疫球蛋白重鏈有5種,分別用希臘字母記為:α、δ、ε、γ以及μ[2]。根據重鏈類型的不同,抗體被分為不同的種型,它們被發現依序分別存在於抗體IgA、IgD、IgE、IgG以及IgM中[1]。不同的重鏈其大小和組成各不相同:α和γ大約有450個胺基酸組成,而μ和ε大約有550個胺基酸組成[2]。

在鳥類的血液和蛋清中,還發現了被稱為IgY的血清抗體種型。這種抗體種型和哺乳動物的IgG有很大的區別。然而在一些舊資料,甚至是生命科學商業產品的網站上,仍然稱之為IgG。這是錯誤的,並且容易引起混淆。
每一條重鏈有兩個區域:恆定區與可變區。同種型的抗體,其恆定區都是一樣的,但不同種型之間該區域是不相同的。例如:γ、α以及δ型重鏈由三個免疫球蛋白結構域串聯而成,並且還有一個用於增加彈性的鉸鏈區;而μ及ε型重鏈則包括四個免疫球蛋白結構域[2]。不同B細胞所生產抗體的重鏈可變區是不同的,但是同一個B細胞及其克隆體所生產的不同種型抗體的可變區則是完全相同的。重鏈的可變區由一個結構域組成,包含大110個胺基酸。
免疫球蛋白輕鏈由大約211至217個胺基酸組成[2],分為兩個結構域,分別是恆定區和可變區。哺乳動物的輕鏈有兩種,分別命名為λ(lambda)和κ(kappa)[2]。每一個抗體的兩個輕鏈的恆定區永遠是完全相同的,例如對於哺乳動物而言,同一個抗體要麼是λ型,要麼是κ,不會同時存在。在如軟骨魚綱(鯊魚)及真骨下綱的低級脊椎動物中,還可發現其它類型的輕鏈,如ι(iota)型。
抗體的某些部分具有獨特的功能。比如說Y形的臂區,包含了兩個可以結合抗原的位點,是識別外來物的關鍵所在。該區域被稱為Fab區,即抗原結合區段(fragment, antigen binding)。無論是重鏈還是輕鏈,抗原結合區段均包括一個可變區與一個恆定區[22],其中可變區的互補位成型於抗體單體胺基酸鏈的末端。可變區又被稱為FV區,是與抗原結合的最關鍵區域,無論是輕鏈還是重鏈都包含該區域。實際上可變區的變化並非隨機或者均勻散布的。更具體的說,這些變化分布在三個可變的β摺疊-轉角上,該區域被稱為互補決定區(Complementarity Determining Region,CDR),也叫做高變區。喬西亞(Chothia)等人[23],以及後來的諾斯等人[24]對互補決定區的結構進行了歸類。在免疫網絡理論中,每個抗體的互補決定區又被稱為獨特型或者基因型。適應性免疫系統的適應過程,就是依靠有各個獨特型之間的互動來進行調整的。
Y形結構的基座的作用是調節免疫細胞的活動,該區域被稱為Fc區(Fragment crystallizable region,可結晶區域片段),由兩條重鏈組成。根據抗體類型不同,該區域的每一條重鏈由2個或者3個恆定結構域組成[2]。因此,Fc區可通過與特定類型的Fc感受器,或者其它免疫分子如補體蛋白質相結合,來確保每個抗體可對一特定抗原產生一個正確的免疫應答。通過這一過程,可引發不同的生理學效果,包括識別調理顆粒、細胞溶解,以及肥大細胞、嗜鹼性球和嗜酸性球的脫顆粒過程[17][25]。
活化的B細胞可分化成兩種不同用途的細胞:生產可溶性抗體的漿細胞,以及用於記憶已接觸過的抗原的記憶B細胞。後者可在體內存活多年,並使得下次再接觸到同樣抗原時,能夠更迅速的做出響應[26]。
胎兒和新生兒體內的抗體是由母親所提供的,是一種被動免疫。在出生後一年內,新生兒就可自行產生許多不同的抗體。由於抗體可以溶解在血液當中,因此它們是體液免疫系統的一部分。體液循環中的抗體,是由應答某一特定抗原如病毒衣殼片段的B細胞克隆子代所產生的。抗體從下列三個方面為免疫力做出貢獻:通過與病原體結合來避免入侵和破壞自身的細胞;通過刺激巨噬細胞等免疫細胞來包裹並清除病原體;以及通過刺激其它免疫應答過程如補體路徑,來消滅病原體[27]。

當補體與細菌結合形成補體級聯時,也是一種能和抗體結合的抗原。當抗體的Fv區與之結合時,會活化典型的補體系統[27]。這將會通過兩種途徑消滅該細菌[4]:第一種途徑是通過抗體與補體的結合在微生物上作標記,使得噬菌細胞受到補體級聯所產生的特定的補體的吸引,並通過一個叫做噬菌作用的過程吞噬細菌;第二種途徑是通過形成一種叫做補體膜攻擊錯合物的補體抗體錯合物來直接殺死細菌[28]。
為了阻止病原體在細胞外進行複製,抗體通過與之結合而將其聚集在一起,即凝集。由於抗體至少擁有兩個互不結合位,因此理論上它可以與不只一個相同類型的抗原相結合。通過對病原體的覆蓋,抗體可以活化能識別該抗體Fc區的細胞的效應作用[4]。擁有可以識別覆蓋病原體的抗體Fc區的細胞,可以和IgA、IgG以及IgE型抗體的Fc區發生互動。某一特定細胞上的Fc區感受器遇到特定的抗體後,會引發該細胞的效應作用,例如:吞噬細胞會進行吞噬,肥大細胞和嗜中性球會脫顆粒,而自然殺手細胞會釋放細胞因子和細胞毒素等化學物質。這些作用最終會導致入侵微生物的解體。Fc區感受器是種型敏感的,因此可使得免疫系統具備更高的靈活性,當不同的病原體入侵時可以僅僅觸發正確的免疫機制[2]。
抗體上的抗原結合位可與抗原結合而將其聚集在一起,即凝集反應。由於抗體至少擁有兩個抗原結合位,因此理論上它可以與不只一個相同類型的抗原相結合,使其抗原-抗體複合體更容易被吞噬細胞吞噬。若為可溶性抗原,則抗體能以形成抗原-抗體複合體的方式大大增加其分子量,使其溶解度降低而沉降於血管壁上,最後被吞噬細胞清除。
人類及高級靈長類動物還可以在病毒入侵之前,在血液中釋放中和抗體。中和抗體是指那些在任何感染、接種疫苗、接觸任何外來抗原或者接受被動免疫之前,即已被製造和釋放出來的抗體。這類抗體可以在適應性免疫響應被啟動之前,活化經典的補體路徑,來消解有包膜的病毒顆粒。許多中和抗體的目標抗原是雙半乳糖α(1,3)-半乳糖(α-Gal),後者通常出現在醣基化的細胞膜蛋白的醣苷基終端上,也是人類消化道中細菌的代謝產物[29]。通常認為異種器官移植所引起的排斥,部分是由接受移植者血清中流動的中和抗體和移植器官上的α-Gal抗原結合造成的[30]。
幾乎所有的微生物都可以觸發抗體的免疫應答。若想要成功識別並清除各種微生物,需要豐富多樣的抗體,而這種多樣性來自於抗體胺基酸的重組變化[31]。據估算,人類可以產生大約100億種不同的抗體,每一種都可以與特定抗原的表位相結合[32]。儘管每個人可以產生的抗體是如此之多,但是產生這些蛋白質的相關基因卻十分有限。脊椎動物發展出了一些複雜的基因機制,使得其B細胞可以利用有限的基因產生非常多樣的抗體[33]。

染色體當中用於編碼抗體的基因座範圍很廣,其中包含了編碼各個結構域的基因。其中編碼人類重鏈的基因座(IGH@)位於第14號染色體,而編碼λ和κ型輕鏈的基因座(IGL@和IGK@)則位於第22號染色體和第2號染色體。重鏈和輕鏈中均存在的可變區,在不同的B細胞所產生的抗體中是不一樣的。控制這些差異的三個轉角被稱為超變區(HV-1、HV-2及HV-3),又稱為互補決定區(CDR1、CDR2及CDR3)。編碼重鏈部分的基因座包含了65種不同的可變區基因,通過將這些基因與其它結構域的基因相組合,就可以產生高度差異的大量不同抗體,這一組合過程被稱為V(D)J重組過程[34]。

體細胞的免疫球蛋白重組又被稱為V(D)J重組,該過程可導致可變區發生獨特的變化。免疫球蛋白中每一條重鏈和輕鏈的可變區是由若干個基因片段(亞基因)所編碼的,這些片斷分別被稱為可變段(V)、多樣段(D)以及連接段(J)[33]。這三種片段均存在於編碼重鏈的基因片段中,而編碼輕鏈的基因片段中只存在V和J段。在哺乳類動物的基因中,V、D和J段的重複基因序列串聯在一起。骨髓中正在發育的B細胞,通過隨機選擇和組合V、D及J段各一段(輕鏈沒有D段),來產生免疫蛋白的可變區。由於每段都有多個不同的拷貝,各段之間還存在不同的組合方式,因此抗體的可變區可以產生數量巨大的變化。正因有如此數量巨大的不同抗原結合位,所以可以產生對大量不同抗原具有特異性的抗體[8]。有趣的是,λ型輕鏈免疫球蛋白的某些亞基因(例如V2家族)的重排,和miR-650微RNA的活耦聯,而後者則對B細胞的生化特性進一步發揮影響[35]。
在B細胞通過V(D)J重組過程產生了一個具備功能的免疫球蛋白之後,它就不可以再產生任何其它形狀的可變區了,這一過程稱為等位基因排斥。因此,每一個B細胞僅能產生某一種相同可變區的抗體[2][36]。
B細胞被抗原活化之後,將會迅速的增殖。在快速增殖的過程中,編碼重鏈及輕鏈可變區的基因,會通過一種稱為體細胞超突變過程,發生非常高概率的點突變。體細胞超突變會使得每一次細胞分裂,在基因的可變區中會產生大約一個核苷酸的變化[9]。這一過程將導致每一個子代B細胞會與親代的DNA,在抗體胺基酸鏈的可變區部分產生細微的差異。
這種突變方式可以增加抗體池的多樣性,並且對抗體與抗原的親和力產生影響[37]。例如,突變的子代中,某些所產生的抗體與抗原結合的能力,比親代所產生的抗體相比反而變弱了(親和力下降),但另一些則可能變強了(親和力增強)[38]。那些表現親和力更強的抗體的B細胞,會在與免疫系統其它部分的交互過程中,獲得比較弱者更強的生存信號,後者會逐漸因為凋亡作用而消失。這種使得生產的抗體逐漸增加結合親和力的過程,就是親和力成熟過程。親和力成熟過程發生在已發生過V(D)J重組後的成熟B細胞上,並需要輔助T細胞的幫助[39]。

免疫種型轉換是在活化後的B細胞中發生的一個生物學過程,該過程使得細胞可以產生不同種型的抗體,如IgA、IgE及IgG等[8]。不同種型的抗體及其效應作用,是由免疫球蛋白重鏈中的恆定區決定的。最開始的時候,初始B細胞僅表現抗原結合區域相同的膜結合形態IgM和IgD抗體。而在活化之後,由於不同種型的抗體僅應對特定的功能,B細胞會根據清除抗原所需要的功能,選擇生產具備IgG、IgA或者IgE效應作用的抗體。通過種型轉換,從同一個活化B細胞分裂出來的子代細胞就可以生產不同種型的抗體。在種型轉換的過程中,只有重鏈的恆定區發生了改變,而可變區則沒有發生任何改變,因此所針對抗原的特異性也不會發生改變。因此,同一個B細胞的子代都能生產針對同一抗原的抗體,但卻可以對各種抗原狀況提供恰當的效應作用。生產哪一種型的抗體,是由B細胞所處環境中存在的細胞因子類型所決定的[40]。
生產抗體種型的轉換,是通過一種稱為種型轉換重組(CSR)的機制對編碼重鏈的基因座進行重組來完成的。該機制依賴被稱為「交換區」的保守核苷酸模體,該模體存在於除δ鏈以外其它重鏈恆定區基因的上游DNA序列中。通過一系列酶的作用後DNA鏈的兩個特定交換區被剪斷[41][42],然後通過非同源性末端接合的過程,將可變區外顯子與需要的恆定區如γ、α、ε鏈重新接合在一起。通過該過程,一段編碼抗體的基因即可產生不同種型的抗體[43]。
若抗體對相同的抗原或抗原表位具特異性,則稱為單特異性抗體(monospecific Ab)[44]、特效抗體、單效抗體;若抗體對兩不同抗原或在相同抗原上的兩不同表位具親和力,則稱為雙特異性抗體[45][46]。若一群抗體對不同抗原或微生物具親和力,則稱為多價抗體(polyvalent Ab)[47]或非特異性抗體(unspecific Ab)、非特效抗體、多效抗體。如無特殊標示,靜脈注射免疫球蛋白的有效成分即含各種不同的非特異性(非特效)多克隆丙種免疫球蛋白(polyclonal IgG)。而單株抗體則是單個B細胞產生的相同抗體,也是對單個抗原表位特異親和的單特異性抗體(單效抗體)。
儘管抗體是用於對抗外來異物的免疫手段,但在部分人群中卻存在著因為抗體異常導致的自體免疫性疾病。這種問題主要是人體針對自身正常細胞或者化學產物的抗原,產生了對應的抗體而造成的。這些疾病當中相當大的一部分是由於自身免疫系統對這種自身抗體結合後的正常細胞產生免疫反應,進而導致殺傷自身細胞而造成的,例如,全身性紅斑狼瘡、乾燥症候群、強直性脊柱炎以及類風濕性關節炎等。這一類的疾病性質根據不同的疾病,嚴重程度並不一樣。如全身性紅斑狼瘡嚴重時可能會危及性命,而乾燥症候群如果稍加控制,通常只會造成口乾舌燥之類的不適。
除了主要因殺傷自身細胞導致的疾病外,還存在另一種致病的原因。例如,患者自身產生了針對促甲狀腺激素受體的抗體,則可能發生如下兩種情況:如果該抗體能夠活化促甲狀腺激素受體,則抗體和受體的結合也會產生類似促甲狀腺激素的作用,並導致甲狀腺當中的濾泡細胞分泌遠超所需的甲狀腺激素,於是導致瀰漫性毒性甲狀腺腫;而如果該抗體可以和受體結合,但不能活化該受體,即該抗體與受體的結合併不會刺激甲狀腺分泌甲狀腺激素,但由於促甲狀腺激素因此被阻礙而無法與受體結合,於是導致甲狀腺激素分泌量遠少於自身所需,因此患者呈現甲狀腺功能低下。
上面這類因自身基因異常所導致的免疫系統異常,儘管通常可以通過藥物進行較為良好的控制,但一般不可能通過藥物治療根治。而對於某些非關鍵器官,例如甲狀腺,可以通過手術摘除的方式根除疾病的病態反應。但術後需要長期服用相關藥物以補充體內無法製造的物質,例如甲狀腺激素等。
而另一種抗體相關的疾病則與「正常的」外來物有關。例如對於懷孕的婦女而言,其腹中胎兒,又或者進入婦女體內的男性精子等。這些外來物的抗原表位與患者自身的抗原表位並不相同,因此功能正常的免疫系統應當識別為外來物,並產生相應的抗體,最終通過免疫反應清除。然而這些外來物本來應該是正常生物活動中的一部分,如果被清除反而會導致不正常的後果。實際上正常的情況下,生物體內會有相應的機制抑制此類情況的發生。例如對於胎兒來說,胎盤除了會隔絕絕大部分的母體免疫細胞進入胎兒體內之外,還會產生相關的化學物質例如孕酮等,抑制免疫系統在胎盤附近的活性,從而避免對胎盤和胎兒造成傷害。但是在某些情況下,這種機制可能會遭到破壞,或者被繞過。例如在懷孕時,孕酮產量不足,導致胎盤被識別為外來物遭到破壞,導致早期胎停及流產。又或者在分娩甚至懷孕過程中,胎兒血液進入母體,或者母體免疫細胞進入胎兒導致母體產生對某種血型的抗體,進而導致下一次乃至本次懷孕因為胎兒血液中的紅血球被攻擊溶解而流產。又或者因為生殖系統發炎,導致這些器官聚集了大量免疫細胞,於是進入體內的精子被識別成外來物的機率大幅提升,進而導致不孕。
和前一類疾病相比,這種疾病並不會因為抗體將自身正常細胞識別成外來物,而導致自身機能的失調,因此通常並不會直接導致危及性命。但由於正常的生理活動無法順利進行,對於諸如生命延續這種重要的功能會遭受打擊。同時可能因為早產等問題,嚴重威脅後代的性命。嚴重時甚至會因為流產等併發症,間接危及自身的性命。由於該問題通常並非自身基因導致的免疫系統故障所造成的,經由適當的治療,甚至只需要一段時間不接觸導致問題的抗原(例如精子),症狀就會自行消失。同時,可以通過相關的篩查(例如夫妻血型對比),可以提前避免這類問題的出現。由於人體記憶B細胞的存在,一旦出現過這類症狀,復發的可能性仍然是存在的。並且一旦復發,其反應時間會較初次更短,免疫反應也會更激烈。因此對於曾經出現該問題的患者,未來的相關活動都需要相對小心,尤其應當遵醫囑咐,使用適當藥物來預防。
檢測特定的抗體是一種常見的醫學診斷方式,而血清學方面的應用便依賴於此[48]。以某種疾病的生化檢查方法為例[48],可通過對血液中人類疱疹病毒第四型或者萊姆病抗體的滴定量來判斷是否患病。如果被檢測者的血液中沒有發現這種抗體,則此人要麼沒有被感染,要麼即使被感染也是很早以前的事情了——那些記憶B細胞都已消解殆盡了。在臨床免疫學中,通過濁度測定法(或者比濁法)對各種免疫球蛋白的水平進行測定,以了解患者的抗體情況[49]。對於肝臟發生損傷但尚未確診的患者檢查何種免疫球蛋白升高情況,有的時候有助於找出問題的原因[1]。例如,IgA升高可能意味著酒精性肝硬化,IgM升高可能意味著病毒性肝炎或者原發性膽汁性肝硬化,IgG升高則可能是由肝硬化、病毒性肝炎或者自體免疫性肝炎的徵兆。患有自體免疫性疾病的患者,通常會存在自身細胞抗原表位相結合的抗體,大部分患者可通過血液檢查檢測到。而通過抗體直接對紅血球的表面抗原進行抗人球蛋白測試,則可以確診免疫所致的溶血性貧血[50]。抗人球蛋白測試也用於輸血之前的抗體篩查準備工作,以及產前孕婦的抗體篩查[50]。在實踐中,基於對抗原抗體錯合物的免疫檢測手段被用來診斷所感染的疾病,這些手段包括:酶聯免疫吸附試驗、免疫螢光染色法、西方墨點法、免疫擴散法、免疫電泳法以及磁性分離酶聯免疫分析等。抗人絨毛膜促性腺激素抗體被用於非處方妊娠檢測,如早孕試紙等。特定的單株抗體療法被用於治療諸如類風濕性關節炎[51]、多發性硬化症[52]、銀屑病[53]等疾病。此外,單株抗體還被用於治療諸如非霍奇金氏淋巴瘤[54]、大腸癌、頭頸部癌以及乳腺癌等多種癌症[55]。某些如性聯遺傳無丙種球蛋白血症以及低丙種球蛋白血症的免疫缺陷會導致部分甚至全部抗體的缺失[56]。這種類型的疾病,通常是通過向病患注射包含抗體的人或動物血清、混合免疫球蛋白或者單株抗體等方式,建立短期的被動免疫力的手段進行治療的[57]。
Rh因子,又稱為RhD抗原,是一種可存在於紅血球表面的抗原。Rh陽性(Rh+)的個體,其紅血球表面存在Rh抗原,而Rh陰性(Rh-)個體的紅血球表面則不存在這種抗原。正常的分娩過程,或者分娩創傷,或者懷孕過程中的併發症,都可能導致胎兒的血液進入母親的免疫系統中。這種血液混合的情況,可能會導致Rh陰性的母親,產生針對Rh陽性嬰兒的血球抗原的抗體。這將導致剩下的孕期,以及未來的懷孕過程產生新生兒溶血症的風險[58]。
Rho(D)是對人類RhD抗原特異的抗體[59],是避免上述情形發生的產前治療方案之一。對懷有RhD陽性胎兒的RhD陰性母親來說,在接觸到RhD抗原之前,或者至少在剛接觸之時,通過給予RhD抗體的治療方案是非常必要的。通過注射這種抗體,可以迅速有效地清除從胎兒血液中帶來的包含RhD抗原表位的血球。這樣可以避免刺激母親的免疫系統產生能夠生產RhD抗體的B細胞,尤其是記憶B細胞。因此,母親的免疫系統就不會生產RhD抗體,也就不會攻擊有RhD抗原的胎兒。儘管該治療方案可以避免Rh血型新生兒溶血症的發生,但卻不能治療已經產生抗體所導致的情況[59]。

通過向小鼠、大鼠或者兔身上注射特定的抗原,可以得到少量相應特異性的抗體。而如果需要得到大量的抗體,則需要向山羊、綿羊或者馬身上注射相應的抗原。對這些實驗動物的血液進行分離後,可以在血清中得到「多株抗體」。即,針對相同抗原的多種不同的抗體。這種方法製備的抗體又叫做抗血清。另一種製備抗體的方式是通過向受精蛋中注射抗原,然後從蛋清中獲得抗體[60]。為了獲得針對某一抗原單一抗原表位的特異性抗體,需要從動物身上分離出相應的抗體分泌淋巴球,然後通過與癌細胞株相融合使之可無限增值。這種融合細胞叫做雜交瘤,可以在培養環境中不停分泌抗體。通過稀釋克隆法將單個雜交瘤細胞隔離出來,這種細胞克隆方法所製備出來的抗體是完全一樣的,被稱為單株抗體[61]。多株抗體和單株抗體的製備,通常還需要使用A/G蛋白質或者抗體親和色譜法來進行提純[62]。
在實驗室中,純化的單株抗體有許多應用場景。最常見的應用場景,是用來鑑定細胞內及細胞外的蛋白質類型。此外,不同類型的細胞會在細胞表面表現不同組合的分化簇分子,並生產出不同的胞內蛋白質,也會分泌出不同的蛋白質。因此單株抗體也被應用於流式細胞術中,通過識別不同細胞所表現的不同蛋白質來區分它們[63]。在免疫沉澱法中,也通過單株抗體來分離細胞溶解物中的特定蛋白及其結合物[64]。此外在西方墨點法中用來分析通過電泳法所分離出來的蛋白質[65],以及在免疫組織化學染色法或免疫螢光染色法中檢驗分析待檢驗組織中所表現的蛋白質,甚至通過顯微鏡直接觀察蛋白質在細胞中的分布情況[63][66]。酶聯免疫吸附試驗(ELISA)及酶聯免疫斑點(ELISPOT)等檢測技術甚至可以通過單株抗體來對特定蛋白進行定量分析[67][68]。
抗體對健康及生物技術工業的重要性導致了對其高解析度結構的知識的需求。這些資訊對蛋白質工程,修改抗體結合親和性,以及識別特定抗體的抗原表位來說非常有用。X射線晶體學是其中一種研究抗體結構的常用手段,然而抗體的結晶過程非常耗時耗力。而通過計算機來研究晶體學問題,相對更快更便宜。但是計算機方法不能得出很確定的結論,因其不能產生經驗所知的結構。諸如「網絡抗體建模」(WAM)[69],以及「免疫球蛋白結構預測」(PIGS)[70]等在線伺服器,使得人們能通過計算機對抗體可變區進行建模。「羅塞塔抗體」(Rosetta Antibody)是一個新型的FV區結構預測伺服器,通過使用非常複雜的技術,它可以最大程度簡化CDR轉角過程,並優化輕重鏈相對位置的定位過程,還可以根據已知同源結構模型來預測抗原抗體是否能成功對接[71]。
抗體(antibody)這個詞首次出現在保羅·埃爾利希1891年10月公布的《免疫力的試驗性研究》這篇文章中,德語的抗體「Antikörper」出現在該文章的結論部分。其中指出了「如果兩種物質導致兩種不同抗體的產生,那麼這兩種物質必然是不同的」[72]。然而這一術語並沒有立即被接受,還有被建議使用的其它幾個術語,如:免疫體(Immunkörper)、介體受體(Amboceptor)、介體(Zwischenkörper)、物質敏感體(substance sensibilisatrice)、連接體(copula)、德氏體(Desmon)、白血球素(philocytase)、介體固定體(fixateur)以及免疫素(Immunisin)等[72][72]。抗體和抗毒素(Antitoxin)字面結構相似,概念則和免疫體(Immunkörper)類似[72]。

針對抗體的研究始於1890年,埃米爾·阿道夫·馮·貝林及北里柴三郎首次描述了抗體對白喉及破傷風痙攣毒素的抵抗作用。他們兩人將體液免疫理論往前推進了一步,提出了血清中存在一種可以與外來抗原相反應的某種介質的假設[76][77]。保羅·埃爾利希受到了他們的這一想法的啟發,於1897年提出了抗體與抗原互動的側鏈理論假說。他假設道,在細胞的表面存在能和特定毒素發生一把鑰匙對應一把鎖類似的特異結合作用的感受器(原文為「側鏈」),而結合反應則會進一步導致相關抗體的生產[78]。其他研究人員在之後的研究中認為,抗體可以在血液中穩定獨立存在。在1904年,奧姆羅斯·萊特進一步提出通過可溶性抗體在細菌的表面包裹標識,使其成為吞噬作用的目標,並最終被消滅。這一過程被他命名為調理作用[79]。
到了二十世紀二十年代,麥可·海德堡和奧斯瓦爾德·埃弗里觀察到抗原可以被抗體所凝結,並進一步發現抗體是一種蛋白質[80]。在三十年代,約翰·馬拉克對抗原-抗體結合活動的生物化學性質做了更詳盡的實驗[81]。接下來的一次重大突破發生在四十年代,萊納斯·鮑林通過抗體抗原的互動能力取決於各自的形狀而不是其化學成分,證明了埃爾利希所提出的一把鑰匙配一把鎖的免疫學理論[82]。1948年,阿斯特麗德·法戈瑞奧司發現B細胞的其中一種形式漿細胞就是負責生產抗體的工廠[83]。
此後,研究工作的重點轉向了識別抗體蛋白質結構中各部分的作用。二十世紀六十年代,傑拉爾德·埃德爾曼和約瑟夫·蓋里發現了抗體的輕鏈[84],並且發現這和1845年由亨利·本冊·瓊斯所發現的本周氏蛋白質是同一種物質[85],這是一項重大的突破。緊接著,埃德爾曼在進一步發現抗體中的重鏈和輕鏈是由雙硫鍵連接在一起的。與此同時,羅德尼·羅伯特·波特識別出了免疫球蛋白的抗體結合區(Fab)及抗體尾部的可結晶區[86]。根據這些發現,科學家們對免疫球蛋白的結構進行了推測,並描述了IgG蛋白質的完整胺基酸序列。以上這些發現,使得他們被共同授予1972年的諾貝爾生理學或醫學獎[86]。Fv區則由戴維·吉沃爾(David Givol)所首先製備和識別[87]。正當人們對抗體的大多數早期研究還集中在IgM和IgG上時,六十年代還發生了重要的事情:托馬斯·托馬西發現了屬於新種型的分泌形態IgA抗體[88],戴維·S·羅維和約翰·L·費伊則識別出了IgD[89],石坂公成和石坂照子夫婦則共同發現了與過敏反應有關的抗體種型IgE[90]。1976年,利根川進對免疫球蛋白相關基因進行研究,發現了抗體通過基因重排實現多樣性的體細胞超突變基本原理[91]。
Seamless Wikipedia browsing. On steroids.