热门问题
时间线
聊天
视角
GABAA受體
来自维基百科,自由的百科全书
Remove ads
GABAA受體(又稱作γ-氨基丁酸A型受體)是一種離子型受體,而且是一類配體門控型離子通道。此通道的內源性配體是一種被稱為GABA的神經遞質。GABA是中樞神經系統裏的一種主要的遞質,雖然GABA在神經遞質的釋放過程中產生的是抑制性效應,但GABA本身並非一種抑制性而是一種刺激性遞質,因為GABA激活GABA受體的開放。在GABAA受體被激活後,可以選擇性的讓Cl-通過,引起神經元的超極化。這種超極化引起了神經信號傳遞抑制,因為降低了動作電位產生的成功率GABAA,在正常條件下產生的抑制性突觸後電位的翻轉電位是-75 mV,高於GABAB受體的-100 mV。
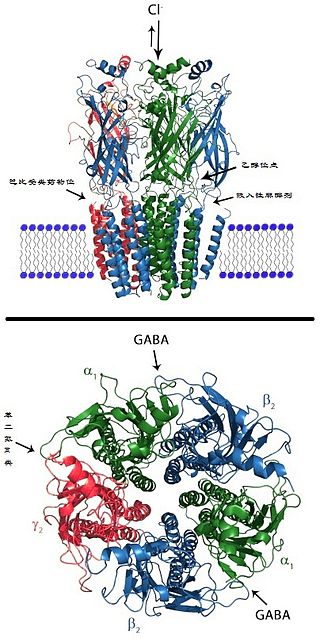
GABAA受體的活性位點可與GABA以及許多藥物諸如蠅蕈醇、加波沙朵、荷包牡丹鹼等結合。受體也包含許多異構調節,可間接調節受體活性,可調控異構位點的藥物包括苯二氮䓬類、非苯二氮䓬類藥物、巴比妥類藥物、乙醇[2]、神經甾體、吸入性麻醉劑、印防己毒素等[3]。
藥物導致GABAA受體對神經元活動的中度抑制可使患者消除焦慮感(抗焦慮作用),而更強的抑制作用則會產生全身麻醉。藥物的嚴重過量鮮有出現,而產生的反應是延長麻醉時間,甚至出現死亡[4]。
Remove ads
苯二氮䓬類位點
苯二氮䓬類藥物可結合離子型GABAA受體蛋白複合物的靶點。苯二氮䓬類的靶點位置與內源性配體GABA的靶點位置不同,並非處於α和β亞基之間,而是一個特殊的苯二氮䓬靶點,這個靶點存在於含有α和γ亞基的受體中,位於α和γ亞基之間(如圖所示)[5][6]。大部分的GABAA受體(含有α1,α2,α3或α5亞基的受體)對於苯二氮䓬類藥物敏感,但少數含有α4或者α6亞基的受體對傳統1,4- 苯二氮䓬類藥物無敏感性[7],對其他類型的GABA能藥物例如神經甾體和乙醇卻存在敏感性。GABAA受體與外周苯二氮䓬受體(又稱作轉位子蛋白)並無關係。IUPHAR建議,不再使用過去的"苯二氮䓬受體", "GABA/苯二氮䓬受體" 及"ω受體" 等術語,並將"苯二氮䓬受體"更名為"苯二氮䓬靶點"[8]。
若一個GABAA受體對苯二氮䓬類藥物敏感,該受體一定帶有至少一個α 和一個γ亞基,使之形成苯二氮䓬靶點。一旦苯二氮䓬類藥物與之靶點結合,可使GABAA受體固定於一種對GABA產生高親和性的構型,該構型增加氯離子通道開放頻率並以此讓細胞膜超極化,加強了GABA對神經系統的抑制效應並引起鎮靜及抗焦慮效應。 不同的苯二氮䓬藥物對GABAA受體有不同的親和性,這種親和性的不同是由受體的亞基不同所造成的。例如,與α1和/或α5亞基親和力高的配體能產生更嚴重的鎮靜,共濟失調和失憶症;對含有α2和/或α3亞基的受體產生更高親和力的配體則會有更強的抗焦慮作用[9]。抗驚厥效果可以由任意一種亞基組合的受體中產生,但現在的研究主要集中於α2亞基選擇性激動劑的方向,因為這種藥物產生的副作用較小,而傳統藥物則會產生鎮靜,失憶等副作用。
苯二氮䓬類藥物在GABAA受體的結合位點與巴比妥類藥物以及GABA的位點都不相同[10],因此產生迥異的藥效。苯二氮䓬類會引起氯離子通道開放更加頻繁,而巴比妥類則增加氯離子通道的開放時間[11] 。因為兩類藥物的調節過程並不相同,兩種調節可以同時發生,產生強效的協同作用,並可能使患者處於十分危險的境地。
另外,某些GABAA受體激動劑(如蠅蕈醇和加波沙朵會與受體上GABA位點結合,產生與苯二氮䓬類藥物相似卻不完全相同的效應。
Remove ads
結構與功能


GABAA受體是由五個亞基組成的跨膜受體,五個亞基圍繞形成離子通道。每個亞基包含四個跨膜域,N-和C-末端都在細胞外。GABAA受體存在於神經元的細胞膜上,大部分該受體處於突觸後膜上,而某些受體的同源異構體也會出現在突觸以外的地方[12]。GABA是GABAA受體的內源性配體,結合時可使受體通道開放。當GABA與受體結合時,受體在細胞膜上發生構型改變,通道孔打開,氯陰離子可順着電勢和濃度梯度通過離子通道。由於大多數神經元上的氯離子的翻轉電位在細胞膜靜息電位附近,或略低於靜息電位,GABAA受體的激活可以使靜息電位更加穩定,甚至使細胞超極化,以至於弱化了激動性神經遞質的去極化效果和產生動作電位的可能。因此,該受體主要發揮抑制性作用,減少神經元的活動。GABAA受體是離子型受體,開放速度快,因此在抑制性突觸後電位的過程中屬於早期效應[13][14]。內源性苯二氮䓬類位點的配體是肌苷。
Remove ads
GABA受體是半胱氨酸環超家族的一員,半胱氨酸環超家族包含一些在進化上相關的並在結構上相似的配體門控離子通道如煙鹼型乙酰膽鹼受體、甘氨酸受體,5-HT3受體。GABAA受體包含許多同源異構體,不同的異構體決定了受體的配體親和性,通道開放率,離子電導性等性質[15]。
在人體中,包含以下亞基[16]:
- 六種α亞基(GABRA1, GABRA2, GABRA3, GABRA4, GABRA5, GABRA6)
- 三種β亞基(GABRB1, GABRB2, GABRB3)
- 三種γ亞基(GABRG1, GABRG2, GABRG3)
- 一種δ亞基 (GABRD)
- 一種ε亞基(GABRE)
- 一種π亞基(GABRP)
- 一種θ亞基(GABRQ)
還有三種ρ亞基(GABRR1, GABRR2, GABRR3),但ρ亞基並不與上述的其他亞基結合,而是形成GABA-ρ受體的同寡聚體(曾被認為是GABAC受體)。 五個亞基會以不同的組合形成GABAA受體。形成GABA門控離子通道的要求是至少有一個α 亞基和一個β亞基[17],而大腦中GABAA受體最常見的構成是兩個α亞基,兩個β亞基和一個γ亞基形成的五聚體(α2β2γ)[16]。
配體
科學發現除GABA以外,一系列的配體都能夠與GABAA受體結合,並能對該受體產生產生調節作用。
Remove ads
能夠激動GABAA受體的配體通常能夠產生抗焦慮,抗驚厥,失憶症,鎮靜,催眠,欣快以及肌肉鬆弛等效果。某些藥物,比如蠅蕈醇,也能夠引發幻覺。而能夠阻滯GABAA受體活性的配體則能產生相反的效果,比如產生焦慮及痙攣等。當前研究集中於某些亞基選擇性異構拮抗劑當中,比如α5IA等,因為這些藥物可產生益智效果,並能緩解GABA能藥物產生的副作用[24]。
許多苯二氮䓬類位點異構調節劑都有一種重要的性質,即它們能夠選擇性地結合某些特別的受體,這些受體由特定的亞基構成。這種性質可以用來檢測哪種GABAA受體的亞基組合在腦的特定區域的表達佔優勢,同時也提供了GABAA受體的亞基組合調節行為的證據,因為不同的藥物對GABAA受體的調控產生特定的生理表現。這些選擇性的配體有良好的藥理學特性,因為這些配體能夠產生需要的治療效果,但卻不產生嚴重的副作用[25]。除了對α1亞基有一定選擇性的藥物唑吡坦以外,幾乎沒有其他亞基選擇性配體進入臨床使用,但不少亞基選擇性化合物正在開發過程當中,比如α3選擇性藥物Adipiplon。許多亞基選擇性化合物在科學研究中廣泛應用,其中包括:
- CL-218,872:α1亞基高度選擇性激動劑
- 溴他西尼:亞基選擇性部分激動劑
- imidazenil和L-838,417:對於某些亞基類型是部分激動劑,對於其他亞基類型是弱拮抗劑
- QH-ii-066:α5亞基高度選擇性完全激動劑
- α5IA:α5 亞基選擇性反向激動劑
- SL-651,498:對於α2和α3亞基是完全激動劑,對於α1和α5亞基是部分激動劑
- 3-酰基-4-喹諾酮: 選擇性α1亞基高於α3亞基[26]
Remove ads
分布
由於GABAA負責調控大部分在中樞神經中的由GABA激活的生理活動,亞基在腦中的許多組織中都有表達。亞基在不同區域有着不同的組成,而GABAA受體的不同亞型也產生了特異的功能。另外,GABAA受體也會存在於其他組織當中,這些組織包括間質細胞,胎盤,免疫細胞,肝臟,骺板及某些內分泌組織。亞基在正常細胞和惡性腫瘤細胞的表達迥異。GABAA受體能夠影響細胞增殖過程[27]。
參見
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

