貴氣體
元素類型 来自维基百科,自由的百科全书
稀有氣體或惰性氣體(英語:inert gases),又稱懶性氣體、鈍氣、貴族氣體(noble gases)等,指在元素週期表中同屬第18族(舊稱ⅧA族)的化學元素,在常溫常壓下都是無色無味的單原子氣體。因為這些元素原子的電子層都處於飽和狀態,使其無論物理和化學特徵都異常穩固,除了同位素裂變或聚變外幾乎沒有任何活性,很難和其它物質發生化學反應。
| 「Noble gas」的各地常用名稱 | |
|---|---|
| 中國大陸 | 稀有氣體 |
| 港澳 | (高)貴氣體 |
| 星馬 | 惰性氣體 |
| 臺灣 | 惰性氣體 |
天然存在的貴氣體有六種,即氦(He)、氖(Ne)、氬(Ar)、氪(Kr)、氙(Xe)和具放射性的氡(Rn)。而人工合成的鿫(Og)原子核非常不穩定,半衰期極短,因此目前未能通過化學實驗來研究其性質。根據元素週期律,除了氖的反應活性最低外,其餘貴氣體的反應活性隨着原子序的增大而漸高,因此估計鿫應比氡更活潑。而且,理論計算顯示,鿫可能會非常活潑,以至於不一定能稱為惰性氣體[1]。
貴氣體的特性可以用現代的原子結構理論來解釋:它們的最外電子層的電子已「滿」(即已達成八隅體狀態),非常穩定,極少參與化學反應,至今只成功製備出幾百種貴氣體化合物。每種貴氣體的熔點和沸點十分接近,溫度差距小於10 °C(18 °F),因此它們僅在很小的溫度範圍內以液態存在。
經氣體液化和分餾方法可從空氣中獲得氖、氬、氪和氙,而氦氣通常提取自天然氣,氡氣則通常由鐳化合物經放射性衰變後分離出來。貴氣體在工業方面主要應用在照明設備、焊接和太空探測。氦也會應用在深海潛水。如潛水深度大於55米,潛水員所用的壓縮空氣瓶內的氮要由氦代替,以避免氧中毒及氮麻醉的徵狀。另一方面,由於氫氣非常不穩定,容易燃燒和爆炸,現今的飛艇及氣球都採用氦氣替代氫氣。
名稱
自從貴氣體在十九世紀始為人知,其性質越趨透澈而多次改名。化學家最初認為它們很罕見,稱之為稀有氣體(rare gases)。不過,並非所有氣體都很少見,這種說法只適用於部分氣體。例如氬氣在地球大氣層的含量佔0.9%,勝過二氧化碳[2];而氦氣在地球大氣層的含量確實很少,但在宇宙卻相當充沛,佔25%,僅次於氫。所以化學家又改稱惰性氣體(又稱鈍氣,inert gases),表示它們在普通環境不化學反應,不曾在自然出現過化合物。對於那些早期需藉由化合物來尋找元素的科學家來說,這些元素甚難尋找。不過,最近研究指出它們可以藉助人工合成的方式和其他元素結合成化合物(此即貴氣體化合物[3]),故最後改稱noble gas[4],這稱呼是由雨果·埃德曼[5]於1898年所用的德語詞Edelgas翻譯而來,表示它們極不活潑,難以反應,但並非不能產生任何化合物,類比於與極不活潑的惰性金屬(noble metal)[6]。
在中文譯名方面,兩岸三地有不同稱呼。中國大陸全國自然科學名詞審定委員會於1991年公佈的《化學名詞》中正式規定「noble gases」稱為稀有氣體一詞[7]。香港教育局的《中學化學科常用英漢辭彙》稱「noble gases」為(高)貴氣體[8],而一般社會仍有使用惰性氣體的稱呼[9]。而台灣方面,由國家教育研究院的國立編譯館建議常稱「noble gases」為惰性氣體,比較少用鈍氣(但審定高中以下化學課本統一使用鈍氣)、稀有氣體等[10],然而最近也有稱為稀有氣體[6]。
發現史

1868年8月18日,皮埃爾·讓森和約瑟夫·諾曼第·洛克伊爾在觀測太陽的色球層時,發現一種發射光譜中有黃色譜線的物質,他們把該物質命名為「氦」(法語:hélium、英語:helium),該詞源自希臘語ήλιος(ílios),意為「太陽」[11]。在他們之前,英國化學及物理學家亨利·卡文迪什已經在1784年在空氣中發現一種微量的物質,其化學反應活性比氮氣還低。一個世紀之後的1895年,瑞利勳爵比較空氣中分離出的氮氣和化學反應所產生的氮氣,發現它們的密度有所不同。瑞利勳爵與倫敦大學學院的科學家威廉·拉姆齊合作,推測從空氣提取的「氮氣」與另一氣體混合物。此後,他們通過實驗順利地分離一種新的元素:氬,此名稱源自希臘語αργός(argós),意思為「不活躍」[12]。由此發現,元素週期表上欠缺一整類的氣體。在尋找氬氣期間,拉姆齊重複美國地質學家希爾布蘭德的實驗,即把釔鈾礦放在硫酸中加熱,他通過此法成功的分離出氦氣。1902年,德米特里·門捷列夫接受氦和氬元素的發現,並為這些貴氣體納入他的元素排列之內,分類為第0族,而元素週期表即從該排列演變而來[13]。
拉姆齊繼續使用分餾法把液態空氣分離成不同的成分以尋找其他的貴氣體。他於1898年發現三種新元素:氪、氖和氙。「氪」源自希臘語「κρυπτός(kruptós)」,意為「隱藏」;「氖」源自希臘語「νέος(néos)」,意為「新」;「氙」源自希臘語「ξένος(xénos)」,意為「陌生人」。氡於1898年由弗里德里希·厄恩斯特·當發現[14],最初取名為鐳放射物(radium emanation),但當時並未列為貴氣體。直到1904年才發現它的特性與其他貴氣體相似[15]。1904年,瑞利和拉姆齊分別獲得諾貝爾物理學獎和化學獎,以表彰他們在貴氣體領域的發現[16][17]。瑞典皇家科學院主席西德布洛姆致詞說:「即使前人未能確認該族中任何一個元素,卻依然能發現一個新的元素族,這是在化學歷史上獨一無二的,對科學發展有本質上的特殊意義[17]。」
貴氣體的發現有助於對原子結構一般理解的發展。在1895年,法國化學家亨利·莫瓦桑嘗試將氟(電負性最高的元素)與氬(貴氣體)反應,但沒有成功。直到20世紀末,科學家仍無法製備出氬的化合物,但這些嘗試有助於發展新的原子結構理論。由這些實驗結果,丹麥物理學家尼爾斯·玻爾於1913年提出,在原子中的電子以電子層形式圍繞原子核排列,除了氦氣以外的所有貴氣體元素的最外層的電子層總是包含8個電子[15]。1916年,吉爾伯特·路易斯制定八隅體規則,指出最外電子層上有8個電子是任何原子最穩定的排佈;此電子排佈使它們不會與其他元素發生反應,因為它們不需要更多的電子以填滿其最外層電子層[18]。
1962年,尼爾·巴特利特發現首種貴氣體化合物六氟合鉑酸氙[19]。其他貴氣體化合物隨後陸續發現:在1962年發現氡的化合物二氟化氡[20];並於1963年發現氪的化合物二氟化氪[21]。2000年,第一種穩定的氬化合物氟氬化氫(HArF)在40K(-233.2℃)下成功製備[22]。
2006年10月,聯合核研究所與美國勞倫斯利福摩爾國家實驗室的科學家成功地以鈣原子轟擊鐦的方法[23],人工合成出鿫,它是18族的第七個元素[24]。
物理和原子性質
| 性質[15][25] | 氦 | 氖 | 氬 | 氪 | 氙 | 氡 | 鿫 |
|---|---|---|---|---|---|---|---|
| 主要化合價 | 0 | 不詳[註 1] | 0 | 0, +1, +2 | 0, +1, +2, +4, +6, +8 | 0, +2, +6 | -1[26], 0, +1[27], +2[28], +4[28], +6[26](推測) |
| 狀態(標況) | 氣體 | 氣體 | 氣體 | 氣體 | 氣體 | 氣體 | 固體(推測)[29] |
| 密度(g/L) | 0.1786 | 0.9002 | 1.7818 | 3.708 | 5.851 | 9.97 | 7.2(推測) |
| 熔點(°C) | −272.20[註 2] | −248.59 | −189.34 | −157.37 | −111.75 | −71 | 52 ± 15(推測)[30] |
| 沸點(°C) | −268.928 | −246.046 | −185.848 | −153.415 | −108.099 | −61.7 | 177 ± 10(推測)[30] |
| 汽化熱(kJ/mol) | 0.08 | 1.74 | 6.52 | 9.05 | 12.65 | 18.1 | 19.4(推測)[31] |
| 20 °C時在水中的溶解度(cm3/kg) | 8.61 | 10.5 | 33.6 | 59.4 | 108.1 | 230 | 不詳 |
| 原子序數 | 2 | 10 | 18 | 36 | 54 | 86 | 118 |
| 原子半徑(pm)[32] | 31 | 38 | 71 | 88 | 108 | 120 | 152(推測)[33] |
| 電離能(kJ/mol) | 2372 | 2080 | 1520 | 1351 | 1170 | 1037 | 860.1(推測)[34] |
| 電負度 | 4.16 | 4.79 | 3.24 | 2.97 | 2.58 | 2.2 | 不詳 |
由於貴氣體無極性且相對分子質量較小,因而它們的分子間作用力非常弱,所以熔點和沸點非常低[35]。它們在標準狀況下都是單原子氣體,甚至比一般固體元素原子量更大的氙、氡等也是如此[15]。與其它貴氣體元素相比,氦具有一些獨特的性質:它的沸點和熔點低於其它任何已知的物質;它是唯一的一種表現出超流性的元素;它是唯一不能在標準狀況下冷卻凝固的元素——必須在0.95 K(−272.200℃)的溫度施加25個大氣壓(2,500 kPa)的壓力,才能使氦凝固[36]。
到氙為止的貴氣體都有多個穩定的同位素,氡和鿫則沒有穩定同位素。壽命最長的氡同位素222Rn的半衰期只有3.8天,222Rn會衰變為氦和釙,最終衰變產物則是鉛[15];而目前已知的鿫同位素只有294Og,半衰期僅0.7毫秒。[37]
貴氣體原子像大部分族中的原子一樣,由於電子層數的增加,原子半徑隨着週期的增加而增加。原子的大小與影響物質的許多性質。例如,電離能隨着半徑的增加而減少,因為較重的貴氣體中的價電子離核較遠,因此更容易脫離原子核的束縛。貴氣體的電離能是每一個週期中最大的,這反映了它們的電子排佈的穩定性,也導致了它們的化學性質不活潑[25]。然而,有些較重的貴氣體的電離能較小,足以與其它元素和分子相比。巴特利特正是看到了氙的第一電離能與氧分子相似,而嘗試用六氟化鉑來把氙氧化,因為六氟化鉑的氧化性非常強,足以把氧氣氧化[19]。貴氣體不能得到一個電子,而形成穩定的陰離子;也就是說,它們的電子親合能是負值[38][39]。

貴氣體的宏觀物理性質主要來自原子之間的弱范德華引力。原子之間的吸引力隨着原子大小的增加而增加,由於極化性的增加以及電離能的減少。這就是在第18族從上到下,原子半徑和原子間力增加,導致熔點、沸點、汽化熱和溶解度增加的原因。密度的增加則是由於原子序數的增加[25]。
貴氣體在標準狀況下幾乎是理想氣體,但它們與理想氣體狀態方程的偏差提供了分子間作用力的研究的重要線索。蘭納-瓊斯勢,通常用來模擬分子間的作用,由約翰·蘭納-瓊斯根據氖的實驗數據提出,那時量子力學還沒有發展到可以作為從第一性原理(即量子化學從頭計算)理解分子間作用力的工具[40]。這些作用的理論分析變得易於處理,因為貴氣體是單原子,且原子是球形,這意味着原子之間的作用與方向無關(各向同性)[35]。
化學性質


貴氣體組成了元素週期表中的第18族。已經確認的元素是氦(He)、氖(Ne)、氬(Ar)、氪(Kr)、氙(Xe)、氡(Rn)和鿫(Og)[41],前六者在標準狀況下都是無色、無氣味、無味道、不可燃的氣體。 曾經有一段時間,它們稱為元素週期表中的第0族,因為大家認為它們的化合價為零,也就是說,它們的原子不能與其它元素結合而形成化合物。然而,後來發現有些貴氣體確實可以形成化合物(氖除外),這樣「第0族」的名稱便再沒有人使用了[15]。目前對第18族的最新元素鿫了解非常少[42]。
與其他主族一樣,此族元素的電子排佈有固定的模式,尤其是主導化學性質變化趨勢的最外層電子:
貴氣體的價電子層已滿。價電子是最外層的電子,通常只有這些電子參與化學鍵。價電子層已滿的原子是非常穩定的,因此很難形成化學鍵,也極難得到或失去電子[43]。然而,在較重的貴氣體中(例如氡),最外層的電子與原子核之間的電磁力要小於較輕的貴氣體(例如氦),因此較重的貴氣體較容易失去最外層電子[註 3]。
由於價電子層已滿,因此貴氣體可以與電子排佈記法結合起來,形成貴氣體記法。這種記法是先寫出元素之前的最近的貴氣體,然後再寫出從那裏開始的電子排佈。例如,碳的電子排佈是1s22s22p2,貴氣體記法則是[He]2s22p2。使用這種記法更容易識別元素,也比完整的原子軌態記法要簡短[44]。

貴氣體的化學反應活性極低;因此,目前只製備出了數百個貴氣體化合物。氦和氖參與化學鍵的中性化合物目前還沒有成功製備(雖然理論上少數氦的化合物是可以存在的),氡、氙、氪和氬也只表現出極低的活性[45]。根據艾倫電負性的大小,可知反應活性的順序為Ne < He < Ar < Kr < Xe < Rn < Og。
1933年,萊納斯·鮑林預言較重的貴氣體可以與氟和氧反應,生成化合物。他預言了六氟化氪(KrF6)和六氟化氙(XeF6)的存在,推測XeF8可能存在但不穩定,也預測了氙酸可以轉化成氙酸鹽[46][47]。目前已經證明了這些預言基本上是準確的,只有XeF8已知不但熱力學上不穩定,動力學上也不穩定[48]。
氙的化合物是貴氣體化合物中數量最繁多的[49]。在大部分這些化合物中,氙原子的氧化態都是+2、+4、+6或+8,與電負性很高的原子如氟或氧鍵合,例如二氟化氙(XeF2)、四氟化氙(XeF4)、六氟化氙(XeF6)、四氧化氙(XeO4)以及高氙酸鈉(Na4XeO6)。其中有些化合物可以在化學合成中作為氧化劑,特別是XeF2可以作為氟化劑[50]。到2007年為止,已經製備出了大約五百種氙與其它元素鍵合的化合物,包括有機氙化合物(氙與碳原子鍵合),以及氙與氮、氯、金、汞和氙本身鍵合的化合物[45][51]。氙與硼、氫、溴、碘、鈹、硫、鈦、銅和銀鍵合的化合物也已製得,但只能在低溫的貴氣體基質或超音速貴氣體射流中存在[45]。
理論上,氡比氙要更活潑,因此應該比氙更容易與其它原子鍵合。然而,由於氡的同位素皆具高度放射性和極短的半衰期,實際上只製備出了少數氡的氟化物和氧化物[52]。
氪沒有氙活潑,但仍然製備出了一些氪的化合物,其中氪的氧化態為+2[45]。二氟化氪是最重要和最容易製備的氪化合物。氪與氮和氧鍵合的化合物也已製得[53],但分別只在−60 °C(−76.0 °F)和−90 °C(−130.0 °F)以下穩定[45]。
氪原子與其它非金屬(氫、氯和碳)以及一些過渡金屬(銅、銀、金)鍵合的化合物也已製得,但只能存在於低溫的貴氣體基質或超音速貴氣體射流中。2000年用類似的條件製備了最初幾個氬化合物,例如氟氬化氫(HArF),以及一些氬與過渡金屬銅、銀、金鍵合的化合物。到2007年為止,還沒有成功製備出含有氦或氖的共價鍵的化合物[45]。
貴氣體(包括氦)可以在氣相中形成穩定的多原子離子。最簡單是1925年發現的氦合氫離子(HeH+)[54]。因為它含有宇宙中最豐富的兩種元素:氫和氦,因此被認為廣泛存在於星際介質中[55]。除此以外,還有許多已知的貴氣體準分子。這些化合物比如ArF和KrF只能在激發態穩定存在,其中一些用於準分子激光器。
貴氣體原子除了形成共價分子,還能形成非共價化合物。它們的包合物最早於1949年報道[56],這類化合物中一個貴氣體原子被特定的無機或有機配體容納在晶格中。它們形成的必要條件是貴氣體原子的大小必須與配體晶格的大小匹配。例如氬、氪和氙能與氫醌形成包合物,而氦和氖卻不能,因為它們太小並且可極化性不夠強[57]。氖、氬、氪和氙還能形成由冰的晶格容納貴氣體原子的水合物[58]。

貴氣體能形成由富勒烯分子容納貴氣體原子的內嵌富勒烯。1993年時發現60個碳原子的球狀分子C
60,可以與高壓的貴氣體反應形成諸如He2C
60的配合物(2這個記號表示氦原子在C
60分子內,而不是與它形成共價鍵)[59]。截止2008年,富勒烯與氦、氖、氬、氪和氙的配合物都已製得[60]。這些化合物的用途主要是通過貴氣體原子的核磁共振波譜來研究富勒烯的結構和反應性[61]。

2成鍵的三中心四電子鍵模型
貴氣體化合物例如二氟化氙(XeF
2)被視作超價分子,因為它們違反了超價分子。這些化合物的成鍵可以使用三中心四電子鍵模型來解釋[62][63]。這種模型於1951年首次提出,描述了三個共線原子的成鍵狀況。例如XeF
2的成鍵可以用三個原子的p軌態進行線性組合形成分子軌態來描述,氙原子全滿的p軌態與每個氟原子半滿的p軌態重疊,形成一個全滿的成鍵軌態、一個全滿的非鍵軌態和一個全空的反鍵軌態。最高佔有分子軌態(HOMO)定域在兩個端基原子上,這表明氟的高電負性促進了電荷的定域化[64]。
較重貴氣體氪和氙的化學已有了長足的發展,而較輕貴氣體氖和氦仍處於開始階段,而最穩定的氖至今仍沒有一種確認存在的化合物,目前只發現了一些不穩定的陽離子和未經證實的水合物[65]。
自然存在與製備
貴氣體在宇宙中的豐度隨着原子序數的增大而降低。氦是宇宙中僅次於氫的最豐富的元素之一,質量分數大約為24%。宇宙中的大部分氦都是在太初核合成中形成的,但是由於恆星核合成中的氫的聚變,氦的數量仍在不斷增加[66][67]。地球上的豐度則完全不同,氦僅僅是大氣中第三豐富的貴氣體。這種不同的原因是大氣層中沒有太初氦,因為氦的原子質量太小,無法被地球的引力場吸引在地球表面附近,因此會散逸至太空中。地球上的氦來自地殼中重元素(例如鈾和釷)的α衰變,這樣產生的氦往往積聚在天然氣田中[68]。另一方面,較豐富的氬來自於鉀-40的β衰變。鉀-40同樣存在於地殼中,它衰變產生的氬-40是地球上最豐富的氬同位素,儘管它在太陽系中相當稀少。這個過程是鉀氬測年法的理論基礎[69]。氙在大氣中的豐度比預想的要低,這被稱作「氙失蹤問題」(英語:missing xenon problem)。有一種理論認為缺少的氙可能被限制在地殼的礦石中[70]。二氧化氙發現後,有研究認為氙能取代矽酸中的矽從而固定在地殼中。[71]氡在岩石圈中通過鐳的α衰變生成。它會通過裂縫逸出石材進入建築物,並在通風不佳的建築物內積聚。因為氡的放射性很強,它對人體健康有很大的危害。估計僅在美國每年就有21000人死於氡引發的肺癌[72]。至於鿫則不存在於自然界中,只能透過粒子加速器人工合成,且製備難度極大,至今科學家只成功合成出五個(亦可能為六個)鿫原子。[73]
氖、氬、氪和氙都是從空氣中使用氣體液化的方法獲得的,先將各種氣體液化,再根據沸點不同來分餾,將混合物分離成不同的餾分。氦通常提取自天然氣,而氡可以從鐳化合物放射性衰變的產物中分離出來[15]。貴氣體的價格取決於他們的自然豐度,因此氬最便宜而氙最昂貴。右側的表格給出了2004年時實驗量的各種貴氣體在美國的銷售價格。
應用
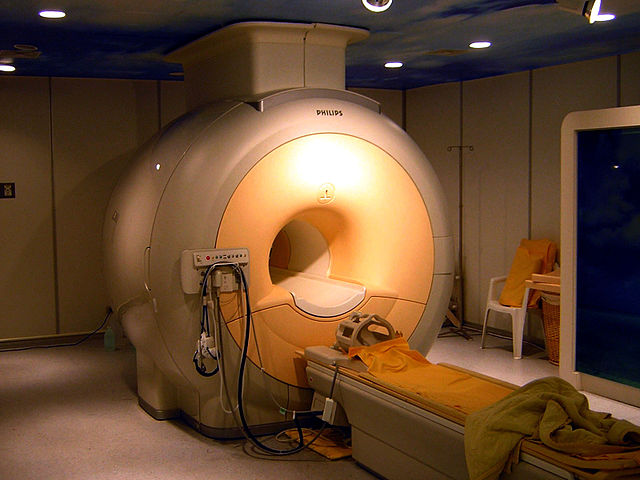
貴氣體的熔沸點非常低,是用途廣泛的低溫學工作介質[78]。特別是沸點低達4.2K(−268.95 °C)的液氦可以用於冷卻核磁共振成像和核磁共振譜學所需的超導磁鐵[79]。儘管液氖的冷卻溫度沒有液氦那麼低,但是仍在低溫學中廣泛使用,因為它的製冷量是液氦的40倍、液氫的3倍[76]。
因為氦在液體尤其是脂質中的溶解度較低,它在潛水員的呼吸氣體中代替了氮氣。人受到類似於水肺潛水的壓力時,氣體會被血液和人體組織吸收,這會造成氮麻醉的嚴重後果[80]。因為溶解度遠比氮氣小,少量的氦被帶入細胞膜。而用氦代替呼吸混合氣中的部分成分時(例如三混氣和氦氧混合劑),潛入較深後上浮時的麻醉反應可以大大減輕[81]。氦的低溶解性為減壓病提供了很好的解決方案[15][82]。由於溶解在體內的氣體減少,上浮時由於減壓而形成的氣泡將大大減少。另一種貴氣體氬被視作水中呼吸器潛水最好的防水衣填充氣體[83]。氦也用作核反應堆中核燃料棒的填充氣體[84]。

自從1937年的興登堡災難以來[85],儘管相對氫氣會使浮力降低8.6%,但因密度小且不可燃,各國仍使用氦氣代替氫氣填充飛艇和氣球[15][86]。
貴氣體在許多場合中用於提供惰性氣氛。氬在化學合成時常用於保護對氮氣敏感的化合物。固態氬也用於研究活性中間體等非常不穩定的化合物,方法是在超低溫下將其隔離在固態氬構成的基質中[87]。氦是氣相色譜法中的載色劑、溫度計的填充氣,並用於蓋革計數器和氣泡室等輻射測量設備中[77]。氦和氬都用作焊接電弧的保護氣和賤金屬的焊接及切割的惰性保護氣。它們在其他冶金過程和半導體工業中矽的生產中同樣有着廣泛應用[76]。


由於化學活性很低,貴氣體廣泛的應用於照明領域。氬和氮的混合氣體是鎢絲膽中填充的保護氣。氪可降低燈絲的蒸發率而常用於色溫和效率更高性能鎢絲膽,特別在鹵素燈中可將氪與少量碘或溴的化合物混合充入。此外,在放電燈中填充不同的貴氣體,可以產生不同顏色的光,如霓虹燈中常見的氖燈。儘管稱為氖燈,其中通常含有其他氣體和磷,它們在氖發出的橙紅色光的基礎上加入了其他顏色。氙通常用於氙弧燈,因為它們的近連續光譜與日光相似。這種燈可用於電影放映機和汽車前燈等[76]。
貴氣體可用於準分子激光器,這是因為它們可形成短暫存在的電子激發態受激子[註 4](英語:excimer)。這些用於激光器的受激子可能是貴氣體二聚體,例如Ar2、Kr2或Xe2,更有可能是與鹵素結合的受激子,例如ArF、KrF、XeF或XeCl。這些激光器產生波長較短的紫外線,其中ArF產生的紫外線波長為193納米,而KrF為248納米。這種高頻率的激光使高精密成像成為現實。準分子激光有諸多工業、醫藥和科學用途。集成電路製造過程中的顯微微影法和微製造必須用到準分子激光。激光手術,例如血管再成形術和眼部手術也需用到準分子激光[88]。
一些貴氣體有直接的醫學用途,如:氦有時用於改善哮喘患者的呼吸[76];氙則因為在脂質中的高溶解度成為一種麻醉劑,比常用的一氧化二氮(俗稱笑氣)更為有效,且容易從體內排出而麻醉後甦醒也較快[89]。氙在超極化核磁共振成像中用於拍攝肺的醫學影像[90]。具有強放射性的氡可用於放射線療法,由於其半衰期很短,通常只能製取出極少量[15]。
大多數離子推進器以貴氣體作為推進劑。由於離子推進器不是以化學反應驅動的,因此需要化學惰性的燃料來防止燃料與推進器上的任何其他物質發生不必要的反應,從而腐蝕機體,減短使用壽命,化學惰性的燃料也能避免對環境造成污染。[91]目前許多推進器都使用氙作為燃料,因為它的高原子序使其電離能很低,從而很容易電離。且氙在室溫下能夠以液態儲存,在推進器運作時可輕易轉化為氣體。然而,目前全球氙供應短缺且價格昂貴(2021年每公斤氙約3,000美元)。[92]2018至2023年間,星鏈網絡衛星上的霍爾效應推進器使用成本更低的氪作為燃料,之後星鏈衛星改用氬霍爾效應推進器以求更高的比衝[93]。
由於鿫只能用粒子加速器人工合成,且製備難度極大,製備出的量又極少(至多幾顆原子),生成後又會很快衰變,因此除了學術研究之外沒有任何實際用途。
放電色

|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
| 氦 | 氖 | 氬 | 氪 | 氙 |
氣體放電發出的光的顏色取決於多個因素,包括[94]:
註釋
參見
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.





