核糖體
来自维基百科,自由的百科全书
核糖體(ribosome),舊稱「核糖核蛋白體」或「核蛋白體」,是細胞中的一種細胞器[1][注 1],它也是一種非膜狀特殊構造,由一大一小兩個次單元結合形成[2],主要成分是相互纏繞的RNA(稱為「核糖體RNA」,ribosomal RNA,簡稱「rRNA」)和蛋白質(稱為「核糖體蛋白質」,ribosomal protein,簡稱「RP」)。核糖體是細胞內蛋白質合成的場所,能讀取信使RNA核苷酸序列所包含的遺傳資訊,並使之轉化為蛋白質中氨基酸的序列資訊以合成蛋白質[3]。在原核生物及真核生物(地球上的兩種具有細胞結構的主要生命形式,前者可細分為古菌、真細菌兩類)的細胞中都有核糖體存在。一般而言,原核細胞只有一種核糖體,而真核細胞具有兩種核糖體(線粒體和葉綠體中的核糖體與細胞質核糖體不相同)。
此條目需要補充更多來源。 (2016年10月9日) |
核糖體在細胞中負責完成「中心法則」裏由RNA到蛋白質這一過程[4],此過程在生物學中被稱為「轉譯」。在進行轉譯前,核糖體小次單元會先與從細胞核中轉錄得到的信使RNA(messenger RNA,簡稱「mRNA」)結合,再結合核糖體大次單元構成完整的核糖體之後,便可以利用細胞質基質中的轉運RNA(transfer RNA,簡稱「tRNA」)運送的氨基酸分子合成多肽[5]。當核糖體完成對一條mRNA單鏈的轉譯後,大小次單元會再次分離。
英語中的「核糖體」(ribosome)一詞是由「核糖核酸」(「ribo」)和希臘語詞根「soma」(意為「體」)組合而成的。
概述
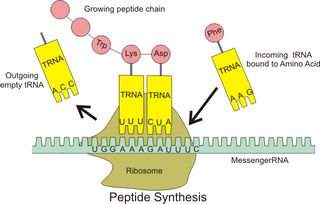
古菌、真細菌的細胞質中以及真核細胞的細胞質基質、線粒體和葉綠體中都含有核糖體,但它們各自擁有的核糖體在大小、數量及組成等方面上都有所不同[6]。
- 大小
核糖體的中軸線比直徑稍長。 原核細胞中的70S核糖體直徑約為20nm(200Å),相對分子質量約為2.5MDa[7];真核細胞細胞質基質中的80S核糖體直徑則介於25nm至30nm之間(250-300Å),相對分子質量為3.9-4.5MDa,比70S核糖體大40%[8],真核細胞線粒體內的線粒體核糖體也比70S核糖體稍大一些[9]。
- 數量
核糖體是原核細胞中唯一的一種細胞器,每個原核細胞中一般含有約15-18×103個核糖體;每個真核細胞中一般有106至107個核糖體。蛋白質合成旺盛的細胞(如未成熟的蟾蜍卵細胞)中核糖體往往比正常細胞多,其含量可達每個細胞約1012個[10]。哺乳動物的成熟紅血球不具有核糖體[11]。
- 組成
核糖體都由rRNA及RP構成,是rRNA與RP的複合物,屬於核糖核蛋白(Ribonucleoprotein,簡稱「RNP」)。每個核糖體包含2-4條rRNA與60-90種RP[注 2]。70S核糖體中,rRNA約佔65%,核糖體蛋白質約佔35%;80S核糖體中,rRNA與RP之比接近1:1;而線粒體核糖體中蛋白質所佔比例是最高的,在這類核糖體中,rRNA約佔25%,核糖體蛋白質約佔75%。由於核糖體的核心成分是RNA(而非DNA),核糖體被部分生物學家認為是「RNA世界」遺留至今的痕跡[12]。(參見本條目組成章節。)
- 結構
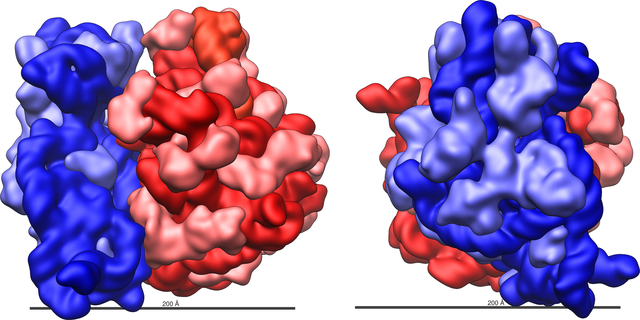
原核生物的核糖體與真核生物的核糖體十分相似[13],每個核糖體都由一大一小兩個相互嵌合的次單元組成。根據改進自二位點模型(two-site model)的三位點模型(three-site model)[14],核糖體中含有A、P、E三個與tRNA結合的位點[15]。除以上三個tRNA位點之外,核糖體中還有結合mRNA及一些轉譯因子的位點。(參見本條目結構章節)
- 功能
核糖體可以與mRNA結合,在多種轉譯因子的輔助下讀取其中的遺傳資訊,並按照特定的資訊利用tRNA轉運來的氨基酸合成具有特定一級結構的多肽。對該過程有重要作用的活性區域是由RNA構成的,所以核糖體也被歸為核酶[16]。(核糖體執行其功能的詳細過程參見本條目工作過程章節)
- 分類
核糖體可按沉降係數、細胞中的存在位置及狀態等分類。
- 根據沉降係數的大小分類:55S核糖體、70S核糖體及80S核糖體等。
- 根據在細胞中的位置分類:細胞質核糖體、線粒體核糖體、葉綠體核糖體等。
- 根據在細胞中的分佈分類:游離核糖體、膜結合核糖體[來源請求]。
- 單位
研究核糖體及相關物質時常用代表單位離心力場下的沉降速度的沉降係數(sedimentation coefficient)來描述[注 3]。沉降係數的一般表達式為[注 4][17]:
歷史事件
核糖體是由羅馬尼亞籍細胞生物學家喬治·埃米爾·帕拉德用電子顯微鏡於1955年在哺乳類與禽類動物細胞中首次發現直徑20nm,富含RNA,能夠製造酶,他將這種新細胞器描述為密集的微粒或顆粒[18]。一年之後,A. J. Hodge等人在多種植物的體細胞中也發現了核糖體,可是當時人們仍無法將微粒體中的核糖體完全區分開來[19]。後來,喬治·帕拉德以及阿爾伯特·克勞德和克里斯汀·德·迪夫因發現核糖體於1974年被授於諾貝爾生理學或醫學獎。
雖然核糖體作為一種細胞器在20世紀50年代初期已被發現,但對這種細胞器仍沒有統一的命名。直到1958年,科學家理查德·B·羅伯茨(Richard B. Roberts)才推薦人們使用「核糖體」一詞:
| “ | 在研討會中出現了一個有關語義的問題:對於部分與會者,『微粒體』意為受到其他蛋白質或脂質污染的微粒體碎片中的核糖核蛋白;而對於其他人,『微粒體』這個概念則包含被其他粒子污染的蛋白質或脂質。『微粒體粒子』這個詞不能充分傳達其意義,但『微粒體碎片中的核糖核蛋白粒子』又顯得太拗口。所以與會期間,『核糖體』一詞被舉薦出來,這個詞讓大家都很滿意,而且聽起來也比較順耳。如果『核糖體』這個詞可以用來表示大小介於35S至100S的核糖核蛋白顆粒,那麼現在這類物質表述上的混亂便最終得以消除。 | ” |
| ——理查德·B·羅伯茨,《微粒體顆粒與蛋白質合成》[20][注 6] | ||
從此,人們對幾種細胞結構碎片概念上的理解逐漸清晰,核糖體這一細胞器本身也有了更明確的定義。這次統一命名為核糖體及相關方面的研究的發展奠定了良好的基礎。
在進入20世紀60年代後,隨着人們對核糖體的探索的不斷深入,許多學術成果也不斷湧現。蘇聯生物化學家亞歷山大·謝爾蓋維奇·斯皮林經過長期研究,發現核糖體各組分實際上不需其他物質輔助即可發生自我組裝[21]。Warner JR等人在1963年發現眾多核糖體共同轉譯同一條mRNA的現象,並將他們發現的結構名命為「多核糖體」(polyribosome)[22]。而B. J. McCarthy和J. J. Holland則1965年發現被干擾的核糖體在無細胞系統中可直接利用DNA作為模板合成蛋白質,而新黴素等抗生素可增強這種特殊的轉譯[23]。在對不同類型的核糖體的研究方面,湯姆·奧布賴恩等人作出了較大貢獻:1967年,奧布賴恩等人在大鼠肝臟細胞的線粒體中發現核糖體[24]。1971年,奧布賴恩等證實之前在線粒體中發現的沉降係數約為55S的核糖體是與70S核糖體或80S核糖體都不相同的另一類核糖體[25]。同年,奧布賴恩等人又在牛胚胎的肝臟細胞線粒體內發現原本以為只存在於細胞質基質中的80S核糖體,並證實這些80S核糖體仍具有合成蛋白質的活性[26]。
20世紀末各種顯微技術的發展使人們對微觀事物的研究上了一個台階。2000年,Poul Nissen等人測得核糖體大次單元中正在形成的肽鍵周圍1.8nm範圍內除了23S rRNA結構域Ⅴ的部分原子外,不存在任何核糖體蛋白質側鏈原子,從而證明了核糖體是一種核酶[27]。
核糖體及轉譯系統中的相關分子(例如一種被稱為轉譯裝置(translational apparatus)的分子)的結構及功能是20世紀中期研究的熱點。直到今天,該領域的研究仍十分活躍。
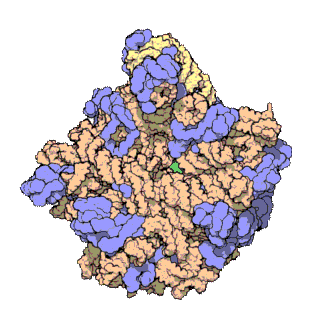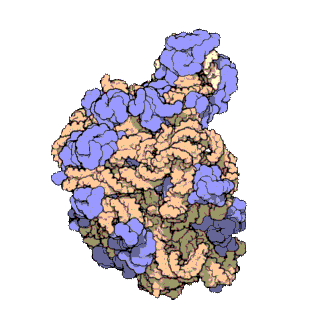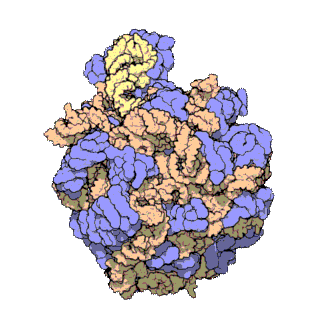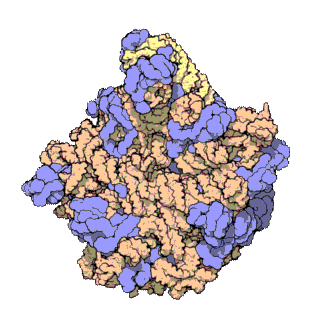
早在20世紀70年代初期,人們已開始着手了解核糖體整體的分子結構。
21世紀初,在人們有能力對亞顯微結構進行高解像度的研究後,描述核糖體結構的精確度達到十分之一納米[來源請求]。
2000年,最初幾份關於核糖體原子級結構的論文連續發表:最先公佈的是屬於古菌中的死海鹽盒菌(Haloarcula marismortui)核糖體50S次單元的結構圖[28]和屬於細菌中的抗輻射奇異球菌(Deinococcus radiodurans)[29]。不久之後,屬於嗜熱棲熱菌(Thermus thermophilus)核糖體30S次單元的結構圖也被公佈[30]。緊接着,又有一份更精細的結構圖被公佈[31]。九年後,文卡特拉曼·拉馬克里希南、托馬斯·施泰茨和阿達·約納特因為確定這些核糖體的詳細結構和機制而被授予2009年諾貝爾化學獎[32]。2001年5月,上述幾份結構坐標被用於重現精確到5.5Å的嗜熱棲熱菌完整的70S核糖體分子結構[33]。
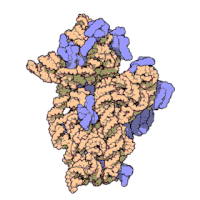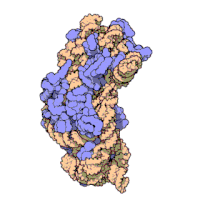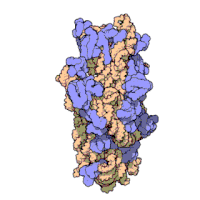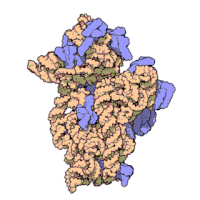
兩份關於大腸桿菌(Escherichia coli)的70S核糖體結構的論文則於2005年被發表。論文中描述了使用X射線晶體學方面的技術獲得解像度高達3.5Å的中空核糖體(未結合mRNA或tRNA的核糖體)的結構[34]。在該篇論文發表兩周後,一份基於冷電子顯微鏡技術的結構圖被公佈[35],該圖以11-15Å的解像度描繪了核糖體中一條剛合成的肽鏈被輸入蛋白質輸出通道(protein-conducting channel)的畫面。一年之後,結合了mRNA和tRNA的核糖體的原子級結構圖由兩個研究小組分別以2.8Å的解像度[36]及3.7Å的解像度[37]獨立繪出。這些結構圖使人們最終看到嗜熱棲熱菌核糖體與在該核糖體經典區域中結合的mRNA、tRNA一起反應的細節。過了不久,核糖體與一些含有夏因-達爾加諾序列的長鏈mRNA的反應也被在4.5-5.5Å的解像度下可視化[38]。
在2011年,第一個從酵母中的釀酒酵母菌(Saccharomyces cerevisiae)的真核生物80S核糖體的完整的原子結構由晶體繞射獲得。[39]該模型揭示了真核生物特有要素的結構以及它們與普遍保存內核的相互作用。
合成
在細菌細胞中,核糖體是通過對多個rDNA的操縱組的轉錄在細胞質中合成的[40]。 在真核細胞中,核糖體的合成主要發生在細胞核的核仁(細胞核中的一個區域)里。在該區域中,rDNA轉錄產生的45S rRNA前體(rRNA的前體分子)與從細胞質中運來的蛋白質結合形成80S rRNP前體,80S rRNP前體再經過加工(其中的45S rRNA前體被RNA酶裂解成5.8S rRNA、18S rRNA及28Sr RNA的較小的rRNA片段),在5-10min內剪切成32S rRNP和20S rRNP。20S rRNP在5min內再經加工形成12S rRNP,率先裝配成40S核糖體次單元。32S rRNP在經加工剪切為28S rRNP及5.8S rRNP後,需耗費約30min才能與在核仁外合成的5S rRNA(5S rDNA不定位在核仁組織區)共同裝配成60S核糖體次單元。[41]大小次單元經核孔排入細胞質後,裝配成核糖體。
核糖體一般的合成過程需要超過200種蛋白質的協同配合來完成聚合、加工核糖體內的4個rRNA,以及將rRNA和多種核糖體蛋白捆綁、組裝在一起。
大小次單元在細胞質中可分離存在,但兩者嵌合成完整核糖體後才具備轉譯能力[42]。
當Mg2+的濃度為10mmol/L時,大小次單元聚合;Mg2+的濃度降至0.1mmol/L時,大小次單元則會發生解聚[43]。
分佈及分佈狀態
在真核細胞中,細胞質核糖體以其分佈狀態分為游離核糖體(free ribosome)與膜結合核糖體(membrane-bound ribosome)兩類。同一種生物的游離核糖體與膜結合核糖體在結構上是沒有區別的,它們的不同只在於兩者在細胞中分佈位置上的差異。
約70%的細胞質核糖體處於游離狀態[44],這些懸浮在細胞質基質中的核糖體稱為「游離核糖體」。游離核糖體幾乎可以在細胞質基質中沿細胞骨架任意移動。在游離核糖體上合成的蛋白質會直接釋放到細胞質基質中,這些蛋白質只能用於構成該細胞自身結構(稱為內源性蛋白,如肌紅蛋白或肌纖維蛋白等)。
由於細胞質在整體上處於還原氛中且常含有高濃度的穀胱甘肽,所以具有二硫鍵的蛋白質(二硫鍵由半胱氨酸殘基形成)不能在游離核糖體中合成。
一個核糖體是處於游離態還是膜結合態僅僅取決於它們正在轉譯的mRNA單鏈首端第一個三聯體密碼子(AUG)之後是否有一段「內質網靶向信號序列」(ER-targeting signal sequence,長度約為45-90nt),該序列經核糖體轉譯,能得到長度約為16-26個氨基酸的多肽片段(稱為「信號肽」,signal peptide),這種合成了信號肽的核糖體在肽鏈延伸約80個氨基酸殘基後將進入膜結合態[注 7],附着在內質網上[45]。
核糖體轉譯出的信號肽暴露在細胞質基質中,會被信號識別粒子(Signal Recognition Particle,簡稱SRP)識別結合,SRP能以其類似tRNA分子的構型佔據核糖體的A位點,使核糖體轉譯暫時停止。SPR可識別糙面內質網膜上相應的SRP受體(又稱停泊蛋白,docking proteins),而SRP受體又能使核糖體通過它與內質網上的易位子(translocon)相連[注 8]。當核糖體停止浮動後,SRP便與其受體分離,但核糖體將仍粘附在內置網膜上開始繼續轉譯,延伸的肽鏈則穿過易位子中的通道進入糙面內質網腔[46]。
另一些粘附在內質網的膜上[注 9]或核膜上的核糖體稱為「膜結合核糖體」。當一個核糖體開始形成一些其他細胞器中需要利用到的蛋白質時,這類核糖體可以與相應細胞器的細胞器膜相結合,成為膜結合核糖體。在真核細胞中,這一過程發生在一類稱為糙面內質網的內質網上。正在延伸中的肽鏈會不斷地被膜結合核糖體透過內質網膜注入內質網腔中,再以囊泡的形式通過分泌途徑(Secretory pathway)輸送到的其他部位。膜結合核糖體既可以合成在細胞內被利用的蛋白質,也可以合成需要通過胞吐排出細胞的分泌蛋白(又稱為「外輸性蛋白質」,如抗體、蛋白質類激素等)[來源請求]。
常見多個核糖體排列成螺紋狀或念珠狀,一起沿着一條mRNA單鏈進行轉譯。這種由一個mRNA串起來的多個核糖體的結構被稱為「聚核糖體」或「多聚核糖體」,它可以提高mRNA的轉譯效率[47]。
組成
- 原核細胞擁有沉降係數為70S的70S核糖體,它由沉降係數為30S的小次單元的和沉降係數50S的大次單元組成。70S核糖體包含3種沉降係數不同的rRNA和大約55種RP,其中小次單元由16S rRNA(重約0.6MDa、長約1540nt[48])和21種RP構成,大次單元由5S rRNA(重約40kDa,長約120nt[49])、23S rRNA(重約1.2MDa,長約2900nt[50])和34種RP構成。[51][52]
- 真核細胞擁有沉降係數為80S的80S核糖體,它由沉降係數為40S的小次單元和沉降係數為60S的大次單元組成。80S核糖體包含4種沉降係數不同的rRNA及逾80種RP。其中,小次單元由18S rRNA(重約0.7MDa,長約1900nt)和約33種RP構成,而大次單元則由5S rRNA(性質與70S核糖體內的基本相同)、5.8S rRNA(重約40kDa,長約160nt)、28S rRNA(重約1.7MDa,長約4700nt)和約49種RP構成。[50][51][52]一些真核生物的線粒體或葉綠體中也包含有一大一小兩個以蛋白質相連的次單元的70S核糖體。根據「內共生學說」,真核細胞中的線粒體及葉綠體都是由被其他細胞吞噬的細菌演化而來的,所以這兩種細胞器中存在的核糖體與細菌細胞中的相似[53]。
- 粒線體核糖體(mitoribosome),或55S核糖體,由沉降係數為28S的小次單元和沉降係數為39S的大次單元組成[54]。線粒體核糖體中含有2-3種rRNA和60-80種RP,作為比較人類線粒體核糖體含有78種RP[55],其中小次單元中含有長度約為950nt的12S MT-RNR1,而大次單元中則含有長度約為1560nt的16S MT-RNR2[50]。高等植物的線粒體中另外含有一種沉降係數也為5S,但與細胞質基質中的核糖體的5S rRNA不同的rRNA[來源請求]。
- 葉綠體核糖體在組成上與原核細胞中的70S核糖體基本相同[來源請求]。
解離從細胞內分離得到的核糖體除了能得到其本身包含的多種較難脫離的、屬於核糖體蛋白質的分子(稱為「真核糖體蛋白質」,real ribosomal proteins)外,還可以得到附着在核糖體上的其他蛋白質(稱為「核糖體相關蛋白質」,proteins associated with ribosome,簡稱「PAR」)。這些不是核糖體實際組分的分子主要為參與轉譯過程但並非核糖體組成部分的轉譯因子,容易被洗脫[來源請求]。
結構

核糖體都由一大一小兩個次單元構成,這兩個次單元中各具有為合成中的肽鏈、mRNA、tRNA及轉譯因子等分子提供的特殊的結構。核糖體大次單元與小次單元之間存在稱為「橋」的接觸面,總共有12對橋將大、小次單元連接起來,它們還起到大、小次單元間傳遞資訊的作用。70S核糖體的這些橋中,除了3對橋中包含了RP,其餘的橋都由rRNA組成。rRNA橋主要由16S rRNA小溝與23S rRNA小溝之間的相互作用來建立。rRNA-RP橋則通過蛋白質識別RNA結構而實現[56]。
核糖體大次單元外側邊緣有三個較明顯的凸起,凸起之間有兩處凹陷。大次單元內部有一條起源於肽酰轉移酶中心附近,橫貫大次單元的、為合成中的肽鏈提供的狹長通道(稱為「肽鏈輸出通道」),這條通道長約35aa[57](約8.5nm)。各種原核生物50S大次單元肽鏈輸出通道的孔徑大小並不完全相同(孔徑最大約2nm,最小約1nm),主要由23S rRNA構成,同時需要一些RP(如L4、L22、L39等)輔助成形[56]。有研究認為該通道具有動態的結構,不僅能與新生肽鏈中的效應模體相互作用調節轉譯效率,而且能夠調節通過通道的多肽鏈的共轉譯摺疊及轉譯後修飾[58]。
核糖體小次單元大致呈扁弧形,一面也有凹陷。在小次單元一端約三分之一處有一條為mRNA穿過提供的凹槽(也稱為小次單元的「頸部」),該凹槽處的空間局限使得mRNA的解碼區呈現U形轉角構象[56]。
在進行轉譯前,兩個游離的次單元結合在一起,協同轉譯夾在兩者之間的mRNA鏈[來源請求]。
- 核糖體A位點(amino acyl-tRNA site,簡稱「A位」),也稱「受位」,是核糖體內接受新胺醯-tRNA的位點,主要部分位於大次單元中。在A位處5S rRNA有一段序列能與胺醯-tRNA的T29C環的保守序列互補,便於新胺醯-tRNA移入A位。起始用的tRNA沒有該段序列,故它只能直接進入核糖體P位。[57]
- 核糖體P位點(peptidyl-tRNA site,簡稱「P位」),也稱「供位」,是核糖體內前一個tRNA將其肽基或甲酰甲硫胺醯基轉移至後一個tRNA上的位點。該位點在大次單元中的區域含有肽酰轉移酶。在對核糖體結晶學的研究中人們發現,核糖體該位點內的肽酰轉移酶附近1.8nm的範圍內並沒有核糖體蛋白質[59](一般認為細胞中的主要催化劑的化學本質是蛋白質)。該發現表明,核糖體中的蛋白質組份本身可能並不直接作為催化劑,而是充當rRNA依附的架構,並起到增強rRNA催化能力的作用(參見:核酶)。
- 核糖體E位點(exit site,簡稱「E位」),是空載tRNA離開的核糖體的位點[來源請求]。
工作過程

原核細胞與真核細胞中進行的轉譯過程並不完全相同,大致可分為被原核轉譯、真核轉譯與古菌轉譯[60]三種類型。這三種類型轉譯步驟基本相同,但這幾種轉譯中利用的核糖體、mRNA及tRNA等在結構上有一定差異,且各需要一套轉譯因子系統的參與(其中真核轉譯中涉及的生物大分子約有200種[61])。
由核糖體主導的轉譯主要可分為起始、延伸、終止及再循環4個步驟[62]。
核糖體對mRNA的轉譯過程是迅速且準確的。在37℃時,細菌細胞內合成肽鏈的速度約為每秒連接15個氨基酸[3]。當其合成速度達到每秒連接1000個氨基酸時,錯誤率約為十萬分之一[63]。

原核轉譯與轉譯中的起始過程基本相同:都先由fmet-tRNA、待轉譯mRNA和核糖體組成轉譯起始複合物(translation initiation complex)[64]。轉譯的起始過程需要起始因子參與,已發現的原核起始因子有3種,古菌起始因子有4種,真核起始因子有12種。
- 在原核轉譯中,待轉譯mRNA5'端上游的夏因-達爾加諾序列(S-D序列)可通與核糖體小次單元16S rRNA3'端的反夏因-達爾加諾序列的互補而結合[65]。緊接S-D序列的短核苷酸序列可被小次單元核糖體蛋白識別結合,mRNA在這兩方面作用下小次單元上定位。在mRNA與小次單元結合後,fMet-tRNAfMet結合於mRNA-小次單元複合體的起始密碼子上,形成30S轉譯起始複合物,大次單元再與該複合體結合,形成70S轉譯起始複合物[66]。左圖是原核轉譯起始過程的圖解。
- 在真核轉譯中,已發現的起始方式有4種:帽依賴性起始(cap-dependent initiation)、重新起始(reinitiation)、核糖體支路(ribosome shunting)及內部起始(interal initiation)[67],其中,帽依賴性起始為主要的起始方式。在帽依賴性起始中,mRNA5'端帽上結合的帽結合蛋白(cap-binding protein,CBP)異源二聚體能促進mRNA分子在核糖體上的定位[68],在這個過程中,如果檢測到mRNA上提前出現無義終止密碼子,無義介導的mRNA降解機制(nonsense-mediated mRNA decay,NMD)便會將錯誤的mRNA降解[69]。在真核轉譯起始過程中,mRNA依靠科扎克共有序列與核糖體小次單元識別結合[70][71]。
轉譯起始後,核糖體沿mRNA鏈由5'端朝3'端移動。從起始密碼子處開始,核糖體利用具有與當前正在轉譯的密碼子相對應的反密碼子的胺醯-tRNA攜帶的氨基酸合成肽鏈。核糖體每轉譯一個三聯體密碼子就為延伸中的肽鏈的C端添加一分子氨基酸,其自身也同時順着mRNA單股移動一段距離。
肽鏈延伸階段是一個不斷循環進行的過程(直至核糖體到達終止密碼子處)。該階段可再細分為進位、成肽和移位三個步驟。真核及原核轉譯延伸階段的不同主要在於各自延伸因子體系的不同:已發現的原核延伸因子有3種,古菌延伸因子有2種,真核延伸因子有2種[72]。

根據核糖體A位內mRNA部分密碼子的引導,具有對應反密碼子的氨基酰-tRNA進入A位的步驟,稱為「進位」。
- 原核轉譯中,結合了GTP的延伸因子EF-Tu(EF-Tu·GTP)與氨基酰-tRNA形成氨基酰-tRNA·EF-Tu·GTP三元複合物並進入核糖體A位。EF-Ts催化水解複合物攜帶的GTP產生能量完成進位。之後,EF-Tu·GDP脫離核糖體,EF-Tu則釋放出GDP並與EF-Ts重新複合形成EF-T,以待再次被利用。
- 真核轉譯中,氨基酰-tRNA由eEF-1以複合成氨基酰-tRNA·eEF-1·GTP三元複合物的形式帶入核糖體的A位[73]。GTP水解後,eEF-1·GDP離開核糖體。在真菌細胞中,延伸步驟還需要第三種真核延伸因子(eEF-3)參加,其作用是維持轉譯的準確性[72]。

核糖體的肽酰轉移酶催化位於核糖體P位的tRNA上運載的甲酰甲硫胺醯基或肽酰基轉移到A位內剛進入核糖體的新氨基酰-tRNA轉運的氨基酸上,使前者的羧基與後者的氨基之間脫水縮合形成肽鍵。此步驟稱為「轉肽」(transpeptidation)。
轉肽步驟完全由核糖體大次單元內的核酶催化完成[74]。在轉肽這一步驟中生成的肽酰-tRNA將佔據核糖體A位,而P位中剛卸載甲酰甲硫胺醯基或肽酰基的空載tRNA則將進入核糖體的E位。

EF-G將位於核糖體A位的tRNA推入P位的步驟稱為「移位」。
EF-G具有轉位酶活性,能催化GTP水解提供能量,推動處於核糖體A位的肽酰-tRNA[75],使之進入P位(同時使P位中的tRNA進入E位、並使E位的tRNA排出核糖體),核糖體也沿mRNA移動一個密碼子。核糖體移位後,其A位將再次空出,為新氨基酰-tRNA進位提供空間。
在肽鏈延伸的過程中,上述三個步驟是重複循環的。循環每完成一次,肽鏈的C端便加入一個氨基酸分子,直至轉譯進入終止階段。

在核糖體讀取至終止密碼子[注 10]時,轉譯進入終止階段。轉譯的終止需要釋放因子的參與[76]。已發現的原核釋放因子有3種,而真核釋放因子有2種[77][注 11]。
轉譯終止失敗可能導致核糖體越過終止密碼子,朝mRNA的3'端繼續轉譯,這種現象稱為「聯讀轉譯」(read-through translation)。已發現多種mRNA聯讀轉譯的產物達到可檢測的水平。許多具有重要生理意義的蛋白質就是通過這種方式合成的。[82]
核糖體再循環是核糖體參與的轉譯中的最後一個過程。在該過程中,核糖體複合物發生解體,以便投入下一次使用。該過程是在核糖體再循環因子(RRF)和參與蛋白質合成過程中轉位的延伸因子(EF-G)的協同作用下完成的。核糖體在其再循環過程中由RRF的結構域Ⅰ識別結合核糖體的功能。RRF的結構域Ⅱ則具有將核糖體解離為大、小次單元的能力。[83]
功能抑制
化學藥劑師如今已可以利用細菌與真核生物(如人類)細胞中核糖體結構的差異來提取或合成能抵抗細菌感染而不損傷受感染者自身細胞的抗生素(如氨基糖苷類抗生素、四環素類抗生素等蛋白質合成抑制劑類抗生素),這類抗生素能抑制感染患者的病原體微生物的細胞內的蛋白質合成。基於70S核糖體與80S核糖體結構上的不同,細菌細胞中的70S核糖體較容易受到某些抗生素的損害而真核細胞中的80S核糖體卻可以不受影響[84]。雖然一些真核生物的線粒體中也含有類似細菌核糖體的70S核糖體,但線粒體擁有具有一定選擇透過性、使這些抗生素不能隨意透過的雙層磷脂雙分子膜,所以這些細胞器也可以避免該類抗生素對其中核糖體的影響[85]。
參見
註釋
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


