Loading AI tools
一種免疫細胞 来自维基百科,自由的百科全书
吞噬細胞為一類防衛細胞,它們通過吞噬細菌、壞死細胞和凋亡細胞等有害物質來保衛有機體。其原文「Phagocytes」的前半部來自古希臘語的「φαγεῖν」(phagein,意為「食用、吞食」),後半部「-cyte」為細胞(cell)的詞綴,來自古希臘語的「κύτος」(kutos,意為「中空容器」)[1]。吞噬細胞在對抗感染以及後續的免疫過程中不可或缺[2],它在整個動物界中都相當重要[3],在脊椎動物體內特別發達[4]。一公升的人類血液約含六十億個吞噬細胞[5]。1882年,伊利亞·梅契尼可夫在研究海星幼蟲時發現了吞噬細胞[6],並因此獲得1908年諾貝爾生理醫學獎[7]。一些阿米巴的行為亦與巨噬細胞(吞噬細胞的一種)相似,說明吞噬細胞在生命進化的早期階段就已出現[8]。
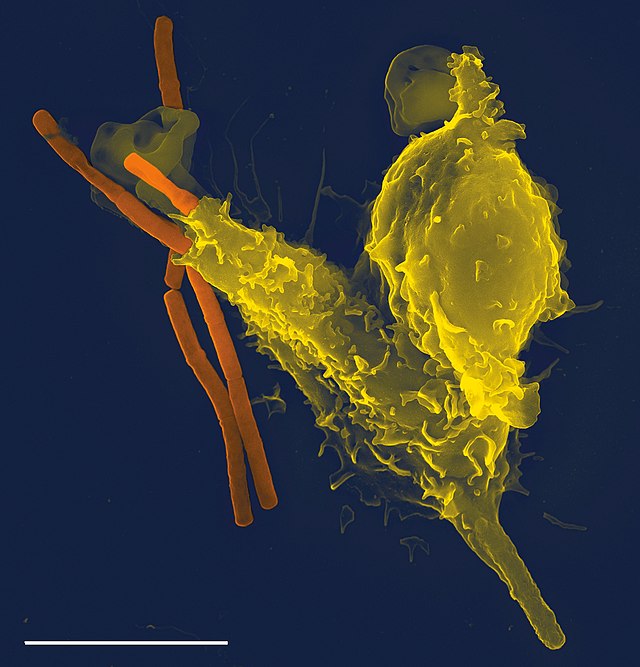
吞噬細胞可由他們在吞噬過程中的特性分為專職(professional)與非專職(non-professional)的吞噬細胞[9],許多類型的白血球都是專職吞噬細胞(如嗜中性顆粒白血球、單核細胞、巨噬細胞、肥大細胞、樹狀細胞等)[10]。專職吞噬細胞和非專職吞噬細胞的主要差別在於專職吞噬細胞表面具有受體分子,受體可以偵測細菌表面上一般不存在生物體內的分子[11]。吞噬細胞除了在對抗感染的過程中發揮很大的作用,它亦能清除壞死或凋亡的細胞,使生物的各種組織保持健康狀態[12]。
在感染過程中,化學訊號使吞噬細胞前往病原體侵入處。這些化學物質可能來自細菌,也可能來自其它已經出現的吞噬細胞。吞噬細胞通過趨化作用進行移動。當吞噬細胞與細菌接觸後,其表面的受體會與細菌結合,從而引導吞噬細胞將細菌吞噬[13],吞噬細胞隨後利用活性氧類(ROS)以及一氧化氮殺死它所吞噬的細菌[14]。在吞噬完成後,巨噬細胞以及樹狀細胞亦可參與抗原呈現的過程。在該過程中,吞噬細胞吞噬物質後會將其一部分轉移到細胞表面,隨後這些物質會展現給其它免疫細胞。一些吞噬細胞會移動到生物體的淋巴結,並將上述物質呈現給淋巴細胞(一種白血球),此過程對建立特異性免疫相當重要[15]。但許多病原體都演化出了逃避吞噬細胞攻擊的機制[2]。

俄羅斯動物學家伊利亞·梅契尼可夫(1845–1916)爲第一個發現吞噬細胞的人。1882年,他在研究海星幼蟲體內的能動(自由移動)細胞時,相信這類細胞對動物的免疫防禦相當重要。為了驗證他的猜想,他將一段取自柑橘樹的小木刺插入海星體內,幾個小時後,他注意到能動細胞聚集在了木刺周圍[16]。梅契尼可夫之後去了維也納,和卡爾·克勞斯(Carl Friedrich Wilhelm Claus)分享他的想法。卡爾提議將梅契尼可夫發現的細胞命名為「phagocyte」[17]。「phagocyte」一詞源於希臘語的「phagein」(吃,吞食)和「kutos」(中空容器)[1],中文則據此譯為「吞噬細胞」。
一年之後,梅契尼可夫對水蚤進行研究,水蚤是一種微小且通體透明的淡水甲殼動物,可在顯微鏡下直接觀察體內細胞,梅契尼可夫發現攻擊水蚤的真菌都被水蚤的吞噬細胞消滅。他接着又觀察哺乳動物的白血球,發現吞噬細胞通過一種其所稱為吞噬作用(phagocytosis)的過程吞食消滅掉炭疽桿菌(Bacillus anthracis,一種細菌)[18]。梅契尼可夫隨後提出,吞噬細胞為機體針對入侵生物的防禦體系的重要組成部分。
1903年,阿爾姆羅思·賴特發現吞噬作用能夠通過特殊的抗體來強化,他稱這種抗體為調理素(英語「Opsonin」來自希臘語「opson」,意即調味品)[19]。梅契尼可夫因為他對吞噬細胞和吞噬作用的研究在1908年和保羅·埃爾利希共享了諾貝爾生理醫學獎[7]。
儘管人們在20世紀早期逐漸意識到這些發現的重要性,但吞噬細胞與免疫系統其他組成部分之間錯綜複雜的關係直到1980年代才得到闡明[20]。

吞噬作用(Phagocytosis)是指細胞吞食細菌、寄生蟲、死亡細胞、細胞殘骸、和外來碎屑的過程[21],當中涉及了一連串的分子機制[22]。吞噬作用始於異物(這裏以細菌為例)與吞噬細胞表面受體分子的結合,吞噬細胞隨後運動到細菌周圍,並將之吞食。人類的嗜中性顆粒白血球吞噬細菌平均要花9分鐘[23]。遭吞噬細胞吞入胞內的細菌會裹在吞噬小體內,並在一分鐘內與溶酶體或顆粒融合,形成吞噬溶酶體。細菌隨後會暴露在超量的殺滅性物質之中[24],並於幾分鐘後死亡[23]。樹狀細胞以及巨噬細胞的吞噬速度相對較慢,這些細胞的吞噬作用可能長達數小時。巨噬細胞是巨大且似乎「什麼都吃」的吞噬者,它們會吞噬大量的物質,並會將一些未消化的物質釋放回組織,並將未消化的碎片作為信號,從血液中徵募更多的吞噬細胞[25]。吞噬細胞相當「貪吃」,科學家還曾用鐵屑來飼餵巨噬細胞,之後再用小磁鐵將這些細胞吸出,以和其他細胞分離[26]。

吞噬細胞表面有許多種能和相關物質結合的受體[2],這些受體包括調理素受體、清道夫受體、Toll樣受體等。調理素受體能與包覆在細菌表面的免疫球蛋白G(IgG)或補體結合以增強吞噬作用;補體是一系列複雜的血漿蛋白,能破壞細胞或將它們標記為摧毀對象[27]。清道夫受體能與細菌表面的許多分子結合。Toll樣受體的名稱來自於已有充分研究,且基因編碼十分相近的果蠅鐸受體,不過Toll樣受體的專一性更強,Toll樣受體與其配體的結合能使吞噬作用增強,也能使吞噬細胞施放一系列能引發炎症反應的激素[2]。

殺滅微生物是吞噬細胞的一項重要功能[28]。吞噬細胞可在細胞內殺滅微生物(胞內殺滅),也可在細胞外殺滅微生物(胞外殺滅)。
當吞噬細胞在吞食細菌(或其他物質)時,它的耗氧量會增加。這一耗氧量的增加稱為呼吸爆發(Respiratory burst),目的是要產生能殺滅微生物的活性氧物質(ROS)[29]。ROS對侵入者和細胞本身都是有毒性的,因此,這些分子只存在細胞中特定的隔室內。這種通過ROS殺滅入侵的微生物的方法稱為氧依賴性胞內殺滅(oxygen-dependent intracellular killing),並可再細分為兩類[14]。
在第一種類型的殺滅中,氧依賴性產物是超氧化物[2],這是一種氧化力很強且具有殺菌活性的物質[30]。在超氧化物歧化酶的作用下,超氧化物轉化為過氧化氫和單線態氧。超氧化物還會和過氧化氫反應,生成羥基自由基。羥基自由基能輔助殺滅入侵的微生物[2]。
在第二種類型的殺滅中,來自嗜中性顆粒白血球顆粒的髓過氧化物酶會參與反應[31]。當顆粒與吞噬體融合為吞噬溶酶體後,髓過氧化物酶即能在其中進行反應。該酶會利用過氧化氫以及氯產生對細菌毒性很強的次氯酸鹽,次氯酸鹽在生活中也可用於漂白劑的製作[2]。髓過氧化物酶包含色素血紅素,因此嗜中性顆粒白血球的許多分泌物(如膿和感染痰液)會呈現綠色[32]。

吞噬細胞也可以通過非氧依賴性的方法(oxygen-independent methods)殺死微生物,不過這類方法不如氧依賴性的方法有效。非氧依賴性胞內殺滅方法有四種主要的類型:第一種使用帶電蛋白破壞細菌的質膜;第二種使用溶酶體,溶酶體中的酶能夠破壞細菌的細胞壁;第三種使用乳鐵蛋白,乳鐵蛋白存在於嗜中性顆粒白血球的顆粒中,它能從細菌胞內移除其生存必須的鐵元素[33];第四種使用蛋白酶和水解酶,它們能消化細菌殘骸的蛋白質[34]。
干擾素-γ(舊稱巨噬細胞活化因子)能夠誘導巨噬細胞產生並釋放一氧化氮以殺滅周圍的微生物[2],CD4+ T細胞、CD8+ T細胞、自然殺傷細胞(NK細胞)、B細胞、自然殺手T細胞(NKT細胞)、單核細胞、巨噬細胞、和樹狀細胞都能產生干擾素-γ[35]。另外,活化的巨噬細胞能產生並分泌腫瘤壞死因子(TNF)作為信號分子[36],它們能夠殺死癌細胞和病毒感染過的細胞,也能輔助活化其他免疫細胞[37]。
在慢性肉芽腫病等疾病中,由於患者氧依賴性殺滅途徑受到異常干擾,吞噬細胞的效率降低,細菌反覆性感染成為困擾患者的難題[38]。另外一些罕見的先天性疾病,如白細胞異常色素減退綜合症(Chediak-Higashi syndrome),也和宿主殺死入侵的微生物的能力低下有關[39]。
病毒只能在細胞內複製,它們藉由宿主細胞表面的特定受體進入胞內。進入細胞後,病毒會控制宿主細胞的合成系統,產生數百份自身複製所需的物質。儘管吞噬細胞和其它先天免疫系統的成員能在一定程度上抑制病毒的擴散,但在病毒進入細胞後,適應性免疫(特別是淋巴細胞)才是防禦的主力 [40]。在病毒感染的區域,淋巴細胞的數目常常遠超過其它免疫細胞,這一現象在病毒性腦膜炎中很常見[41]。淋巴細胞殺死受病毒感染的細胞後,吞噬細胞會將其殘骸清除[42]。

動物體內的細胞會不斷地死亡,細胞分裂和細胞死亡維持着成年個體細胞數目的穩定[12]。細胞有兩種主要的死亡方式:壞死(necrosis)和凋亡(apoptosis)。細胞凋亡又稱為「細胞程式性死亡」,是一個健康細胞正常功能的一部分;細胞壞死則通常由疾病或外傷造成。人體每天都必須要清理數十萬已死亡或正在走向死亡的細胞,吞噬細胞在這個處理過程中扮演了重要角色[43]。
細胞凋亡末期的細胞[44]表面會出現磷脂絲氨酸等分子,這些表面分子能藉由吞噬細胞辨識[45]。磷脂酰絲氨酸在正常情況下僅存在於質膜靠細胞質一側的表面上,但在細胞凋亡時,磷脂酰絲氨酸會由「磷脂促翻轉酶」(scramblase)移到到質膜的外側(磷脂促翻轉酶目前還未發現,只是一種假說中的蛋白)[46]。細胞表面的磷脂酰絲氨酸為該細胞進行了標記,使巨噬細胞上相應的受體能夠加以辨識,並將該細胞吞噬[47]。通過吞噬細胞清理凋亡細胞的過程經過妥善安排,不會引發炎症反應,這也是吞噬細胞的一項重要功能[48]。
吞噬細胞通常不會固着在特定的器官,而會在體內各處遊走,並與其他組成免疫系統的吞噬細胞和非吞噬細胞發生相互作用。吞噬細胞通過「細胞因子」(或稱細胞激素)與其他細胞進行資訊交流,細胞因子能招募其他的吞噬細胞到感染區域,也可以刺激未活化的淋巴細胞[49]。吞噬細胞是動物(包括人類)先天免疫系統的一部分,先天免疫的效率很高,但卻專一性卻不高,即先天免疫無法精確針對入侵物質的種類而回以特殊的反應。另外一方面,有頜脊椎動物的後天免疫系統則具有高度的專一性,能夠區分幾乎所有種類的入侵物質[50]。相較於先天免疫系統以吞噬細胞為基礎,後天免疫系統奠基於淋巴細胞。淋巴細胞能夠分泌「抗體」(一種保護性蛋白質)來標記入侵物質,以便進行後續的清除程式。另外,抗體還能和病原體結合,使其喪失感染細胞的能力[51]。吞噬細胞,尤其是樹狀細胞以及巨噬細胞,能夠通過抗原呈遞(antigen presentation)的進程刺激吞噬細胞產生抗體[52]。

抗原呈遞是吞噬細胞將吞噬物質的一部分搬運到細胞表面,並將它們呈遞給其他免疫細胞的過程[53]。「專職的」的抗原呈遞細胞共有兩種:巨噬細胞和樹狀細胞[54]。在吞噬異物後,外來蛋白(即抗原)會在巨噬細胞或樹狀細胞胞內水解為多肽片段。隨後,這些多肽會與細胞的主要組織相容性複合體(MHC,為醣蛋白)結合,攜帶着多肽的MHC會轉運至吞噬細胞的表面,並將多肽「呈遞」給淋巴細胞[15]。成熟的巨噬細胞並不會離開感染區域太遠,不過樹狀細胞能移動到含有數百萬淋巴細胞的淋巴結處[55]。這一過程中,樹狀細胞將多肽呈現給淋巴細胞,使淋巴細胞對多肽產生專一性的抗體(這種反應和淋巴細胞直接在感染區域接觸抗原後產生的應答是等效的),增加免疫反應的強度[56]。除此以外,樹狀細胞還可以殺滅或抑制對自體組織有反應的淋巴細胞——這對阻止自體免疫反應的發生至關重要,此一過程稱為「(免疫)耐受」[57]。
樹狀細胞對免疫耐受的產生十分重要[58],免疫耐受性使得免疫系統不會攻擊自身的組織。第一類免疫耐受為發生於胸腺中的中樞耐受(central tolerance),主要的機制是讓與自身抗原(由胸腺中的上皮網狀細胞呈遞)結合得過於緊密的T細胞死亡。第二類免疫耐受是外周耐受(peripheral tolerance),因為許多可能的原因(其中一種主要原因是胸腺中自身抗原表達的缺乏),對自身組織有反應的T細胞會逃離胸腺,這時候調節性T細胞就可以降低這些T細胞的活性[59]。一旦免疫耐受失效,個體就可能患上自體免疫疾病[60]。

人類以及其他有頜類脊椎動物的吞噬細胞都能夠依照其吞噬作用的效率分為專職及非專職兩種[9]。專職吞噬細胞包括單核白血球、巨噬細胞、嗜中性顆粒白血球、組織樹狀細胞、和肥大細胞[10]。一公升人類血液含有約60億個吞噬細胞[5]。
所有的吞噬細胞,尤其是巨噬細胞,在一定程度上都已經準備好要活化。巨噬細胞在組織中通常較不活躍,增殖速度很慢;在此種休止狀態中,巨噬細胞能清除死亡的個體細胞和其他非感染性碎片,但幾乎不參與抗原呈遞。但當感染發生後,巨噬細胞會受到化學信號(通常是干擾素-γ)的刺激而生產更多的MHCII分子,做好參與抗原呈遞的準備;在此種活化的狀態下,巨噬細胞是一個優秀的抗原呈遞者兼殺手。然而,此時巨噬細胞若直接接觸到入侵者,它們就會進入「超活化態」(hyperactivated),即停止增殖,並專注於殺滅;此時巨噬細胞的大小和吞噬速率都會增加,有時甚至可以長大到足以吞食原生生物[61]。
在血液中,嗜中性顆粒白血球雖然處於非活化態,但卻以很快的速度循環。在收到發炎處巨噬細胞的信號後,它們會減慢速度、離開血液、進入組織中,並由細胞因子活化,抵達戰場的第一線進行殺滅[62]。

感染發生後,吞噬細胞會在感染處的求救化學信號(稱為趨化因子)誘導之下前往該處[63],這些化學信號可能是入侵細菌的蛋白質、凝血系統的多肽、補體產物、或感染處巨噬細胞所釋出的細胞因子[2];另外,也有一些趨化因子是用於徵募嗜中性顆粒白血球以及單核白血球的[13]。
為了抵達感染區域,吞噬細胞必須穿過血管才能進入受影響的組織中。感染傳出的信號使血管內皮細胞產生選凝素(一種細胞表面的粘連蛋白),嗜中性顆粒白血球表面的選擇素配體會與內皮上的選擇素結合,這使得嗜中性顆粒白血球能在發炎處停下,並接着穿越內皮、進入組織。另外一些化學信號能誘導血管擴張,使血管內皮細胞之間的連接變得較鬆散,以便吞噬細胞穿過管壁。趨化作用指吞噬細胞受到細胞因子的吸引而移動到感染區域的過程[2]。 嗜中性顆粒白血球穿過上皮細胞所包覆的器官以到達感染區域,儘管這是對抗感染重要的一步,但遷移的過程本身也可能會導致類似疾病的症狀[64]。在感染過程中,數百萬的嗜中性顆粒白血球會從血液中投身至感染處,不過它們都會在數日後死亡[65]。
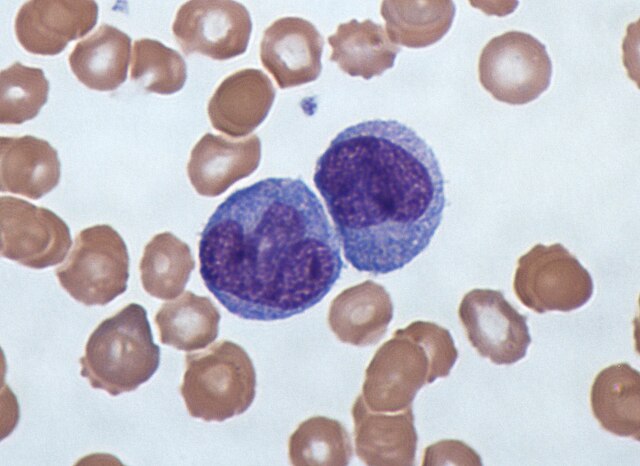
單核細胞於骨髓中發育,在血液中成熟。成熟的單核白血球體積大、表面光滑、有分葉的核(常呈腎形),且細胞質擁有大量顆粒。單核白血球能攝取外源或具危險性的物質,並將抗原呈遞給其他免疫細胞。單核白血球可分為兩種群體:循環群體(約30%)以及滯留在特定組織中的邊緣群體(約70%)。大部分的單核白血球會在20至40小時後離開血液,進入組織和器官之中,依照收到的信號[66]分化為巨噬細胞[67]或樹狀細胞。一升人類血液中約有5億個單核白血球[5]。

成熟的巨噬細胞不會作遠距移動,而會在特定幾個身體與外界接觸的區域巡邏。在這些區域中,依收到的信號不同,他們可能會扮演清道夫、抗原呈遞者、或是殺手的角色[68]。巨噬細胞分化自單核白血球、顆粒白血球幹細胞、或來現存巨噬細胞的分裂。巨噬細胞具有分裂能力,能通過分裂產生更多巨噬細胞[69]。人類巨噬細胞的直徑大約是21微米[70]。
巨噬細胞胞內沒有顆粒,但有很多的溶酶體。人體幾乎所有的組織和器官中都有巨噬細胞(比如大腦中的微膠細胞、肺中的肺泡巨噬細胞),不過平時他們都處於休止的狀態。巨噬細胞所處的位置可決定其大小和形狀。它們可以產生白血球介素1族(IL-1)、白血球介素6(IL-6)、腫瘤壞死因子-α(TNF-α)來引起發炎反應[71]。巨噬細胞大都分佈在組織中,血液中幾乎找不到它們的蹤跡。組織中巨噬細胞的壽命從4天到15天不等[72]。
巨噬細胞在活化後,可擁有一些休止的單核細胞沒有的功能[71]。輔助T細胞(Th細胞)通過細胞因子干擾素-γ或表面蛋白CD40配體來活化巨噬細胞[73];此外,TNF-α以及細菌的脂多糖同樣也能作為活化的信號[71]。第一型輔助T細胞(Th1)能夠通過多種方法徵募吞噬細胞到感染區域:它們可以分泌某些細胞因子到骨髓中刺激單核白血球和嗜中性顆粒白血球產生,也能分泌另一些細胞因子促使單核白血球和嗜中性顆粒白血球離開血液[74]。Th1細胞分化自在二級淋巴組織中受到抗原刺激的CD4+T細胞[71]。活化的巨噬細胞也能通過產生TNF-α、干擾素-γ、一氧化氮、活性氧化合物、陽離子蛋白、水解酶等物質來殺滅腫瘤[71]。

嗜中性顆粒白血球長期存在於人類的血液中,是數量最多的吞噬細胞,佔血液中白血球數目的50%到60%[75]。一升的人類血液大約含有50億個嗜中性顆粒白血球[5]。嗜中性顆粒白血球的直徑約10微米[76],壽命約5天[37]。它們在收到恰當信號後,需要花約30分鐘離開血液前往感染區域[77]。它們能迅速吞食與抗體或補體結合的入侵物質、受損的細胞、和細胞碎片。隨後,嗜中性顆粒白血球不會回到血液中,它們會在轉化為膿細胞後死亡[77]。成熟的嗜中性顆粒白血球體積較單核白血球小,核多葉(通常為2到5葉),不同葉之間由染色體纖絲連結。嗜中性顆粒白血球通常在成熟後才會離開骨髓,不過在感染發生時,嗜中性顆粒白血球的前趨細胞幼顆粒白血球以及早幼顆粒白血球亦會自骨髓中釋出[78]。
研究者很早就發現人類嗜中性顆粒白血球內的顆粒有摧毀蛋白質以及殺滅細菌的作用[79]。嗜中性顆粒白血球分泌的物質能刺激單核白血球以及巨噬細胞,增強吞噬作用以及活性氧物質的產生[80]。由嗜中性顆粒白血球初級顆粒分泌出的物質能刺激吞噬細胞吞食抗體內包覆的細菌[81]。
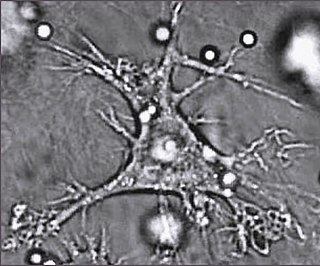
樹狀細胞是特化的抗原呈遞細胞。這類細胞表面有大量的樹突狀突出[82],這些突出可以幫助它們吞食細菌等入侵物質[83][84]。樹狀細胞在皮膚、鼻子內側、肺、胃,以及腸等與外界接觸的組織中都有分佈[85]。在活化後,樹狀細胞會並移動到淋巴細胞中與T細胞和B細胞發生作用,協助啟動適應性免疫反應[86]。成熟的樹狀細胞能活化輔助型T細胞以及細胞毒性T細胞[87],活化的輔助型T細胞則能活化巨噬細胞和B細胞。另外,樹狀細胞也會影響後續產生的免疫反應類型:當它們移動到富含T細胞的淋巴組織時,就能活化T細胞,使它們分化為細胞毒性T細胞或輔助型T細胞[83]。
肥大細胞擁有Toll樣受體,能與樹狀細胞、B細胞、和T細胞相互作用,幫助介導適應性免疫反應[88]。肥大細胞能生產MHCII分子,並參與抗原呈遞,但其在抗原呈遞中扮演的角色目前並未得到充分研究[89]。肥大細胞可以吞食並殺滅革蘭氏陰性菌(比如沙門氏菌),並在處理其抗原後將之呈遞給T細胞[90]。肥大細胞對細菌表面菌毛蛋白的處理特別在行,菌毛使細菌能黏附在生物體組織上[91][92]。除了這些作用外,肥大細胞還可以產生細胞因子誘導炎症反應[93],炎症反應可吸引更多的免疫細胞到感染發生的區域,因此對身體防禦相當重要[90]。
走向死亡的細胞以及侵入體內的外來生物也能由「專職」吞噬細胞以外的細胞吞食[95],這些細胞包括上皮細胞、內皮細胞、纖維母細胞,以及間質幹細胞。將它們稱為非專職吞噬細胞(non-professional phagocytes)是為了強調其與專職吞噬細胞的不同,吞噬不是它們最主要的功能[96]。舉例來說,纖維母細胞在疤痕的重塑過程中會吞噬膠原蛋白,同時也會嘗試消化外來顆粒[97]。
非專職吞噬細胞能吞噬的顆粒種類比專職吞噬細胞少,這是因為它們缺乏高效的吞噬受體──特別是調理素受體。調理素是指由免疫系統產生而能協助吞噬的物質,它們通常是能與入侵物質結合的抗體或補體[11]。另外,大多數的非專職吞噬細胞都不能產生用以殺滅的活性氧物質[98]。

漿細胞(Plasma cell),亦稱為效應B細胞(effector B cell),是免疫系統中釋放大量抗體的細胞。直徑10-20μm,細胞核較小,占細胞的一半以下,多偏於一側,偶爾可有雙核。漿細胞的染色質粗密、 聚集成堆、常呈紫丁香色、不均勻,在近核處一邊常伸出半月狀淡染區;漿中偶見有空泡或有泡沫感。
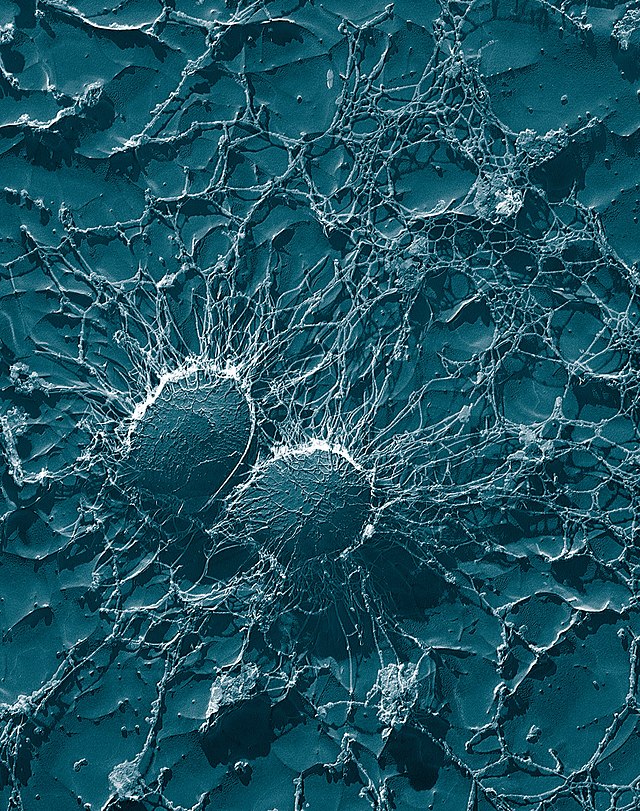
病原體必須迴避生物體的防禦才能成功入侵。致病性微生物(包括致病菌以及具有致病能力的原生動物)有一系列抵禦吞噬細胞攻擊的方法,許多致病性微生物通過這些方式存活下來,或甚至在吞噬細胞內進行複製[99][100]。
細菌利用多種方式避免與吞噬細胞接觸。有些細菌可以在吞噬細胞無法到達的地方生長(比如完整的皮膚表面);有些則能抑制炎症反應,缺乏發炎反應將使吞噬細胞無法產生足夠強度的回應;有些細菌則能以化學毒素干擾吞噬細胞,使其無法到達感染區域[99];最後,一些細菌可以誤導免疫系統,將自己偽裝成宿主自體的一部分而躲過攻擊,例如梅毒螺旋體(Treponema pallidum)的表面有纖連蛋白[101],而纖連蛋白是傷口癒合的過程中具有重要功能的人體蛋白[102]。
細菌通常會在其表面產生一層蛋白質或糖類所構成的莢膜包覆自身,以干擾吞噬作用的進行[99]。大腸桿菌(E.coil)表面的K5莢膜和O-抗原[103]、表皮葡萄球菌(Staphylococcus epidermidis)的外多糖莢膜等都是很好的例子[104]。肺炎鏈球菌(Streptococcus pneumoniae)能產生數種不同的莢膜,它們能提供不同程度的保護[105]。A群鏈球菌則能產生M蛋白以及菌毛蛋白來對抗吞噬作用。一些細菌能阻止與調理素介導的吞噬作用,如金黃色葡萄球菌(S.aureus)產生的蛋白A可以阻止抗體受體和抗體結合,減弱調理素的作用[106]。
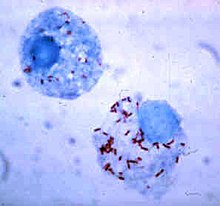
細菌發展出了各式各樣的方法使它們能在吞噬細胞胞內存活,躲在其中迴避免疫系統的攻擊[107]。為了能安全地待在吞噬細胞內,細菌會表達一種名為「侵染素」(invasin)的蛋白,並設法留在細胞質中,以避免吞噬溶酶體內的有毒化學物質攻擊[108]。一些細菌能阻止溶酶體和吞噬體融合,使吞噬溶酶體無法生成[99]。利什曼原蟲(Leishmania)等病原體可以在吞噬細胞胞內形成高度特化的液泡,幫助它們在吞噬細胞內生存與繁殖[109]。一些細菌可以在吞噬溶酶體內存活,如金黃色葡萄球菌可以產生過氧化氫酶和超氧化物歧化酶來分解吞噬細胞所產生的殺菌物質(如過氧化氫)[110]。細菌也可能在吞噬溶酶體生成前從吞噬體中逃亡,如李斯特菌(Listeria monocytogenes)可以用李斯特菌溶血素O(listeriolysin O)和磷脂酶C在吞噬體的膜上打洞[111]。
細菌已經發展出一些途徑來殺死吞噬細胞[106]。溶細胞素能造成吞噬細胞膜上產生孔洞;鏈球菌溶血素(streptolysin)以及殺白血球素(leukocidin)則能使嗜中性顆粒白血球細胞質中的顆粒破裂,其內的有毒物質於是釋放到胞質當中[112][113];外毒素亦能殺死吞噬細胞,這種分子能使吞噬作用必須的ATP供應短缺。細菌在吞噬細胞吞食後就能釋放上述毒素,毒素會穿過吞噬體或吞噬溶酶體的膜到達目標作用部位,進而殺死吞噬細胞[99]。
入侵者常用的生存策略還包括干擾細胞因子或其他細胞信號傳送途徑,以阻斷吞噬細胞對入侵的回應[114]。原生生物寄生蟲如弓形蟲(Toxoplasma gondii)、克氏錐蟲(Trypanosoma cruzi)、和利什曼原蟲(Leishmania)能夠感染巨噬細胞,並通過各自獨特的方法「馴服」巨噬細胞[114]。舉例來說,某些種類的利什曼原蟲可以改變巨噬細胞的信號傳送,抑制細胞因子和殺菌物質(一氧化氮和活性含氧物質等)的產生,並阻遏巨噬細胞進行抗原呈遞[115]。
巨噬細胞以及嗜中性顆粒白血球能施放蛋白質和小分子發炎介質(inflammatory mediators),在發炎過程中發揮着至關重要的作用。這些分子能控制感染,但不會造成自體組織的損傷。吞噬細胞消滅病原體的方式是將它們吞食後送入含有多種毒性化學物質的吞噬溶酶體中;如果一個吞噬細胞未能將其目標吞食,上述的毒物就可能釋放到壞境中(這一過程稱為「吞噬受挫」(frustrated phagocytosis))。因為這些物質對自體細胞也是有毒的,它們可能會對健康的細胞和組織造成嚴重損傷[116]。
如果嗜中性顆粒白血球將它們的顆粒在腎臟中釋放,顆粒中的物質(活性氧化合物、蛋白水解酶)會降解細胞外基質,並對腎小球細胞產生損傷,不僅會使這類細胞的形態發生改變,還會使它們濾血的功能受損;此外,磷脂酶的酶解產物(比如白三烯)也會加劇損傷。這類物質的釋放會通過趨化作用促進更多的嗜中性顆粒白血球到達感染區域。腎小球細胞在嗜中性顆粒白血球遷移過程中,也會受到黏附分子的進一步損傷。腎小球細胞的損傷可能造成腎功能衰竭[117]。
嗜中性顆粒白血球在多數類型的急性呼吸窘迫綜合症中也扮演着關鍵角色[118],活化的嗜中性顆粒白血球會將含有毒性物質的顆粒釋放入肺部[119]。實驗表明嗜中性顆粒白血球數量的減少能減緩急性呼吸窘迫綜合症的症狀[120],但抑制嗜中性顆粒白血球的療法在臨床上卻並不現實,因為這樣做會使患者無力抵抗伺機性感染[119]。在肝臟中,細菌所釋放的內毒素、敗血症、創傷、酒精性肝炎、缺血、和大出血造成的低血容量性休克都會使嗜中性顆粒白血球對上述情形做出反應,而造成肝損傷或功能缺失[121]。
巨噬細胞釋放的化學物質亦可能造成自身組織的損傷。腫瘤壞死因子-α(TNF-α)是一種由巨噬細胞釋放的細胞激素,它可使小血管中的血液凝固,阻止感染的擴散[122]。然而,如果細菌感染已經擴散到血液中,TNF-α就會通過血液流入重要的器官,這會導致血管擴張和血漿體積減少,誘發感染性休克。感染性休克發生後,TNF-α的釋放會使為重要器官供血的小血管堵塞,造成器官停止工作,並可能導致死亡[13]。
吞噬作用在各種生物中十分常見,可能在演化早期就已經出現[123]。吞噬細胞一開始可能是類似變形蟲的單細胞真核生物[124],變形蟲是一類單細胞原生生物,相較於植物,動物和它們的親緣關係更為接近。變形蟲與吞噬細胞有許多共通的功能特色[124],比如盤基網柄菌(Dictyostelium discoideum)是一種生活在土壤和草料中的變形蟲,它們以細菌為食,主要藉由Toll樣受體吞噬細菌,並還有許多與吞噬細胞相同的功能[125]。盤基網柄菌的群落具有社會性,飢餓時它們會聚集在一起,生成一團蛞蝓狀的假合胞,這個多細胞群體最後會形成有孢子的子實體來對抗危險環境。在子實體生成前,細胞會以蛞蝓狀假合胞的型態遷移數天,這期間接觸到的致病細菌或毒素可能會阻礙孢子產生,使物種生存受到威脅。不過,一些在假合胞中循環的變形蟲細胞會吞噬有害的細菌或吸收毒素,並在完成上述過程後死亡;這些細胞和假合胞中的其它變形蟲細胞在遺傳上完全相同。它們以自我犧牲的方式保護其它變形蟲細胞不受細菌侵害,這和脊椎動物免疫系統中吞噬細胞的自我犧牲行為相似,有理論因此推測變形蟲的吞噬作用可能與動物界的吞噬細胞的作用同源[126]。然而,哺乳動物吞噬細胞和變形蟲的同源關係還未經證實。吞噬細胞存在於幾乎所有動物界成員[3],不論是海綿動物、節肢動物、高等或低等的脊椎動物體內都有吞噬細胞[127][128]。變形蟲區別自我和非我的能力非常重要,是許多變形蟲免疫系統的根基[8]。
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.