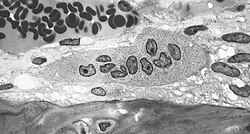
破骨細胞
来自维基百科,自由的百科全书
破骨細胞(英語:osteoclast)又稱蝕骨細胞[1],是一種存在於骨組織中的細胞,由多個單核細胞融合而成,直徑最大可達100微米,細胞核的數目一般是6-50個[2][3]。破骨細胞由核因子B配體激活受體(RANKL),以及巨噬細胞集落刺激因子(M-CSF)刺激分化產生。它的主要功能是通過釋放乳酸、檸檬酸、碳酸、碳酸酐酶及溶酶體酶等,對骨組織進行分解破壞[2],是體內唯一具有骨吸收活性的細胞[4][5][6]。
破骨細胞於1873年由德國的阿爾伯特·馮·科立克最早發現[7]。英語 osteoclast 中,osteo- 來自古希臘語 ὀστέον(osteon),意爲骨;-clast 來自古希臘語 κλαστός(clastos),意爲破壞。
結構


破骨細胞是起源於骨髓單核細胞的多核巨細胞。破骨前體細胞在趨化因子的作用下進入血循環[11],到達處於吸收狀態的骨組織部位,在M-CSF和RANKL的作用下分化成破骨細胞[12]。人類破骨細胞通常具有五個緊密堆積的細胞核,直徑為150-200µm。當使用趨化因子將巨噬細胞轉化為破骨細胞時,可能會出現直徑達到100µm的極大細胞,具有數十個細胞核,並且通常會表達主要的破骨細胞蛋白。由於不是天然的底物,因此與活骨中的細胞有顯著差異[13][14]。多細胞核破骨細胞的大小使其能夠將許多巨噬細胞的離子轉運,同時蛋白質分泌和囊泡轉運能力集中在骨頭的局部區域。
骨吸收原理
有研究發現,骨吸收能力是由破骨細胞數量及單個細胞降解骨基質的能力所決定[15]。在骨吸收過程中,破骨細胞會與骨基質接觸,通過整合素αVβ3等分子的作用,使破骨細胞自身與骨表面之間形成一個獨立的微環境。在破骨細胞內的溶酶體酶的作用下,經皺摺緣排泌酸性物質,從而在破骨細胞和骨基質之間形成一個局部酸性微環境。酸性環境使骨中的礦物質溶解,暴露出其有機質部分,隨後被組織蛋白酶K、抗酒石酸酸性磷酸酶 (TRACP) 及基質金屬蛋白酶-9 (MMP-9) 等酶降解。抗酒石酸酸性磷酸酶主要存在於與破骨細胞膜相聯繫的微粒體內,參與骨基質中鈣磷礦化底物的降解,可間接反映破骨細胞的活性及骨吸收的速率[16]。這些溶解的產物,如鈣離子、彈性蛋白及蛋白多糖等均從細胞膜的皺摺緣被吸收,然後進入到破骨細胞的轉移小泡進行下一步處理,最終通過胞吐作用被轉移出破骨細胞[17]。
抑制
目前發現無細胞毒性的IgG2單克隆抗體地舒單抗(denosumab)[18]能夠與RANK競爭性結合人類RANKL蛋白上的DE環結構。一方面活化了核因子活化B細胞κ輕鏈增強子 (NF-κB),後者進入細胞核影響相關基因的表達,對破骨細胞的活化、分化、增殖及多核化和生存起關鍵作用。另一方面,則抑制RANKL與破骨細胞及其前體表面的RANK結合,有效阻斷配體與受體間的作用關係,從而抑制活化破骨細胞的形成、功能和存活,降低破骨細胞活性、抑制破骨細胞分化,進而阻礙腫瘤生長[19]。
參考資料
Wikiwand - on
Seamless Wikipedia browsing. On steroids.