Loading AI tools
有機化合物 来自维基百科,自由的百科全书
此条目需要补充更多来源。 (2014年4月24日) |
| 苯 | |||
|---|---|---|---|
| |||
| |||
| |||
| IUPAC名 Benzene[1] | |||
| 别名 | 囷、焑、㷍、菕、轮质 1,3,5-环己三烯(理论共振异构体) [6]轮烯(不推荐[1]) | ||
| 识别 | |||
| CAS号 | 71-43-2 | ||
| PubChem | 241 | ||
| ChemSpider | 236 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | UHOVQNZJYSORNB-UHFFFAOYAH | ||
| ChEBI | 16716 | ||
| RTECS | CY1400000 | ||
| 性质 | |||
| 化学式 | C6H6 | ||
| 摩尔质量 | 78.11 g·mol−1 | ||
| 外观 | 无色透明易挥发液体 | ||
| 密度 | 0.8765(20) g/cm³[2] | ||
| 熔点 | 5.5 °C(279 K) | ||
| 沸点 | 78.3 °C(351 K) | ||
| 溶解性(水) | 1.8 g/L(15 ℃)[3][4][5] | ||
| 黏度 | 0.652 cP,20℃时 | ||
| 偶极矩 | 0 D | ||
| 热力学 | |||
| S⦵298K | 173.26 J/mol·K | ||
| 热容 | 135.69 J/mol·K(298.15 K) | ||
| 危险性 | |||
| 警示术语 | R:R45-R46-R11-R36/38-R48/23/24/25-R65 | ||
| 安全术语 | S:S53-S45 | ||
| 欧盟分类 | 可燃(F) Carc. Cat. 1 Muta. Cat. 2 有毒(T) | ||
| NFPA 704 | |||
| 闪点 | −10.11℃(闭杯) | ||
| 自燃温度 | 562.22℃ | ||
| 相关物质 | |||
| 相关化学品 | 甲苯 环硼氮烷 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
苯是最简单的芳香烃,难溶于水,易溶于有机溶剂,本身也可作有机溶剂。苯是石油化工基本原料,其产量和生产的技术水平是国家石油化工发展水平的标志。苯的环系叫苯环,是最简单的芳香环。苯分子去掉一粒氢后的结构叫苯基,用Ph表示;因此苯也可表示为PhH。
苯最早在18世纪初研究将煤气作为照明用气时合成出来。一般认为苯是由麦可·法拉第在1825年发现。他从鱼油等类似物质的热裂解产品中分离出了纯度甚高的苯,称之为“氢的重碳化物”(Bicarburet of hydrogen)。[7]并且测定了苯的一些物理性质和其化学组成,阐述了苯分子的碳氢比。[8]
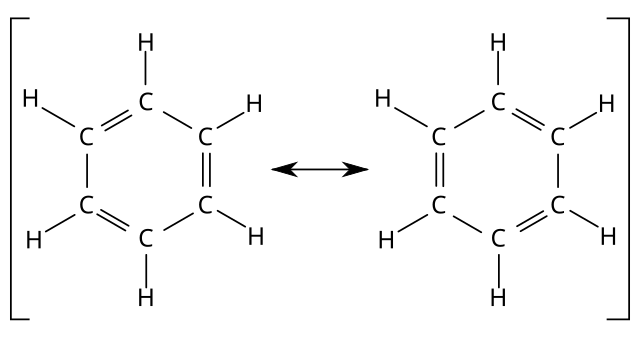
1833年,米修里希·伊尔哈得确定了苯分子中6碳和6氢原子的经验式(C6H6)。[9]1865年,弗里德里希·凯库勒提出了苯环单、双键交替排列、无限共轭的结构(⌬),即现在所谓“凯库勒式”,据称他梦到一条蛇咬住了自己的尾巴才受到启发想出。[10]他解释称环中双键位置不固定,可迅速移动,所以6粒碳等价。他通过对苯的一氯代物、二氯代物种类的研究,发现苯是环形结构,每粒碳连接一粒氢。也有说法指出,把苯分子结构画成六角形环状最早是法国化学家奥古斯特·劳伦1854年在《化学方法》一书中提出。但是出于某种原因[需要解释],凯库勒在论文没有提及劳伦的成果。[10]
也有人提出了其他设想:比如詹姆斯·杜瓦就归纳出不同结构,以其命名的杜瓦苯现已证实是与苯不同的另一种物质,可由苯经光照得到。

1845年德国化学家霍夫曼从煤焦油的轻馏分中发现了苯,其学生查尔斯·曼斯菲尔德(Charles Mansfield)随后加工提纯了苯。后来他又发明了结晶法精制苯。他还研究工业用途,开创了苯的加工利用途径。大约从1865年起开始工业生产。最初是从煤焦油中回收。随着它用途增多,产量不断上升,到1930年已经成为世界十大吨位产品之一。
苯的苯环结构给它特殊的芳香性。苯环是最简单的芳环,由六粒碳原子构成六元环,每粒碳原子接一组基团,苯的6组基团都是氢原子。

苯不是单、双键交替排列的轮烯,原子间成键并不是不连续的单双键交替,而是给离域π电子云覆盖。
苯分子是平面分子,12粒原子处于同一平面,6粒碳和6粒氢均等,碳-氢键长1.08Å,碳-碳键长1.40Å,此数值介于单双键长之间。分子所有键角均为120°,说明碳原子都采取sp2杂化。这样每粒碳原子还剩余一条p轨道垂直于分子平面,每条轨道有一粒电子。于是6条轨道重叠形成离域大Π键(即π66),有下图所示的共振式,现在认为这是苯环非常稳定的原因,也直接使苯环有芳香性。
从分子轨道理论来看,可以认为苯的6条p轨道相互作用形成6条π分子轨道,其中ψ1、ψ2、ψ3是能量较低的成键轨道,ψ4、ψ5、ψ6是能量较高的反键轨道。ψ2、ψ3和ψ4、ψ5是两对简并轨道。基态时苯的电子云分布是三个成键轨道叠加的结果,故电子云均匀分布于苯环上下及环原子上,形成闭合的电子云。它是苯分子在磁场中产生环电流的根源。
苯的沸点80.1℃,熔点5.5℃,在常温无色,透明,有芳香气味,易挥发。苯比水密度低,密度为每毫升0.88克,但其分子质量比水高。苯难溶于水,1升水最多溶解1.8克苯;但苯是良好的有机溶剂,溶解有机分子和一些非极性无机分子的能力很强。
苯能与水恒沸,沸点69.25℃,含苯91.2%,在有水生成的反应中常加苯蒸馏,以将水馏出。
P单位为mmHg,t单位为℃,A=6.91210,B=1214.645,C=221.205。
卤素、硝基、磺酸基、烃基等可在一定条件下取代苯环的氢原子,生成相应衍生物。取代基不同以及氢原子位置、数量不同,可以生成不同数量和结构的同分异构体。
苯环电子云密度甚大,在苯环的取代反应大都是亲电取代反应。亲电取代反应是芳环的代表反应。苯的取代物在亲电取代时,第二取代基的位置与原先取代基的种类有关。
苯的卤代反应通式可以写成:
反应中,卤素分子在苯和催化剂共同作用下异裂,X+进攻苯环,X-与催化剂结合。以溴为例:反应要加入铁粉,铁与溴作用先生成三溴化铁。
反应机理为:
磺化是可逆反应,苯磺酸加热与稀硫酸或盐酸反应,可失去磺基,生成苯。合成时可以先磺化以保护芳核的某位置。
苯环引入磺酸基后反应能力下降,不易继续磺化,需要更高温才能引入第二、第三组磺酸基。这说明硝基、磺酸基都是钝化基团,即妨碍再次亲电取代的基团。
三氯化铝催化,苯和醇、烯烃和卤代烃反应,烷基取代苯环的氢原子生成烷基苯。这反应称为(傅-克)烷基化反应。[11]例如与乙烯烷基化生成乙苯:
反应过程中,烃基可能会重排:如1-氯丙烷与苯反应生成异丙苯,自由基总是趋向稳定的构型。
臭氧在特定情况也可氧化苯,生成乙二醛。这反应可以看作是苯的离域电子定域后生成的环状多烯烃发生的臭氧化反应。
但在一般条件下,强氧化剂不能氧化苯。但是在氧化钼、五氧化二钒等催化剂存在下,与空气中的氧在500℃反应,苯可选择性氧化成顺丁烯二酸酐。这是屈指可数的几种能破坏苯的六元碳环系的反应之一。(马来酸酐是五元杂环。)
这是强放热反应。
苯在高温下,用铁、铜、镍做催化剂,可以发生缩合反应生成联苯。[12]和甲醛及次氯酸在氯化锌存在下可生成氯甲基苯。和乙基钠等烷基金属化物反应可生成苯基金属化物。在四氢呋喃中氯苯或溴苯和镁反应可生成苯基格林尼亚试剂。
邻、对位定位基亦称为o(ortho)、p(para)定位基,可使新的取代基主要进入邻、对位(o+p>60%),除了卤素以外都可活化苯环,有利亲电取代反应。[13]
苯可以由含碳量高的物质不完全燃烧获得。自然界中,火山爆发和森林火灾都能生成苯。香烟的烟也有苯。
直至二战,苯还是一种钢铁工业焦化过程中的副产物。这种方法只能从1吨煤中提取出1千克苯。1950年代后,随着工业,尤其是日益发展的塑料工业对苯的需求增多,由石油生产苯的过程应运而生。现在全球大部分的苯来源于石油化工。工业上生产苯最重要的三种过程是催化重整、甲苯加氢脱烷基化和蒸汽裂化。
在煤炼焦过程中生成的轻焦油含有大量的苯。这是最初生产苯的方法。将生成的煤焦油和煤气一起通过洗涤和吸收设备,用高沸点的煤焦油作为洗涤和吸收剂回收煤气中的煤焦油,蒸馏后得到粗苯和其他高沸点馏分。粗苯经过精制可得到工业级苯。这种方法得到的苯纯度比较低,而且环境污染严重,工艺比较落后。
原油中含有少量的苯,从石油产品中提取苯是最广泛使用的制备方法。
重整这里指使脂肪烃成环、脱氢形成芳香烃的过程。这是从第二次世界大战期间发展形成的工艺。
在500至525 ℃、8至50大气压下,各种沸点在60至200℃之间的脂肪烃,经铂-铼催化剂,通过脱氢、环化转化为苯和其他芳香烃。从混合物中萃取出芳香烃产物后,再经蒸馏即分出苯。也可以将这些馏分用作汽油。
蒸汽裂解是由乙烷、丙烷或丁烷等低分子烷烃以及石脑油、重柴油等石油组份生产烯烃的一种过程。其副产物之一裂解汽油富含苯,可以分馏出苯及其他各种成分。裂解汽油也可与其他烃类混合作为汽油添加剂。
裂解汽油大约有40至60%苯,同时还含有二烯烃以及苯乙烯等其他不饱和组份,这些杂质在贮存过程中易进一步反应生成高分子胶质。所以要先经过加氢处理过程来除去裂解汽油中的这些杂质和硫化物,然后再适当地分离得到苯产品。
从不同方法得到的含苯馏分,组分非常复杂,用普通的分离方法很难见效,一般用溶剂液-液萃取或者萃取蒸馏的方法分离芳烃,然后再采用一般的分离方法分离苯、甲苯、二甲苯。根据采用的溶剂和技术的不同又有多种分离方法。
甲苯脱烷基制备苯,可以采用催化加氢脱烷基化,或是不用催化剂的热脱烷基。原料可以用甲苯、及其和二甲苯的混合物,或者含有苯及其他烷基芳烃和非芳烃的馏分。
用铬、钼或氧化铂等作催化剂,500至600℃高温和400至600大气压,甲苯与氢气混合可以生成苯,过程称为加氢脱烷基化作用。如果温度更高,则可以省去催化剂。按照以下方程式反应:
根据所用催化剂和工艺条件的不同又有多种工艺方法:
甲苯在高温氢气流中可不催化就脱烷基生成苯。反应为放热反应,针对遇到的不同问题,开发出了多种工艺过程。
二甲苯用量上升,在1960年代末相继开发出可以同时增产二甲苯的甲苯歧化和烷基转移技术,主要反应为:

这反应可逆,工艺过程因催化剂、工艺条件、原料而异。
此外,苯还可以通过乙炔三聚得到,但产率很低。具体的做法是,将乙炔通过高温石英管(500℃)。反应方程式如下:
此反应实则为狄尔斯-阿尔德反应。
气相色谱和液相色谱可以检测各种产品的苯含量。苯的纯度一般用冰点法测定。
检测空气中的微量苯,可以用甲基硅油等易挥发有机溶剂或者低分子量聚合物吸收,然后用色谱分析;或者采用比色法分析;也可以将含有苯的空气深度冷冻,将苯冷冻下来,然后把硫酸铁和过氧化氢溶液加入得到黄褐色或黑色沉淀,再用硝酸溶解,然后用比色法分析。或者直接用硝酸吸收空气中的苯,硝化成间二硝基苯,然后用二氯化钛溶液滴定,或者用间二甲苯配制的丁酮碱溶液比色定量。
苯易挥发,暴露于空气中很易扩散。人和动物吸入或皮肤接触大量苯进入体内,会引起急性和慢性苯中毒。有研究报告表明,引起苯中毒的部分原因是苯在体内转化为苯酚。
苯会麻痹中枢神经系统,引起急性中毒。重者会出现头痛、恶心、呕吐、神志模糊、知觉丧失、昏迷、抽搐等症状,严重者会因中枢系统麻痹而死亡。少量苯也能使人产生睡意、头昏、心率加快、头痛、颤抖、意识混乱、神志不清等现象。摄入含苯过多的食物会引起呕吐、胃痛、头昏、失眠、抽搐、心率加快等症状,甚至死亡。吸入20000ppm的苯蒸气5至10分钟便会有致命危险。
长期接触苯会对血液造成极大伤害,引起慢性中毒,引起神经衰弱综合症。苯可以损害骨髓,使红血球、白细胞、血小板数量减少,并使染色体畸变,从而导致白血病,甚至出现再生障碍性贫血。苯可以导致大量出血,从而抑制免疫系统的功用,使疾病有机可乘。有研究报告指出,苯在体内的潜伏期可长达12至15年。
妇女吸入过量苯后,会导致月经不调达数月,卵巢会缩小。苯对胎儿发育和对男性生殖力的影响尚未明了。孕期动物吸入苯后,会导致幼体的重量不足、骨骼延迟发育、骨髓损害。
苯对皮肤、粘膜有刺激作用。国际癌症研究中心(IARC)已经确认苯为致癌物。[15][16]
接触限值:
毒性:
当然,每个人的健康状况和接触条件不同,对苯的敏感程度也不相同。嗅出苯的气味时,它的浓度大概是1.5ppm,这时就应该警惕中毒的危险。检查时,尿和血液可以很易查出苯的中毒程度。
苯主要经呼吸道吸入(47至80%)、胃肠及皮肤吸收的方式进入人体。一部分苯可由尿液排出,未排出的苯则首先在肝中细胞色素P450单加氧酶作用下给氧分子氧化为环氧苯(7-氧杂双环[4.1.0]庚-2,4-二烯)。环氧苯与它的重排产物氧杂环庚三烯存在平衡,是苯代谢过程中产生的有毒中间体。接下来有三种代谢途径:与谷胱甘肽结合生成苯巯基尿酸;继续代谢为苯酚、邻苯二酚、对苯二酚、偏苯三酚、邻苯醌、对苯醌等,以葡萄糖苷酸或硫酸盐结合物形式排出;以及氧化为已二烯二酸。
苯可在空气中燃烧,一般都定为危险品。例如在中华人民共和国国家标准《危险货物品名表》(GB 12268-90)中,苯属第三类危险货物易燃液体中的中闪点液体。[17]而且它甚易挥发,可能造成蒸气局部聚集,贮存、运输时一般都要求远离火源和热源,防止静电。
苯的冰点颇高(5.5℃),在寒冷天气中运输会有困难,但是加热熔化会有危险。
早在1920年代,苯就已是工业常用的溶剂,主要用于金属脱脂。苯有毒,人体能直接接触溶剂的生产过程现已不用苯作溶剂。
苯有减轻爆震的作用而能作为汽油添加剂。在1950年代四乙基铅开始使用以前,所有抗爆剂都是苯。然而现在含铅汽油淡出,苯又重新起用。苯对人体有不利影响,对地下水质也有污染,欧美国家限定汽油中苯的含量不得超过1%。2011年,美国国家环境保护局再次收紧限制,汽油的苯含量上限降至0.62%。[18]
苯在工业上最重要的用途是做化工原料。苯可以合成一系列苯的衍生物:
在若干软性饮品,如部份汽水、果汁饮品、果汁味饮品、葡萄适中,苯甲酸盐类防腐剂(包括苯甲酸钠、苯甲酸钾、苯甲酸钙)[19]会跟维他命C(抗坏血酸)或异抗坏血酸发生化学作用,脱羧,形成少量致癌物质苯,光照或加热时加速反应。多数饮料中,苯的含量都在每公斤10μg以下,符合世界卫生组织标准(10ppb),但高于美国(5ppb)[20]、加拿大(5ppb)和欧盟(1ppb)[21]的标准。有少量饮料含有较高含量的苯,含量最高的可达87.9ppb,但与日常生活中吸入的苯含量相比,这个数值仍然较小。例如,人每天吸入的洁净空气中约含苯220μg;人开车一小时会吸入40μg苯;每天吸20支烟的人约会吸入7900μg苯(欧盟估计值),经二手烟吸入的苯也有63μg。[22]
下面是一些苯的著名取代物或与苯结构相似的物质。
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.