热门问题
时间线
聊天
视角
水的性质
純水的物理和化學性質 来自维基百科,自由的百科全书
Remove ads
水(H
2O)是一种极性无机化合物,也是一种在常温下无味无臭的液体。其几乎无色,只有微弱的蓝色,是迄今为止研究次数最多的化合物[2],被称为“通用溶剂”[3]和“生命溶剂”[4]。水是地球表面最丰富的物质[5],并且是唯一一种在地球表面以固体、液体和气体三种形式存在的常见物质[6]。水分子也是宇宙中含量第三丰富的分子,仅次于氢分子和一氧化碳分子[5]。
水分子之间通过氢键相互作用,且具有较强的极性。这种极性使水能够解离盐中的离子,并与其他极性物质(如醇和酸)形成键,从而溶解它们。水分子间的氢键使水具有许多独特的性质,例如其固态比液态密度低、与其摩尔质量相比具有较高的沸点(100°C)以及具有较高的热容量。
水是一种两性物质,意味着它能根据溶液的pH值表现出酸性或碱性的特性,并能轻易生成H+
和OH−
离子。水的两性特性导致其发生自我离子化。水的H+
和OH−
离子的活性度是常数,因此它们的浓度是互为反比的[7]。
Remove ads
热力学性质
- 气态:气态的水即我们所说的水蒸气。水蒸气是无色的,我们看到的白色水气是水蒸气冷凝后的液态小水滴。
- 过冷水是低过0℃的水,在破坏平衡下会迅速结冰。超临界水是在高压和高温环境下形成的水,不仅具有极强的氧化能力,而且极易与油和其他物质混合,具有很强融合能力。
- 固态的水即我们熟知的冰。由于氢键的存在,当水被冷却至冰点附近时,水分子能透过重组来使能量最小化的关系,所以氢键的存在意味着分子可以形成带六角形晶体结构的冰,这种冰的密度实际上较低:因此于固态时(冰)会浮水上。亦即是说,水结冰时会膨胀(负热膨胀)。在足够压力下,固体密度比液体低会带来一个效果。当压力增加时熔点下降,而当熔点温度比周围环境低时冰会熔化。要使熔点大幅度下降需要增加相当大的压力——溜冰者所施加的压力只会把熔点下调约0.09℃。
- 热冰是水的另一个现象,即水在室温下,加以106V/m的电场,也能变成冰[8]。这个现象被用来解释云的形成,云层里的冰晶初次形成时需要−10 °C的低温,而后来再次结冰只需要−5 °C,这意味着晶体的结构发生了改变。[9]
- 聚合水是一个水的聚合物的假设,在1960年代晚期是科学界的争论话题之一。现在多数人认为聚合水并不存在。
Remove ads
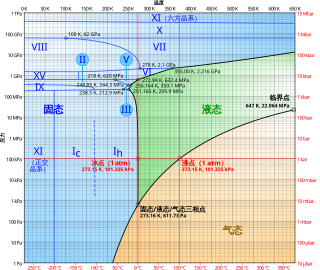
- 三相点:固态、液态和气态能同时存在的温度和压力就被称为水的三相点。这点用于制定温度单位(开氏度,间接摄氏度,甚至华氏度都是)。约定俗成的三相点温度为273.16 K (0.01 oC),而压力则为611.73 Pa。这个压力是颇低的,约为海平面大气压力(101,325 Pa)的1/166。火星这颗行星上的表面大气压力跟三相点压力非常地相近,故火星的零海拔或“海平面”被规定为大气压力跟三相点压力一致的高度。
- 临界点:在其临界温度及压力(647K及22.064MPa)时,水分子会变为一种“超临界”状态,液态般的水滴漂浮于气态之中。
- 熔点、沸点:尽管氢键是一种相对较弱的引力(跟连接水分子内原子的共价键比较时),但是它造就了水的多个特性。其中一个特性就是水相对较高的熔点及沸点,因为需要更多能量才能够克服分子间的氢键。相近的化合物硫化氢(H2S)的氢键较水的弱,在室温下是气体。维也纳标准平均海水(VSMOW)的熔点在273.1500089(10) K / 0.000089(10)℃ ,沸点在373.1339 K / 99.9839 ℃。在历史上,人们曾利用水的性质来定义温度的标度。值得注意的是,热力学温标、摄氏温标和华氏温标都是,或曾经是用水的熔沸点来定义的。其他不常用的温标,例如Delisle温标、牛顿温标、列氏温标和罗氏温标,也是用相似的方法定义的。在现代,人们更普遍使用水的三相点作为一个标准点。[10]
水分子间额外的键为液态水带来了高比热容。这种高比热容使水成为一种较佳的热量储存媒介。
分子间作用

水分子间的电磁相互作用分为氢键和范德华力。氢键是一种较强的分子间作用力,强于范德华力,又比化学键弱得多。一个水分子最多能形成四条氢键,因为它能够在接受两个电子的同时也可以提供两个电子。水跟其他氢键液体(如氟化氢、氨及甲醇)在热力学、动能及结构方面的表现差别明显,原因在于水是唯一能形成四条氢键的分子,其他分子不能这样做的原因有二:一是由于它们不能再提供或接受氢,二是由于这样做会形成引起立体效应的残馀物。由水的四条氢键所形成的正四面体序列,产生了开放结构以及三维结合网络,跟简单液体内部的紧密结构截然不同。尽管水是有氢键结合网络的液体,而二氧化硅则有高熔点的电价网络,但两者的异常表现仍有相近之处。水适用于生命体,而且被它们采用,原因在于它在各生物程序适应的一系列温度状况下展示出独有的性质,包括水合作用。
一般被认为水的氢键主要是由静电力及一些电价性所导致的。氢键的类电价性质由莱纳斯·鲍林于1930年代预测,至今仍待实验及理论计算的明确证明。
Remove ads

水的表面张力其大小与温度负相关。由于水具有所有非金属液体中最大的表面张力值72.8 mN/m(20℃),使水滴保持相对稳定。当少量水滴滴在玻璃板上,即可观察到水的表面张力:水滴继续保持液滴状态。另一个常见的例子是,向一杯注满水的玻璃杯中缓缓投放硬币,水不会立刻溢出,而是向上凸起。
水的毛细现象对生物来说非常重要。例如,植物吸水时,水通过茎内的木质部向上运输。强大的分子间作用力维持维管束中水的柱状形态,粘接性使水柱聚集,粘性使水紧贴维管束壁,而张力则能防止叶面蒸腾作用导致水柱断裂。其他低张力的液体则会导致液柱裂开,形成真空,使蒸腾作用失效。[11]
水的浸润性是指水在物体表面的展开性和渗透性。水滴会在亲水性物体,如玻璃、金属等表面展开形成水膜,在疏水性物体如蜡的表面则会形成球形。渗透性是指一种材料在不损坏介质构造情况下,能使水通过的能力。[12]

水的一项重要特性就是它的极性。水分子呈角状,当中氢原子位于末端而氧原子则在顶点。由于氧的电负性比氢高,所以分子中有氧原子的一边电荷会偏负。带这样一个电荷差的分子被称为偶极子。电荷差使得水分子互相吸引(偏正电的区域会被偏负电的区域吸引),同时亦使它们和其他极性分子互相吸引。这种吸引力被称为氢键,它解释了许多水的特性。某些分子,如二氧化碳,原子间负电性亦有差异,但不同之处在于二氧化碳分子形状成对称排列,因此对立电荷会被相互抵消。如果将电荷靠近小水柱时亦可观察到水的此一现象,这现象会使水柱向电荷方向弯曲。
物理性质
水(H2O)的摩尔质量为18g·mol⁻¹,即6.02×1023个水分子的质量为18克。重水(D2O)是普通水的氢原子被它更重的同位素(氘)所取代而形成的,摩尔质量为20g·mol⁻¹,其化学性质和普通水基本一致,常用在核反应堆中减速中子。1933年,吉尔伯特·牛顿·刘易斯分离出来第一份纯的重水。超重水(T2O)由两个氚和一个氧组成,摩尔质量为22g·mol⁻¹,半衰期约12年。

冰的密度比液态水要“低”,所以冰会浮在水上。在室温时,液态水在温度降低时密度会增加,但在接近冰点的3.98°C 时,水达到其最大密度,而且当水的温度继续向冰点下降,在标准状态下液态水会膨胀,密度并因此会变“低”。这现象的物理原因跟普通冰的晶体结构有关,该结构又被称为六角形。水、镓、铋、锑和硅都会在凝固时膨胀;其他大部份材料则收缩。但要注意的是,并不是所有种类的冰密度都比液态水低。例如高密度非结晶冰和超高密度非结晶冰的密度都比液态纯水要高。因此,普通冰密度比水低的理由并不能容易地凭直觉所得,而且它跟氢键固有的不寻常特性有很大的关系。
总的来说,水在凝固时的膨胀是由于其以氢键不寻常的弹性而排成的纵列分子结构,以及能量特别低的六角形晶体形态(也就是标准状态下所采用的形态)。那就是当水冷却的时候,它尝试在晶格形态下成堆,而该晶格会把键的旋转及振动分量拉长,所以一个水分子会被邻近的几个分子推挤,这实际上就减少了当水在标准状态下成冰时的水密度ρ。
这特性在地球生态系统中的重要性是不言而喻的。例如,“如果”水凝固的时候密度较高的话,极地环境中的湖泊和海洋最后都会结成冰(从上至下)。这是因为此时冰会沉到湖底及河床,而必要的升温现象(见下文)在夏季时则因暖水层质量比底下的固态冰层低而发生不了。自然界的一个重要特征就是上述并不会在环境中自然发生。
然而,冷水(在相关生物系统中的一般自然设定下)因氢键而在从冰点以上的3.98°C所开始产生的不寻常膨胀,为淡水生物在冬季提供了一重要的好处。在表面上被冷冻的水沉下,形成提供对流的水流并冷却整个水体,但当湖水到达4°C 时,若继续冷却则表面水密度降低,形成一表面层,该层水最后会凝固成冰。由于向下的冷水流被密度的转变挡住,冬季任何由淡水所成的大水体最冷的水都会在表面附近,离开湖底及河床。这说明了多种不为人知的冰性质,它们跟湖中的冰相关及像二十世纪早期科学家卡夫特(Horatio D. Craft)所描述的“跌出湖的冰”。
Remove ads
水的压缩系数随压强和温度变化。在0℃和0气压情况下,水的压缩系数是5.1×107 bar−1。[14] 随着压力的增大,压缩系数不断减小,在0℃达到3.9×107 bar−1。水的本体模量是2.2×109 Pa。[15] 非气体,尤其是水的低可压缩性,使人们往往错误地认为水不可压缩。水的低可压缩性,意味着即便是在4000米深的海底,压强达到4×107 Pa,水的体积也仅仅减少了1.8%。[15]

不包含任何离子的水是优良的绝缘体,可即使是去离子水也不是完全没有离子的。水在绝对零度以上的任何温度下都会发生自偶电离。由于水是优良的溶剂,所以其中总会含有微量的溶质,多数情况下为无机盐。即使很少量的杂质也会使水导电,因为溶于水中的盐会电离为自由离子。水分子的导电过程被称为格罗特斯机理(Grotthuss mechanism)[16]。
化学性质
通常情况下,水可由通电而分解为氢气和氧气两种物质,此过程被称为电解。此时水分电离出的H+及OH−离子,分别向阴极及阳极移动。两个H+在阴极获得两电子形成气体H2,而四个OH−则于阳极结合并释放出氧气、分子水及四个电子。气体生成气泡升上水面,可被收集。已知水电阻率的最大理论值于25℃时约为182 kΩ ·m2/m(18.2 MΩ·cm2/cm)。此数字与超纯水系统逆渗透时观测到的相当一致,该系统的水经超过滤及去电离处理,半导体制造厂等会用到。盐或酸等污染物水平即使超过一万亿分之一(ppt),都会使电阻率水平大幅下降达好几个kΩ·m2/m(相等于电导上升几百nS/m)。
1800年,英国化学家威廉·尼科尔森第一次使用电解的方法将水分解成为氢气和氧气。1805年,约瑟夫·路易·盖-吕萨克和亚历山大·冯·洪堡展示了水是由两体积的氢和一体积的氧组成。
由于水的极性,水是一种良好溶剂。当离子或极性分子进入水中,就会被水分子立刻包围。水的相对分子质量使一个溶质分子可以被多个水分子包围。偶极中偏负电的部分受溶质中的正电部份吸引,而偶极中的正电部分则反之亦然。
一般来说,离子分子和极性分子诸如酸,酒精,和盐类比较容易溶解在水中,而非极性分子如脂类,油,等有机物在水中由于范德瓦耳斯力作用而聚集。
一个离子化合物溶质的典型例子是食盐(NaCl),它会在水中分离为Na+阳离子和Cl−阴离子,每个被水分子包围的离子会从晶格上移走,进入溶液。一个非离子溶质的例子是蔗糖,水中的氢离子与蔗糖的-OH基结合,从而将蔗糖分子带入溶液。
在化学上,水是一种两性物质,即水可以同时充当酸和碱。当水的pH值为7(中性)时,氢氧根离子(OH−)浓度等于水合氢离子(H3O+)浓度。当化学平衡被破坏时,两种离子的比例发生变化,而表现出酸性或碱性。
根据布仑斯惕-劳里酸碱理论(Brønsted-Lowry)系统,酸被解释为一种在反应中失去质子(一个 H+离子)的物质,而碱则是在反应中得到质子的物质。所以在反应中遇到强酸,水就充当碱,相反,遇到强碱,水就充当酸。例如,在平衡状态中,水从HCl得到H+离子,充当碱:
- HCl + H2O ⇌ H3O+ + Cl−
在和氨水的反应中,H2O 失去H+离子,水充当酸:
- NH3 + H2O ⇌ NH4+ + OH−
理论上,在298 K温度下的水的pH值为7。但事实上,纯水的制备是非常困难的。暴露在空气中的水会迅速地吸收二氧化碳,生成低浓度的碳酸(pH极限值为5.7)。云滴形成以及雨滴掉落的过程中,水也会吸收空气中CO2,因此大部分地球上的水都是弱酸性的。如果空气中氮氧化物和硫氧化物含量过高,就会导致酸雨。

水分子上还有未成键的孤对电子,能与酸放出的氢离子结合生成水合氢离子,所以水也是一种路易斯碱。
H2O+H+→H3O+
量子特性
尽管水的分子式一般被认为是分子热力学的稳定结果,但于1995年开始的近期研究指出在水的亚原子量子水平时,水表现得较像H3/2O,而不是H2O。[18] 此结果可能对生物、化学及物理系统里的氢键等水平上产生重要的分支课题。实验指出当中子及质子与水碰撞时,它们的散射方式表明它们只受1.5:1的氢氧比率所影响。然而,能观测到这反应的时间段需以微微微秒(10−18 s)来量度,故此只与被高度分解的运动及动力系统有关系。[19][20]
系统命名法
水(Water)和氧烷(oxidane)是被国际纯粹与应用化学联合会承认的正式名称。另外氧化氢这个名称也用来描述这个分子。
对水来说,最简洁的系统命名是“氧化氢”。这个命名与对相关化合物命名相似,如过氧化氢、硫化氢和氧化氘(重水)。另外一个系统名称是氧烷(oxidane),它被用来作为对基于氧的相关取代基系统命名时的母体。[21] 但事实上,这些取代基常常有其他的推荐名称,例如,羟基(hydroxyl)被推荐来描述-OH集团,而不是“oxidanyl”。IUPAC也认为不应该使用oxane来描述这个分子,因为它已经被用来描述一个环醚,也被叫做四氢吡喃。相似的化合物还包括二𫫇烷和三氧杂环己烷(trioxane)。
参考文献
参考书目
参见
外部链接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




![{\displaystyle {2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightleftharpoons } {}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/bfc620bea57792d52572dca9764123ab04e3a593)