Білки
біомакромолекула, що полімерізується з амінокислот З Вікіпедії, вільної енциклопедії
Білки́ — великі біомолекули та макромолекули, які містять один або кілька довгих ланцюгів амінокислотних залишків, сполучених пептидними зв'язками. Білки виконують широкий спектр функцій всередині організмів, включаючи каталізацію метаболічних реакцій, реплікацію ДНК, реагування на подразники, створення структури клітин і організмів і транспортування молекул з одного місця в інше. Білки відрізняються один від одного насамперед своєю послідовністю амінокислот, яка диктується послідовністю нуклеотидів їхніх генів і яка зазвичай призводить до згортання білків в специфічну тривимірну структуру, яка визначає його активність. В однині (білок) термін найчастіше використовують для посилання на білок як речовину, коли неважливий її конкретний склад, та на окремі молекули або типи білків, у множині (білки) — для посилання на певну кількість білків, коли точний склад важливий.
| Білки | |
 | |
| Досліджується в | протеїнологіяd і protein chemistryd |
|---|---|
| Кодуючий ген | білок-кодувальний генd |
| Модельний елемент | білок у харчуванні |
| EntitySchema для класу | Помилка Lua у Модуль:Wikidata у рядку 242: Невідомий тип сутності.. |
| Білки у Вікісховищі | |

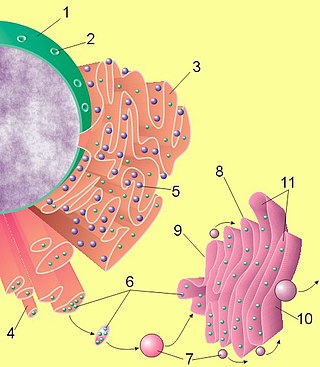
Лінійний ланцюг із амінокислотних залишків називається поліпептидом. Білок містить принаймні один довгий поліпептид. Короткі поліпептиди, що містять менше 20-30 залишків, рідко вважаються білками і їх зазвичай називають пептидами, а іноді і олігопептидами. Окремі амінокислотні залишки з’єднані між собою пептидними зв’язками та сусідніми амінокислотними залишками. Послідовність амінокислотних залишків у білку визначається послідовністю гена, яка закодована в генетичному коді. Загалом, генетичний код визначає 20 стандартних амінокислот; але у деяких організмів генетичний код може включати селеноцистеїн і — у деяких архей — піролізин. Незабаром після або навіть під час синтезу залишки в білку часто хімічно модифікуються шляхом посттрансляційної модифікації, яка змінює фізичні та хімічні властивості, згортання, стабільність, активність і, зрештою, функцію білків. Деякі білки мають приєднані непептидні групи, які можна назвати простетичними групами або кофакторами. Білки також можуть працювати разом для досягнення певної функції, і часто з’єднуються, утворюючи стабільні білкові комплекси.
Після утворення білки існують лише протягом певного періоду, а потім розкладаються та переробляються механізмами клітини в процесі обміну білків. Тривалість життя білка вимірюється з точки зору його періоду напіврозпаду і охоплює широкий діапазон. Білки можуть існувати протягом хвилин або років із середньою тривалістю життя 1-2 дні в клітинах ссавців. Аномальні або неправильно згорнуті білки деградують швидше через те, що вони націлені на руйнування, або через їхню нестабільність.
Як і інші біологічні макромолекули, такі як полісахариди та нуклеїнові кислоти, білки є невід'ємними частинами організмів і беруть участь практично в кожному процесі всередині клітин. Багато білків є ферментами, які каталізують біохімічні реакції і є життєво важливими для метаболізму. Білки також мають структурні або механічні функції, такі як актин і міозин в м’язах і білки в цитоскелеті, які утворюють систему каркасів, що підтримує форму клітини. Інші білки мають важливе значення в передачі сигналів у клітинах, антитілах, адгезії клітин і клітинному циклі. У тварин білки необхідні в раціоні для забезпечення незамінних амінокислот, які не синтезуються. Травлення розщеплює білки для використання в обміні речовин.
Білки можуть бути очищені від інших клітинних компонентів за допомогою різноманітних методів, таких як ультрацентрифугування, преципітація, електрофорез та хроматографія; Поява генної інженерії зробила можливим ряд методів для полегшення процесу очищення. Методи, які зазвичай використовуються для вивчення структури та функції білка, включають імуногістохімію, сайт-спрямований мутагенез, рентгенівську кристалографію, ядерний магнітний резонанс та мас-спектрометрію.
Загальний опис
Узагальнити
Перспектива
| Зовнішні відеофайли | |
|---|---|
| 1. Що таке білки // Канал «Цікава наука» на YouTube, 8 липня 2021. | |
Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами. Послідовність амінокислот у конкретному білку визначається відповідним геном і зашифрована генетичним кодом. Хоча генетичний код більшості організмів визначає лише 20 «стандартних» амінокислот, їхнє комбінування уможливлює створення великого різноманіття білків із різними властивостями. Крім того, амінокислоти у складі білка часто зазнають посттрансляційних модифікацій, які можуть виникати і до того, як білок починає виконувати свою функцію, і під час його «роботи» в клітині. Для досягнення певної функції білки можуть діяти спільно, і часто зв'язуються, формуючи великі стабілізовані комплекси (наприклад, фотосинтетичний комплекс).
Функції білків в клітині різноманітніші, ніж функції інших біополімерів — полісахаридів і нуклеїнових кислот. Так, білки-ферменти каталізують протікання біохімічних реакцій і грають важливу роль в обміні речовин. Деякі білки виконують структурну або механічну функцію, утворюючи цитоскелет, що є важливим засобом підтримки форми клітин. Також білки грають важливу роль в сигнальних системах клітин, клітинній адгезії, імунній відповіді і клітинному циклі.
Білки — важлива частина харчування тварин і людини, оскільки ці організми не можуть синтезувати повний набір амінокислот і повинні отримувати частину з них із білковою їжею. У процесі травлення протеолітичні ферменти руйнують спожиті білки, розкладаючи їх до рівня амінокислот, які використовуються при біосинтезі білків організму або зазнають подальшому розпаду для отримання енергії.
Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни, від грец. πρώτα — «першорядної важливості». Проте їхня центральна роль в життєдіяльності всіх живих організмів була виявлена лише у 1926 році, коли Джеймс Самнер показав, що фермент уреаза також є білком[1]. Секвенування першого білка — інсуліну, тобто визначення його амінокислотної послідовності, принесло Фредерику Сенгеру Нобелівську премію з хімії 1958 року. Перші тривимірні структури білків гемоглобіну і міоглобіну були отримані за допомогою рентгеноструктурного аналізу, за що автори методу, Макс Перуц і Джон Кендрю, отримали Нобелівську премію з хімії 1962 року[2][3].
Історія дослідження
Узагальнити
Перспектива

Білки були виділені в окремий клас біологічних молекул у 18 столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати під час нагрівання або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зерна пшениці. Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однакову емпіричну формулу. Мульдер також визначив продукти руйнування білків — амінокислоти — і для однієї з них (лейцину) майже точно визначив молекулярну масу — 131 дальтон.
Мульдеру, зокрема, належить перша модель хімічної будови білків, запропонована ним у 1836 році. Виходячи з теорії радикалів, він сформулював поняття про мінімальну структурну одиницю у складі білків. Саме ця одиниця зі складом C16H24N405 отримала пізніше назву «протеїну» (Pr), а концепція — теорії протеїну[4]. Сам термін «протеїн», що в сучасному розумінні означає білок більшістю європейських мов, був запропонований у 1838 році співробітником Мульдера Якобом Берцеліусом[5]. Перевірка цієї моделі привернула увагу відомих хіміків свого часу, таких як Юстус Лібіх і Жан-Батист Дюма. Під впливом нових даних теорія протеїну декілька разів корегувалася, але все ж до кінця 1850-х років від неї довелося повністю відмовитися.
До кінця 19 століття вже було досліджено більшість амінокислот, що входять до складу білків. У 1894 році німецький фізіолог Альбрехт Коссель висунув теорію, що амінокислоти є головними структурними елементами білків[6]. На початку 20-го століття німецький хімік Еміль Фішер експериментально довів, що білки збудовані з залишків амінокислот, сполучених пептидними зв'язками. Також він здійснив перші аналізи амінокислотного складу білків та дав пояснення протеолізу. Після 1926 року також стала зрозумілою центральна роль білків в організмах, коли американський хімік Джеймс Самнер (згодом — лауреат Нобелівської премії) показав, що фермент уреаза також є білком[7].
Вивченню білків перешкоджала складність їхнього виділення. Тому перші дослідження білків проводилися з використанням тих поліпептидів, які могли бути очищені у великій кількості, тобто білків крові, курячих яєць, різних токсинів і травних/метаболічних ферментів, які можна було виділити в місцях забою худоби. Наприкінці 1950-х років компанія Armour Hot Dog Co. змогла очистити кілограм бичачої панкреатичної рибонуклеази А, яка стала експериментальним об'єктом для багатьох учених.
Ідея про те, що вторинна структура білків утворюється в результаті формування водневих зв'язків між амінокислотами, була висловлена Вільямом Астбері в 1933 році, але Лайнус Полінг вважається першим ученим, який зміг успішно передбачити вторинну структуру білків. Пізніше Волтер Каузман, спираючись на роботи Кая Ліндерстрем-Ланга, зробив вагомий внесок до розуміння законів утворення третинної структури білків і ролі в цьому процесі гідрофобних взаємодій. У 1949 році Фред Сенгер визначив амінокислотну послідовність інсуліну, продемонструвавши таким способом, що білки — це лінійні полімери амінокислот, а не розгалужені (як у деяких цукрів) ланцюжки, колоїди або циклоли.
Перші структури білків, що ґрунтуються на методах рентгеноструктурного аналізу на рівні окремих атомів, були отримані в 1960-х роках, а за допомогою ЯМР-спектроскопії — в 1980-х роках. У 2006 році Банк даних білків (Protein Data Bank) містив приблизно 40 000 структур білків. У наш час[коли?] кріоелектронна мікроскопія великих білкових комплексів за роздільною здатністю наближається до атомного рівня.
Особливістю досліджень білків початку 21-го століття є одночасне отримання даних про білковий склад цілих клітин, тканин або організмів — протеоміка. У результаті необхідності аналізу цих даних та росту можливостей обчислювальних технологій активно розвиваються методи біоінформатики аналізу та порівняння білкових структур та обчислювальні методи передбачення структури білків, наприклад, методи молекулярної динаміки, призначені замінити в майбутньому експериментальне визначення білкових структур.
Будова білка
Узагальнити
Перспектива
Склад

Молекули білків є лінійними полімерами, що складаються з α-L-амінокислот (які є мономерами цих полімерів) і, в деяких випадках, з модифікованих основних амінокислот (щоправда, модифікації відбуваються вже після синтезу білка на рибосомі). Для позначення амінокислот в науковій літературі використовуються одно- або трибуквені скорочення. Хоча на перший погляд може здатися, що використання «всього» 20 основних типів амінокислот обмежує різноманітність білкових структур, насправді кількість варіантів важко переоцінити: для ланцюжка всього з 5 амінокислот воно становить вже більше 3 мільйонів, а ланцюжок з 100 амінокислот (невеликий білок) може бути представлений більш ніж у 10130 варіантах (для порівняння — кількість атомів у Всесвіті оцінюється приблизно у 1080). Поліпептидні ланцюжки завдовжки від двох до кількох десятків амінокислотних залишків зазвичай називають пептидами, а довші — власне білками або протеїнами, хоча цей поділ вельми умовний.
При утворенні білка в результаті взаємодії α-аміногрупи (-NH2) однієї амінокислоти з α-карбоксильною групою (-СООН) іншої амінокислоти утворюються пептидні зв'язки. Кінці білка називають С- і N- кінцями (залежно від того, яка з груп кінцевої амінокислоти вільна: -COOH чи -NH2, відповідно). При природному синтезі білка на рибосомі нові амінокислоти приєднуються до C-кінця, тому назва пептиду або білка дається шляхом перерахування амінокислотних залишків починаючи з N-кінця.

У довгому поліпептидному ланцюжку між окремими його частинами виникають водневі зв'язки, в результаті поліпептидний ланцюжок закручується по спіралі. Спіраль ДНК підпорядковується правилу золотого перетину — відповідну закономірність можна побачити, спостерігаючи інтервали її вигинів[8]. Таким чином виникає подібна до спіралі структура білкової молекули, яку називають α-структурою білкової молекули. Наявність такої структури встановлена американським хіміком Л.Полінгом та Р.Корі на основі даних рентгеноструктурного аналізу. Таким чином, внутрішньомолекулярні водневі зв'язки впливають на просторову впорядкованість таких складних систем як білки й нуклеїнові кислоти. Водневі зв'язки між двома ланцюгами спіралі ДНК забезпечують геометричну конфігурацію цієї складної молекули, що відповідає за генетичну інформацію.
Послідовність амінокислот у білку відповідає інформації, що міститься в гені даного білка. Ця інформація представлена у вигляді нуклеотидної послідовності, причому одній амінокислоті відповідає одна або декілька послідовностей з трьох нуклеотидів — так званих кодонів. Те, яка амінокислота відповідає даному кодону в ДНК та мРНК (проміжній ланці біосинтезу білків), визначається генетичним кодом, який може дещо відрізнятися у різних організмів.
Гомологічні білки (що виконують одну функцію і мають загальне еволюційне походження, наприклад, гемоглобіни) різних організмів мають в багатьох місцях ланцюжка різні амінокислотні залишки, які називають варіабельними, на противагу консервативним, спільним залишкам. За ступенем гомології можна оцінити еволюційну відстань між різними таксонами організмів.
Рівні структури білків

Окрім послідовності амінокислот поліпептиду (первинної структури), для функціонування білків украй важлива тривимірна структура, яка формується в процесі згортання білків (або фолдинга, від англ. folding). Ця структура утримується в результаті взаємодії структур нижчих рівнів. Тривимірна структура білків за нормальних природних умов називається нативним станом білка. Хоча чимало білків здатні згортатися та приймати нативний стан самостійно, завдяки властивостям свого поліпептидного ланцюжка, інші вимагають допомоги інших білків, молекулярних шаперонів. Виділяють чотири рівні структури білків[9]:
- Первинна структура — пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків у пептидному ланцюжку. Саме первинна структура кодується відповідним геном і найбільшою мірою визначає властивості сформованого білка.
- Вторинна структура — локальне впорядковування фрагменту поліпептидного ланцюжка, стабілізоване водневими зв'язками і гідрофобними взаємодіями. Найпоширеніші типи вторинної структури білків включають[10]: α-спіралі (спіраль, що має 4 залишки на виток, стабілізована водневими зв'язками між пептидними групами з кроком у 4 ланки) і β-листи (кілька зигзагоподібних поліпептидних низок, в яких водневі зв'язки утворюються між відносно віддаленими ділянками ланцюжка або між різними ланцюжками, а не між близько розташованими пептидними групами, як це характерно для α-спіралі). Інші елементи вторинної структури включають π-спіралі (спіралі з кроком водневих зв'язків у 3 ланки), -спіралі (спіралі з кроком водневих зв'язків у 5 ланок), повороти, невпорядковані фрагменти та інші. Найпоширеніша єдина класифікація таких структур — номенклатура DSSP.

- Третинна структура — повна просторова будова цілої білкової молекули, просторове взаємовідношення вторинних структур одна до одної. Третинна структура загалом стабілізується нелокальними взаємодіями, найчастіше формуванням гідрофобного ядра, а також завдяки утворенню водневих зв'язків, сольових містків, інших типів іонних взаємодій, дисульфідних зв'язків між залишками цистеїну.
- До третинної структури зазвичай відносять і проміжні рівні між основними елементами вторинної структури та повною структурою білка — «надвторинну» структуру, що складається із структурних мотивів та доменів. Структурні мотиви — невеликі усталені поєднання кількох елементів вторинної структури, що мають схожу структуру, важливу для виконання білком певних функцій. Схожі структурні мотиви зазвичай виконують схожі функції, завдяки чому за ними можна передбачити функцію невідомого білка. Хоча структурні мотиви можуть бути аналогічними, частіше за все вони зберігаються в процесі еволюції видів. Домени — дещо більші елементи структури білка, що характеризуються стабілізацією незалежною від решти поліпептидного ланцюжка, і що часто виконують окрему функцію. В процесі еволюції елементи надвторинної структури можуть передаватися між генами, надаючи їм нові функції, таким чином існує набагато менше різновидів цих елементів, ніж різних білків. Процес передачі доменів можна здійснити і штучними методами генної інженерії, створюючи химерні білки.
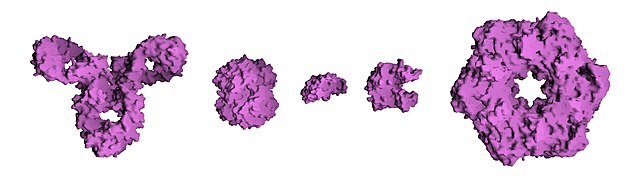
- Четвертинна структура — структура, що виникає в результаті взаємодії кількох білкових молекул, які в даному контексті називають субодиницями. Повна структура кількох поєднаних субодиниць, що разом виконують спільну функцію, називається білковим комплексом.
Розміри
Розмір білка може вимірюватися за числом амінокислот або в одиницях молекулярної маси — дальтонах — Да (частіше, у зв'язку із великими розмірами молекул, в похідних одиницях — кілодальтонах — кДа). Найбільшим відомим одиничним білком є тітін (компонент саркомер м'язів), що містить понад 29 тис. амінокислот і має молекулярну масу 3 МДа[11], а найбільший внутрішньоклітинний білковий комплекс — комплекс ядерної пори хребетних тварин — має масу близько 125 МДа[12]. Проте загалом важко говорити про найбільший розмір білкового комплексу, тому що часто комплекси мають дуже обмежений час життя, крім того, весь цитоскелет клітини, або позаклітинна матриця цілого організму може вважатися єдиним комплексом. Найменший білок також важко визначити, багато білків, що мають ензиматичну активність, не перевищують за розміром кілька десятків амінокислот, багато пептидних гормонів мають ще менші розміри. Інколи найменшим білком вважають єдину невелику амінокислоту пролін, що має самостійну каталітичну активність[13].
Фізико-хімічні властивості
За зовнішнім виглядом білки можуть бути порошками, кристалами, волокнами чи колоїдами. В окремих випадках можливі переходи з одного стану в інший, наприклад, білок, що перебуває у стані колоїдного розчину при висолюванні може випасти в осад, а при відновленні оптимального pH повернутись до колоїдної форми.
Білки також характеризуються ізоелектричною точкою (pI) — кислотністю середовища pH, при якому молекула даного білка не несе електричного заряду. Чим більше в даному білку гідроксильних груп (основних залишків), тим вище у нього pI. Білки з pI, меншим за 7, називаються кислотними, а з більшим за 7 — основними. В цілому pI білка залежить від функції, яку він виконує; так, білки, що зв'язуються з нуклеїновими кислотами, часто належать до основних. Прикладом таких білків є гістони.
За ступенем розчинності у воді білки бувають розчинними (гідрофільними) і нерозчинними (гідрофобними). До останніх відносяться більшість білків, що входять до складу біологічних мембран, тобто інтегральних мембранних білків, які взаємодіють з гідрофобними ліпідами мембрани[14]. Гідрофобні взаємодії — взаємодії та зближення неполярних частин поліпептидних ланцюжків, що супроводжується послабленням їх взаємодії із оточуючою водою[15].
Гідрофобна взаємодія виникає завдяки зближенню двох неполярних груп (наприклад, аланіну й лейцину), доки вони не дотикнуться, причому це зближення супроводжується зменшенням[16] оточуючих їх молекул води — молекули води виштовхуються з тієї сфери, де виникає гідрофобна взаємодія. Здатністю до гідрофобних взаємодій наділені залишки валіну, лейцину, ізолейцину, фенілаланіну тощо. Гідрофобні взаємодії, як і інші нековалентні зв'язки, відіграють роль створення та стабілізації структури, і є специфічними для кожного білка. Одиничні гідрофобні взаємодії, завдяки кооперативності багатьох таких взаємодій, утворюють дуже міцні асоціації, які стабілізують структуру білкової молекули. Вперше значення гідрофобних ділянок поліпептидного ланцюжка у формуванні конфігурації молекули білка показали Д. Л. Талмуд та С. Ю. Бреслер[ru].[джерело не вказане 1813 днів]
Класифікація білків
Білкові молекули класифікують за їхньою формою, хімічним складом і властивостями.
За формою молекули розрізняють два типи білків: фібрилярні та глобулярні. У фібрилярних білків поліпептидні ланцюги просторово розташовані уздовж однієї осі, внаслідок чого вони набувають шаруватої чи волокнистої будови. Більшість фібрилярних білків нерозчинні у воді, тому пов'язані зі структурною чи моторною функціями. У глобулярних білків поліпептидні ланцюги розташовані у різних площинах, внаслідок складення (скручування) молекули в глобулу. Такі білки, як правило, розчинні у воді і виконують сигнальну, регуляторну, каталітичну, захисну функції.
За хімічним складом розрізняють прості та складні білки. Прості білки містять тільки амінокислоти, зв'язані в ланцюжки. На відміну від них складні білки мають також неамінокислотний компонент — простетичну групу. За типом простетичної групи складні білки поділяють на глікопротеїни (з вуглеводним залишком), ліпопротеїни (включають ліпіди), хромопротеїни (містять пігмент), нуклеопротеїни (сполучені з нуклеїновими кислотами), фосфопротеїни (містять фосфатні групи), металопротеїни (містять іони металів), флавопротеїни (включають флавіни) тощо. Деякі простетичні групи служать кофакторами, необхідними для роботи ферментів. Інші, такі як полісахаридні ланцюжки, допомагають білку приймати потрібну конформацію і надають додаткову стабільність. Прикладами органічних простетичних груп в складі білків служать гем (в складі гемоглобіну), тіамін, біотин та інші. Неорганічні простетичні групи найчастіше складаються з іонів металів, найпоширенішими з яких є цинк, магній і молібден[17].
Прості білки за здатністю розчинятися поділяють на такі групи: гістони — розчинні лише у воді; альбуміни — розчинні у воді та сольових розчинах; глобуліни — розчинні тільки у слабких сольових розчинах; склеропротеїни — не розчинні у воді, кислотах, лугах, сольових розчинах[18].
Денатурація білків

Як правило, білки протягом досить довгого часу зберігають структуру і, отже, фізико-хімічні властивості, наприклад, розчинність, в умовах (таких як pH, температура), до яких пристосований даний організм або які підтримуються в його межах в результаті збереження гомеостазу[7]. Різка зміна цих умов, наприклад, внаслідок нагрівання або обробки білка кислотою чи лугом, призводить до втрати четвертинної, третинної і вторинної структур білка, а також обумовлених ними природних властивостей, — цей процес називається денатурацією. Відомий випадок денатурації білка в побуті — приготування курячого яйця, коли під впливом високої температури розчинний у воді прозорий білок овальбумін стає щільним, нерозчинним і непрозорим.
Білки, що використовуються в технологічних методах і вимагають нетипових умов, часто підбираються з екстремофілів — організмів, здатних проживати в екстремальних умовах. Так, наприклад, ДНК-полімераза Taq, що використовується в полімеразній ланцюговій реакції (ПЛР), може витримувати без денатурації багаторазове нагрівання до 95 °C. Вона була спочатку виділена з бактерії Thermus aquaticus. Денатурація в деяких випадках оборотна, як, наприклад, при преципітації водорозчинних білків за допомогою солей амонію, і використовується як спосіб їхнього очищення[19].
Четвертинна структура молекул білка
Розташування білкових субодиниць у просторі та сукупність контактів і взаємодій між ними без огляду на внутрішню геометрію окремих одиниць. Це чітко визначена організація двох чи більше макромолекул з третинною структурою, таких як протеїни, що утримуються разом за рахунок водневих зв’язків, кулонівських чи вандерваальсівських сил. Молекула білка, яка не складається хоча би з потенційно розділюваних субодиниць (не зв’язаних ковалентними зв’язками), не має четвертинної структури (прикладом протеїнів без четвертинної структури є рибонуклеаза, хемотрипсин).
Біосинтез та життєвий цикл білків
Узагальнити
Перспектива
Рибосомний синтез
Живі організми синтезують білки з амінокислот на основі інформації, закодованої в генах. Кожен білок складається з унікальної послідовності амінокислот, яка визначається нуклеотидною послідовністю гену, що кодує даний білок. Генетичний код складається з трибуквених «слів», які називаються кодонами. Кожен кодон відповідає за приєднання до білка однієї амінокислоти: наприклад, поєднання AUG (АУГ) відповідає метіоніну. Оскільки ДНК складається з чотирьох типів нуклеотидів, то загальне число можливих кодонів дорівнює 64; а оскільки в білках використовується 20 амінокислот, то багато амінокислот визначаються більш ніж одним кодоном. Гени, що кодують білки, спочатку транскрибуються в послідовність нуклеотидів матричної РНК (мРНК) білками РНК-полімеразами.
У прокаріотів мРНК може зчитуватися рибосомами в амінокислотну послідовність білків відразу після транскрипції, проте в більшості випадків у еукаріотів та інколи у бактерій вона оброблюється в процесі сплайсингу. Після цього еукаріоти повинні також транспортувати зрілу мРНК з ядра в цитоплазму, де знаходяться рибосоми.
Швидкість синтезу білків вища у прокаріотів і може досягати 20 амінокислот в секунду[20].
Процес синтезу білка з мРНК називається трансляцією. Під час початкової стадії трансляції — ініціації, кодон метионіну розпізнається малою субодиницею рибосоми, до якої за допомогою білкових факторів ініціації приєднана метионінова транспортна РНК (тРНК). Після розпізнавання стартового кодона до малої субодиниці приєднується велика субодиниця рибосоми, і починається друга стадія трансляції — елонгація. На кожному кроці рибосоми від 5'- до 3'-кінця мРНК прочитується один кодон шляхом утворення водневих зв'язків між трьома нуклеотидами (кодоном) мрРНК і комплементарним йому антикодоном транспортної РНК, до якої приєднана відповідна амінокислота. Синтез пептидного зв'язку каталізує рибосомна РНК (рРНК), що утворює пептиділтрансферазний центр рибосоми. Рибосомна РНК каталізує утворення пептидного зв'язку між останньою амінокислотою пептиду і амінокислотою, приєднаною до тРНК, позиціонуючи атоми азоту і вуглецю в положенні, сприятливому для проходження реакції. Фермент аміноацил-тРНК-синтетаза приєднує амінокислоти до їхньої тРНК. Третя і остання стадія трансляції, термінація, відбувається при досягненні рибосомою стоп-кодону, який не кодує амінокислот, після чого білкові фактори термінації гідролізують останню тРНК від білка, припиняючи синтез. В рибосомах білки завжди синтезуються від N- до C-кінця.
Нерибосомний синтез
У деяких грибів і деяких бактерій існує менш поширений спосіб біосинтезу білків, який не вимагає участі рибосом. Синтез пептидів, зазвичай вторинних метаболітів (так званих нерибосомних пептидів), проводиться високомолекулярним білковим комплексом, NRP-синтетазою (від англ. nonribosomal peptide synthetase — «нерибосомна синтетаза пептидів»). NRP-синтетаза зазвичай складається з декількох доменів або окремих білків, що здійснюють підбір амінокислот, утворення пептидного зв'язку, вивільнення синтезованого пептиду й іноді має домен, здатний ізомеризувати L-амінокислоти (нормальна форма) в D-форму[21][22].
Посттрансляційні модифікації білків
Після завершення трансляції і вивільнення білка з рибосоми амінокислоти у складі поліпептидного ланцюжка зазнають різноманітних хімічних модифікацій. Ці модифікації здатні значно розширити різноманітність можливих білків, надаючи їм нові властивості. Прикладами посттрансляційних модифікацій служать:
- приєднання різних функціональних груп (ацетил-, метил- і фосфатних груп);
- приєднання ліпідів і вуглеводнів;
- зміна стандартних амінокислот на нестандартні (наприклад, утворення цитруліну);
- утворення структурних змін (утворення дисульфідних містків між цистеїнами);
- білковий сплайсінг — видалення частини білка як на початку (сигнальна послідовність або метіонін, що кодується старт-кодоном), так і в окремих випадках в середині (інсулін);
- додавання невеликих білків, які впливають на деградацію білків (сумоїлювання і убіквітинювання).
При цьому тип модифікації може бути як універсальним — додавання ланцюжків, що складаються з мономерів убіквітину, служить сигналом для деградації цього білка протеасомою — так і специфічним для даного білка[23]. Водночас один і той же білок може зазнавати численних модифікацій. Так, гістони, білки, що входять до складу хроматину еукаріотів та архей, за різних умов можуть зазнавати до 150 типів різних модифікацій[24].
Сортування білків
Багато білків, які синтезує клітина, призначені для використання у відповідних органелах, на мембранах клітини або у міжклітинному просторі, якого білки досягають шляхом секреції. Правильне сортування критичне для клітини, помилки у цьому процесі часто призводять до хвороб. Процес сортування і транслокації білків здійснюється, виходячи з інформації, що міститься безпосередньо в самому білку. Ця інформація, так звані сигнали сортування, може міститися як в пептидній послідовності білка, так і в просторовій структурі згорнутого білка.
Найпоширенішим механізмом сортування є розпізнавання N-термінальної сигнальної послідовності білка під час синтезу. В цьому випадку комплекс рибосоми з білком переміщається до поверхні шорсткого ендоплазматичного ретикулуму (ЕПР). Там поліпептид, що синтезується, розпізнається транслокаційним комплексом і проходить через мембрану ЕПР. У випадку білків, призначених до секреції, сигнальна послідовність під час синтезу відщеплюється від поліпептиду сигнальною пептидазою. Для деяких трансмембранних білків ця обробка дещо відрізняється.
Деякі білки транслюються цілком в цитозолі, після чого прямують до місця призначення. Це відбувається для білків, призначених для мітохондрій, хлоропластів або пероксисом (в останньому випадку білки зазвичай мають сигнальну послідовність на C-кінці). Також посттрансляційно переміщаються білки, призначені для ядра клітини, вони перетинають ядерну оболонку через ядерні пори.
У бактерій основний механізм сортування білків цитоплазматичної мембрани подібний до еукаріотичного, проте для інших відділів клітини бактерії містять системи секреції I типу, II типу, III типу тощо.
Згортання білків і підтримка їхньої структури

Здатність білків відновлювати правильну тривимірну структуру після денатурації дозволила висунути гіпотезу про те, що вся інформація про кінцеву структуру білка міститься в його амінокислотній послідовності. На початку XXI століття загальновизнаною є теорія про те, що стабільна форма білка має мінімальну вільну енергію в порівнянні з іншими можливими формами цього поліпептиду[25].
Проте кінцева структура буває дуже складною, а процес її прийняття новосинтезованим поліпептидним ланцюжком вимагає деякого часу. Процес прийняття білком цієї структури називається згортанням або фолдингом (від англ. folding). Невеликі однодоменні білки розміром до 100 амінокислот зазвичай згортаються за один крок, таке згортання займає кілька мілісекунд і зазвичай відбувається одночасно з трансляцією[26][27]. З іншого боку, великі складні білки вимагають кілька хвилин або годин для фолдингу, перш за все через ізомеризацію проліну та формування помилкових дисульфідних містків. Такі білки повинні пройти через ряд проміжних кроків для завершення процесу[28].
Багато білків не здатні завершити згортання самостійно і досягти нативного стану, часто через взаємодію з іншими білками клітини. Такі білки вимагають зовнішньої допомоги від білків спеціального класу — молекулярних шаперонів. Часто шаперони необхідні лише за певних умов, наприклад за умов теплового шоку, коли висока температура призводить до збільшення числа помилок згортання[29].
Важливість нормальної роботи шаперонів для функціонування організму може бути проілюстрована на прикладі шаперону α-кристаліну, що входить до складу кришталика ока людини. Мутації в цьому білку призводять до помутніння кришталика через агрегування білків і, як наслідок, до втрати кришталиком ока прозорості й до катаракти[30].
Функції білків в організмі
Узагальнити
Перспектива
Класифікація білків за функцією може бути як біохімічною, тобто за типом безпосередньої біохімічної функції, яку білок виконує в організмі, так і заснованою на головних клітинних процесах, один з кроків яких виконує даний білок. В останньому випадку класифікація включає такі категорії[31]:
- Обробка та збереження інформації (процеси реплікації, експресії генів та підтримки геному);
- Клітинні процеси та сигнали (контроль клітинного циклу, підтримка структури клітини та органів, транспорт, модифікації макромолекул, сигнальні системи);
- Метаболізм (отримання та перетворення енергії, синтез та транспорт ліпідів, амінокислот, цукрів, неорганічних молекул, вторинних метаболітів).
У кожному організмі є невелика кількість білків, які виконують дві чи більше операцій. Найчастіше ці операції належать до одного функціонального блоку. Наприклад, лізил-тРНК-синтаза ссавців є інформаційним білком, що приєднує лізин до тРНК і також регулює реплікацію ДНК і транскрипцію кількох генів[32]. Білок CtrA бактерії Caulobacter crescentus контролює клітинний цикл через регуляцію реплікації і транскрипції[33]. Аналіз геномів показав, що у різних організмів існує велика різниця у кількості білків, що виконують ту чи іншу функцію. Особливо це стосується операційних білків від яких залежить адаптація організму до його екологічної ніші. Цікаво, що у людини та деяких інших організмів частина білків не повністю закодована в успадкованому геномі. Так, велика різноманітність імуноглобулінів досягається за рахунок рекомбінації та мутацій відповідних генів, що тривають протягом усього життя в клітинах імунної системи. Також не треба забувати, що виявлення функцій білків ще не завершене: у будь-якому організмі 20 % чи більше білків виконують функції, про які ще нічого не відомо.
Особливості білків порівняно з іншими біомолекулами

Білки — головні гравці у процесах в межах клітини. Вони виконують специфічні завдання залежно від інформації, закодованої у відповідних генах[34]. За винятком певних типів РНК більшість біомолекул часто розглядаються як інертні субстрати, на які діють білки. Білки складають половину сухої ваги клітин Escherichia coli (Кишкової палички), тоді як такі молекули як ДНК і РНК — лише 3 % і 20 %, відповідно[35]. Повний набір білків специфічної клітини або типу клітин називається протеомом.
Головна характеристика білків, що дозволяє їм виконувати різноманітний набір функцій — здатність специфічно та щільно зв'язуватися з іншими молекулами. Ділянки білків, що відповідають за таке зв'язування, називаються ділянками зв'язування. Вони часто мають вигляд вигину або «кишені» на поверхні молекули. Ця здатність до зв'язування опосередкована третинною структурою білка, яка визначає розташування кишень зв'язування, і хімічними властивостями амінокислот навколишніх бічних ланцюгів. Зв'язування білків може бути надзвичайно щільним та специфічним, наприклад, білок-інгібітор рибонуклеази зв'язується з людським ангіогеніном з менш ніж фемтомолярною константою дисоціації (<10−15 М), але взагалі не зв'язується з його гомологом, онконазою, отриманою з клітин жаб (>1 М). Надзвичайно незначної хімічної зміни, такої як додавання до партнера зв'язування єдиної метильної групи, іноді може бути достатньо для того, щоб майже виключити зв'язування; наприклад, аміноацил-тРНК-синтетаза специфічна до амінокислоти валіну чітко відрізняє його від дуже подібного бічного ланцюга ізолейцину.
Білки можуть зв'язуватися з іншими білками, іншими біомолекулами та невеликими субстратами. Коли білки зв'язуються з іншими копіями тієї ж самої молекули, вони утворюють олігомери, які у деяких випадках формують волокнину; цей процес часто відбувається в структурних білках, які складаються з кулястих мономерів, що є партнерами у взаємному зв'язуванні. Він дозволяє формувати міцні волокна. Білок-білкова взаємодія також регулює ферментативну діяльність, управляючи протіканням клітинного циклу, і надає клітині змогу утворювати великі білкові комплекси, які здійснюють багато складних реакцій, важливих для виконання основних біологічних функцій. Крім того, партнери зв'язування часто здатні індукувати конформаційні зміни в білках, що дозволяє утворення надзвичайно складних сигнальних мереж.
Каталітична функція

Найкраще відома роль білків в організмі — каталіз різних хімічних реакцій. Ферменти — тип білків, що характеризується специфічними каталітичними властивостями, тобто кожний фермент каталізує одну або декілька реакцій. Ферменти каталізують реакції розщеплювання (катаболізм) і синтезу (анаболізм) складних молекул, зокрема, синтез та деградацію ДНК, РНК, білків, ліпідів та цукрів. Крім того, вони каталізують синтез та деградацію малих молекул, хімічні модифікації та ряд інших реакцій, необхідних для життєдіяльності. Відомо близько 4 тис. реакцій, що каталізуються ферментами, багато з них протікають поза межами клітин[36], наприклад фермент пепсин розщеплює білки в процесі травлення. Прискорення реакції в результаті ферментативного каталізу часто величезне: наприклад, реакція, що каталізується ферментом оротат-карбоксилазою протікає в 1017 разів швидше[37], ніж без каталізатора (без ферменту реакція відбувалася б раз у 78 мільйонів років, а за участю ферменту відбувається раз у 18 мілісекунд). Молекули, які змінюються в результаті реакції при посередництві ферментів, називаються субстратами.
Хоча ферменти зазвичай складаються з сотень амінокислот, тільки невелика частина з них взаємодіє з субстратом, і ще менша кількість — в середньому 3-4 амінокислоти в одній молекулі білка, часто розташовані далеко одна від іншої в первинній амінокислотній послідовності, — безпосередньо беруть участь в каталізі[38]. Частина ферменту, яка з'єднується із субстратом і містить каталітичні амінокислоти, називається активним центром ферменту.
Структурна функція
Структурні білки часто грають роль арматури, що надає форму та жорсткість клітинам та тканинам. Зазвичай ці білки здатні формувати довгі філаменти або зв'язувати філаменти, сформовані іншими білками — частина структурних білків є фібрилярними, інші формують філаменти за допомогою полімеризації глобул білка за певних умов[39]. Структурну роль всередині клітини грають компоненти цитоскелету: наприклад глобулярні актин і тубулін в еукаріотів та їхні бактеріальні гомологи FtsZ та MreB. Ці білки дуже динамічні, тобто можуть полімеризуватися при потребі. Вони відіграють роль не тільки у забезпеченні структури, але й у локомоції клітин та клітинному поділі. Інші компоненти цитоскелету — проміжні філаменти еукаріотів та бактеріальний кресцентин — фібрилярні й мають перш за все структурну функцію. Важлива також структурна роль компонентів міжклітинної матриці. Деякі з них збираються в значних кількостях і відіграють роль у забезпеченні структури окремих органів, наприклад, міжклітинний кератин важливий для підтримки структури волосся, нігтів і пір'я птахів. Колаген, ламінін і еластин важливі для підтримки епітелію стінок порожнин організму — легенів, шлунка тощо. Крім того, колаген і еластин — основні компоненти сполучної тканини (наприклад, хряща). Структурні білки також складають клітинну стінку багатьох архей і відіграють роль в утриманні разом полісахаридних компонентів клітинних стінок рослин та бактерій.
Захисна функція

Багато білків, що входять до складу крові, беруть участь в захисній відповіді організму як на пошкодження, так і на атаку патогенів. Прикладами першої групи білків служать фібриногени і тромбіни[40], що беруть участь в згортанні крові, а антитіла (імуноглобуліни), нейтралізують бактерії, віруси або чужорідні білки. Антитіла, що входять до складу імунної системи та відповідають за набутий імунітет, приєднуються до чужорідних для даного організму речовин, антигенів, і таким чином нейтралізують їх, направляючи до місць знищення. Антитіла можуть секретуватися в міжклітинний простір або закріплюватися в мембранах спеціалізованих В-лімфоцитів, які називаються плазмоцитами[41].
Принципово іншим класом захисних білків (зазвичай пептидів) є токсини, що використовуються багатьма організмами для знищення хижаків і паразитів, тоді як власні клітини захищені від токсинів фізичним бар'єром, містять антидот (протиотруту), що локально нейтралізує токсин, або нечутливі до нього через іншу будову, ніж клітини жертви токсинів.
Захист кліток від токсинів, шкідливих хімічних речовин з навколишнього середовища й продуктів власного метаболізму, а також багатьох фармацевтичних препаратів може здійснюватися мембранними білками-насосами. Різноманітність, специфічність і принцип дії таких білків, що відкачують шкідливі речовини із кліток, сильно варіює від організму до організму.
Широко розповсюдженим способом захисту бактерій від бактеріофагів є система рестрикції-модифікації. Один білок цієї системи метилює певні сайти знову синтезованої геномної ДНК бактерій. Інший білок — рестриктаза розщеплює незахищену ДНК бактеріофагів. Існує багато інших способів і відповідних їм білків для захисту бактерій від фагів і еукаріотичних клітин від ДНК- та РНК-вірусів і бактерій. У цілому, за чотири мільярди років еволюційної боротьби між організмами була створена велика різноманітність білків для атаки й захисту клітин, більшість з яких ще не вивчена.
Сигнальна та регуляторна функція
Багато білків беруть участь в процесах передачі сигналів на міжклітинному та внутрішньоклітинному рівнях. Деякі білки, гормони, нейротрансмітери, фактори росту і цитокіни пептидної природи, — позаклітинні сигнальні молекули, що передають сигнал від клітини, де вони були синтезовані, до інших клітин, як поряд із клітиною (нейротрансмітери, фактори росту), так і у віддалених тканинах (гормони). До прикладів таких білків належить гормон інсулін, який регулює концентрацію глюкози в крові та фактор некрозу пухлин, що передає сигнали про запалення між клітинами організму[42].
Інші молекули, залучені до сигнальної системи, — рецептори, що можуть бути як мембранними, так і цитоплазматичними або периплазматичними білками. Одна частина молекули рецептора сприймає сигнал, який з допомогою конформаційних змін передається на іншу частину молекули, що активує передачу сигналу на інші клітинні компоненти. У мембранних рецепторів частина молекули, що зв'язується з сигнальною молекулою, знаходиться на поверхні клітини, а домен, що передає сигнал, усередині[43]. Часто рецептори є водночас і мембранними каналами, відповідь яких на зовнішній сигнал полягає в зміні концентрації певного іона в клітині.
Багато внутрішньоклітинних сигнальних білків організовані в сигнальні каскади, ланки яких модифікують наступний білок за допомогою ковалентних модифікацій (наприклад, фосфорилювання за допомогою білкових кіназ) або зв'язування. Ці каскади передають сигнал про зміну умов навколишнього середовища або внутрішньоклітинні процеси на регуляторні білки, які зі свого боку регулюють клітинну відповідь.
На внутрішньоклітинному рівні експресія генів регулюється приєднанням білків — факторів транскрипції, залежно від напрямку регулювання, активаторів або репресорів, до регуляторних послідовностей генів. На рівні трансляції зчитування багатьох мРНК також регулюється приєднанням білкових факторів[44], а деградація РНК і білків проводиться спеціалізованими білковими комплексами[45].
Транспортна функція
Розчинні білки, що беруть участь в транспорті малих молекул, зв'язують відповідний субстрат в одній частині клітини або організму, наприклад в місцях високої концентрації або при присутності додаткових регуляторних факторів, і легко вивільняють його в місцях низької концентрації субстрату або там, де відсутні згадані регуляторні молекули. Прикладом таких транспортних білків можна назвати гемоглобін, який переносить кисень з легень до решти тканин і вуглекислий газ від тканин до легень, а також гомологічні йому білки, знайдені у представників інших доменів живих організмів[46].

Деякі мембранні білки беруть участь в транспорті малих молекул через біологічні мембрани, змінюючи їхню проникність для цих молекул. Ліпідний компонент мембрани водонепроникний (гідрофобний), що запобігає дифузії полярних або заряджених (іони) молекул. Ці мембранні білки містять внутрішні канали, які дозволяють таким молекулам переміщатися всередину або назовні, та мають можливість відкривати або закривати їх за певними умовами. Багато іонних каналів спеціалізується на транспорті тільки одного іона, так калієві і натрієві канали розрізняють ці схожі йони і пропускають тільки один з них[47].
Багато інших мембранних білків переносять макромолекули до окремих відділів клітини. Наприклад, при сортуванні білків певні сигнали новосинтезованих білків розпізнаються мембранними транспортерами, що селективно пропускають їх через мембрани. Особливим прикладом систем переносу макромолекул через мембрани є механізм ядерного транспорту еукаріотів, центральною частиною якого є великий білковий комплекс ядерної пори, який пропускає невеликі незаряджені молекули (до 30 кДа), тоді як більші за розміром білки вимагають допоміжних білків (каріоферинів). Наприклад, експортини допомагають транспорту великих молекул, таких як зрілі мРНК, зв'язуючись з ними в ядрі, проходять у зв'язаному стані через ядерні пори, й звільнюють їх у цитоплазмі. Інші білки, імпортини, беруть участь у зворотному процесі, допомагаючи транспорту таких білків як фактори транскрипції та компоненти рибосом до ядра клітини.
Ще однією життєво важливою білковою транспортною системою є електронтранспортний ланцюг, необхідний у процесах фотосинтезу та клітинного дихання. В результаті роботи цієї системи, електрони переносяться через мембрану проти електричного поля за рахунок енергії світла або катаболічної енергії, що отримується в циклі Кребса та при окисленні білків і ліпідів. Енергія, збережена у формі різниці електрохімічних потенціалів, використовується іншим білковим комплексом, АТФ-синтазою, для перетворення цієї енергії на АТФ, форму, зручну для використання іншими білками клітини.
Моторна функція
Функцією молекулярних моторів є здійснення механічної роботи в межах клітини за рахунок хімічної або електричної енергії. Так моторні білки, підгрупа молекулярних моторів, переміщують клітинні «вантажі» уздовж філаментів. Моторні білки динеїни і кінезини транспортують молекули та органели вподовж мікротрубочок з використанням гідролізу АТФ як джерела енергії. Динеїни переносять вантаж із цитоплазми у напрямку до центросоми, кінезини в протилежному напрямку[48][49]. Ця активність важлива як для розділення хромосом в анафазі мітозу при клітинному поділі[50], так і для доставлення важливих молекул до місць їхнього використання, часто дуже віддалених, як це відбувається при аксоплазматичному транспорті[51]. Інші моторні білки важливі для життєвих процесів біосинтезу білків, зокрема розплітанні ДНК (топоізомерази) та русі білкових комплексів уздовж ДНК (полімерази) та РНК (рибосоми).
Моторні білки часто відповідають і за макроскопічний рух організму. Наприклад, синхронізований рух багатьох молекул білка міозина уздовж мікрофіламентів у складі саркомер приводить до скорочення м'язів[52]. Для руху окремих клітин використовуються інші молекулярні мотори, наприклад, мотори джгутиків, ворсинок та інших відповідних органел клітини, проте багато механізмів локомоції клітин залишаються невідомими.
Крім пересування об'єктів, молекулярні мотори беруть участь у низці інших важливих для клітини процесів. Наприклад, вірусний пакувальний мотор доставляє синтезований вірусний геном (РНК або ДНК) до вірусного капсиду[53], а електромотор F0 — субодиниця АТФ-синтази — переробляє енергію, отриману за рахунок різниці електрохімічних потенціалів на мембранах мітохондрій (в еукаріотів) або цитоплазматичній мембрані (у прокаріотів), на механічний рух, що використовується іншою субодиницею комплексу (F1) для синтезу АТФ — головного «палива» клітини.
Живильна (резервна) функція
У деяких системах класифікації виділяється окрема група білків, що виконують переважно резервну і харчову функцію. Проте майже усі білки використовуються в організмі як джерело амінокислот. Твердження, що резервна є головною функцією якогось білка, може виявитися необґрунтованим просто через недолік знань. Наприклад, вивчення овальбуміна (основного компонента яєчного білка) показало, що він не тільки служить джерелом сировини, але також бере участь в транспорті іонів металів і може відігравати захисну роль, викликаючи алергію у тварин, у тому числі в людини.
Харчові білки молока — казеїни відрізняються від більшості інших (нормальних) білків тим, що вони не утворюють твердої просторової структури й радше нагадують денатуровані білки. В кишечнику казеїни розрізаються протеазою і коагулюють на стінках. Вивільнення пептидів і амінокислот з коагульованого білка відбувається повільно, підживлюючи організм у період між годівлями. Крім харчової в казеїнів молока були виявлені й інші важливі функції. Короткі пептиди, що виходять із казеїнів під дією кишкових протеаз можуть модулювати сорбцію амінокислот стінками кишечнику, тиск і згортуваність крові, імунну реакцію, а також мати сильні опіоїдні властивості. Таким чином білкова дієта служить не тільки джерелом амінокислот, а має набагато глибший вплив на організм.
Дослідження білків
Узагальнити
Перспектива
Хімічний синтез білків
Короткі білки можуть бути синтезовані хімічним шляхом за допомогою методів, які використовують органічний синтез, — наприклад, хімічне лігування[54]. Більшість методів хімічного синтезу проходять в напрямі від С-кінця до N-кінця, на відміну від біосинтезу. Таким чином можна отримати короткий імуногенний пептид (епітоп), необхідний для отримання антитіл шляхом ін'єкції в тварини, або отримання гібридо́м; хімічний синтез також використовується для отримання інгібіторів деяких ферментів[55].
Хімічний синтез дозволяє вводити до складу білків штучні амінокислоти, тобто такі, що не зустрічаються у звичайних білках, — наприклад, приєднувати флюоресцентні мітки до бічних амінокислотних ланцюжків. Проте сучасні (2008 рік) хімічні методи синтезу неефективні при довжині білків, що перевищує 300 амінокислот; крім того, штучні білки можуть мати неправильну третинну структуру, а в амінокислот штучних білків відсутні посттрансляційні модифікації.
Виділення та очищення білків

Для здійснення аналізу білків in vitro їх потрібно очистити від інших клітинних компонентів. Цей процес зазвичай починається з лізису клітини, при якому клітинна мембрана руйнується і вміст клітини вивільняється у розчин, який називається незрілим лізатом або клітинним екстрактом. Результуюча суміш може бути частково очищена за допомогою ультрацентрифугування, яке фракціонує різні клітинні компоненти у фракції, що містять розчинні білки, мембранні ліпіди й білки, клітинні органели й нуклеїнові кислоти. За допомогою методів преципітації або висолювання можна сконцентрувати білки з цього екстракту. На наступному кроці для ізоляції білка або білків використовуються різні типи хроматографії, що базуються на таких характеристиках білків, як молекулярна вага, питомий заряд (наприклад, високоефективна рідинна хроматографія) або спорідненість до зв'язування (адсорбційна хроматографія). Рівень очищення може контролюватися, використовуючи різні типи гелевого електрофорезу, якщо відомі молекулярна маса білка та його ізоелектрична точка, спектроскопічні методи, якщо білок має помітні спектроскопічні особливості, або випробування ферментативної активності, якщо білок має ферментативну активність. Додатково, білки можуть бути ізольовані на основі їхнього електричного заряду за допомогою ізоелектричного фокусування[56].
Для природних білків зазвичай необхідна серія з кількох кроків очищення, щоб отримати білок, достатньо чистий для застосування лабораторних методів. Для спрощення цього процесу використовується генна інженерія, за допомогою якої можна додати білкам хімічні особливості, що роблять білки легшими для очищення без зміни їхньої структури та активності. Наприклад, до білків додають специфічні послідовності амінокислот, часто серії залишків гістидину («His-мітка»). Як наслідок, коли екстракт проходить через колонку нікелевої хроматографії, залишки гістидину зв'язуються із колонкою, тоді як непомічені білки проходять її без перешкод.
Дослідження функцій та механізмів роботи білків
Біохімічні методи
Для вивчення біохімічної активності ферментів використовуються численні біохімічні методи, що мають загальну назву випробувань ферментативної активності (англ. enzyme assays). Ці методи в більшості випадків проводяться in vitro і ставлять ціллю вимірювання зміни кількості переробленого субстрату білка або кількості створених продуктів реакції. Безперервні методи зазвичай залучають використання оптичних методів, таких як зміна оптичної щільності розчину або його флюоресценції, якщо відомі оптичні властивості субстратів або продуктів реакції, або вимірювання виділеного тепла при реакції. Якщо ці властивості важкі для вимірювання, часто застосовуються хроматографічні або радіографічні методи. Хроматографічні методи (наприклад, гелевий електрофорез, високоефективна рідинна хроматографія) використовуються для розділення продуктів реакції, після чого вони можуть бути візуалізовані за допомогою інших методів. Радіографічні методи залучають використання радіоактивних маркерів (зазвичай одного з атомів в субстраті, заміненого на його радіоактивний ізотоп), що легко візуалізувати фотографічними методами, чутливими до радіонуклідів.
Перевагою методів in vitro зазвичай є можливість виділити один або кілька компонентів, що досліджуються, та вивчати їхню активність, спрощуючи систему за рахунок усунення інших компонентів, зазвичай присутніх у клітині, що можуть впливати на протікання реакції.
Методи генної інженерії
За допомогою одного з методів генної інженерії — направленого мутаганезу (site directed mutagenesis) — дослідники можуть змінити амінокислотну послідовність білка таким чином, що його структура, клітинна локалізація і сприйнятливість до регулювання змінюються. Таким чином можна досліджувати ефект таких змін на функціонування всієї клітини, визначаючи природну роль білка та партнерів, з якими він взаємодіє.
Поширеним застосуванням методу є повне усунення гену (gene knock-out), що кодує даний білок, і досліджування ефекту відсутності активності цього гену на клітину. Часто, коли білок, що відповідає за певну функцію, невідомий, проводиться так званий генетичний скринінг, коли за допомогою транспозонів, що вставляються до геному у випадкових місцях, можна отримати мутантів із відповідним фенотипом, а потім знайти положення транспозону, яке викликало мутацію. Встановлені таким чином білки часто називаються за назвою мутантного фенотипу, що спостерігається.
Методом генної інженерії вдалося отримати пра-білки, що, як вважають дослідники, існували в часи докембрію[57][58].
Оптичні методи

Дослідження білків in vivo часто вимагає визначення локалізації цих білків у межах клітини. Хоча білки синтезуються в цитоплазмі або на мембранах ендоплазматичного ретикулума (в еукаріотів), після цього багато білків направляються до специфічних органел або клітинних структур, де вони виконують свою функцію, що не завжди можливо передбачити за допомогою аналізу структури білка. Таким чином, корисним методом дослідження ролі білків є аналіз локалізації цих білків у клітині. Для здійснення такого аналізу в живих клітинах використовуються химерні білки, до яких додається «репортер», наприклад зелений флюоресцентний білок (англ. green fluorescent protein, GFP). Локалізація такого химерного білка може бути точно визначена за допомогою флюоресцентної мікроскопії, як показано на зображенні.
Інший метод дослідження локалізації білків — імунофарбування — залучає використання флюоресцентно мічених антитіл проти досліджуваного білка, що зв'язуються з ним у вбитих та зафіксованих клітинах.
Часто барвники зв'язують з білками за допомогою біохімічних методів таким чином, що вони мітять специфічні білки в точно визначених місцях, та полегшують детекцію таких білків. За допомогою методу флюоресцентного резонансного переносу енергії (FRET) енергія збудження переноситься з одного барвника (або флюоресцентного білка) на інший, коли вони знаходяться в безпосередній близькості один від одного[59]. Таким чином можна визначати партнерів із білок-білкової взаємодії або досліджувати оптичними методами, в якій конформації перебуває білок у цей час. За допомогою методу відновлення флюоресценції після фотознебарвлення (FRAP) барвник знебарвлюється в певній частині клітини, після чого флюоресценція може поступово відновлюватися, якщо до цього місця потрапляють нові флюоресцентні білки. Залежно від швидкості цього процесу можна визначити швидкість транспорту білка в клітині або визначити частини клітини, фізично відокремлені від інших.
Багато досліджень проводяться на рівні окремих білків. Так, метод флюоресцентної кореляційної спектроскопії (FCS), що вимірює кореляцію флюоресценції в часі від невеличкої (близько 0,2 мікрона) ділянки, дозволяє детекцію окремих молекул усередині клітини та визначення їхньої мобільності, яка залежить від розміру білка та його зв'язування з іншими білками та частинами клітини[60]. На рівні окремих білків (зазвичай in vitro) може використовуватися і метод FRET, що дозволяє досліджувати рух частин білка при виконанні ним своєї функції.
Механічні методи
Використовуються і кілька механічних методів впливу на білки. Так за допомогою лазерних[61] та магнітних щипців[62] і атомного силового мікроскопа[63][64] можна прикладати сили до окремих частин окремих білків, та досліджувати їхній вплив на активність білка, в іншому режимі можна спостерігати механічний рух частин білка одна відносно одної. Це важливо для дослідження руху молекулярних моторів і руху частин ферменту при виконанні їм каталітичної реакції[65].
Дослідження окремих білків має значну перевагу в порівнянні з об'ємними методами тому, що стан кожного білка може бути різним, а середні значення, виміряні в об'ємі, часто не дають інформації про розподіл значень властивостей між окремими білками.
Обчислювальні методи
Для дослідження функції білків широко застосовуються і методи моделювання або математичної біології. Через складність біохімічних шляхів клітини часто важко визначити вплив складної багатобілкової системи на функціонування клітини. Наприклад, методи математичного моделювання були ефективними для визначення механізму роботи АТФ-синтази[66][67] або для з'ясування механізму роботи Min-системи, що відповідає за розміри дочірніх клітин при поділі бактерії Escherichia coli[68].
Часто методи математичного моделювання важливі і для встановлення ефекту невеликого числа білків у клітині (багато білків працюють в кожній клітині лише в кількох примірниках) та флуктуації кількості цих білків.
При розрахунках взаємодій вода-білок застосовується Модель простих точкових зарядів.
Визначення структури білків

Переважна більшість відомих структур білків (близько 90 % в Банку даних білків) були визначені за допомогою рентгенівської кристалографії. Цей метод дозволяє визначення тривимірної структури електронної густини білка в кристалізованому стані, й таким чином вивести координати атомів у 3-х вимірах із певним рівнем роздільної здатності, до приблизно 0,5 Å в найкращому випадку. Близько 9 % відомих структур визначені за допомогою ЯМР-спектроскопії, що також дозволяє отримання структур високої роздільної здатності. Останнім часом також набирає популярності кріоелектронна мікроскопія, як дуже швидкий, хоча і низькоточний, метод визначення структур білків. Її роздільна здатність вже знизилася до менш ніж 5 Å, й обіцяє ще покращитися найближчим часом. Хоча цей метод і не здатний визначити розташування окремих амінокислот або деталі вторинної структури, він широко застосовується для дослідження великих білкових комплексів.
Протеоміка і біоінформатика

Повний набір білків, які в конкретний момент присутні в клітині, певному типі клітин або в організмі, називається протеомом, а дослідження великих наборів даних про ці білки та зв'язки між ними називається протеомікою, що була названа за аналогією з геномікою. Головні експериментальні методи протеоміки включають: мас-спектроскопію, що дозволяє швидке ототожнення високих кількостей білків і встановлення пептидної послідовності, білкові мікрочипи, що дозволяють одночасне визначення відносних кількостей великого числа білків в клітині, двогібридний скринінг, що дозволяє систематичне дослідження білок-білкової взаємодії (встановлюючи їхню повну систему — інтерактом), та інші. Систематичні спроби визначення структури білків та всіх можливих станів кожного білка називаються структурною геномікою.
Зараз доступна велика кількість даних про послідовності геному й послідовності та структури багатьох білків різноманітних організмів, зокрема геном людини, що дозволяє дослідникам ефективно ідентифікувати гомологічні білки у зв'язаних організмах за допомогою вирівнювання послідовностей. Велике число інструментів перевірки послідовностей дозволяє виконувати ряд маніпуляцій з послідовностями, наприклад складати карти ділянок рестрикції, знаходити відкриті рамки зчитування у нуклеотидних послідовностях та передбачати вторинну структуру білків. Інші інструменти, наприклад Clustal, дозволяють складання філогенетичних дерев та перевірку еволюційних гіпотез щодо походження організмів і генів. Надзвичайна кількість наявних даних привела до розвитку біоінформатики, галузі знань, що збирає, позначає та аналізує дані геноміки і протеоміки, застосовуючи обчислювальні методи розв'язання біологічних задач, таких як пошук генів і кладистика.
Передбачення структури білків
Окрім структурної геноміки, існує область досліджень, яка займається передбаченням структури білків і прагне розвинути ефективні методи створення правдоподібних моделей білків, структури яких не були визначені експериментально. Найуспішніший вид передбачення структури, відомий як моделювання гомології, використовує відому структуру «матриці» зі схожою послідовністю до модельованого білка; завданням є лише знайти відмінності та передбачити, яким чином вони впливатимуть на структуру. Хоча створення точних моделей залишається дуже складним, якщо доступні тільки приблизно подібні «матриці», вважається, що вузьким місцем методу є вирівнювання послідовностей. Це підтверджується тим, що у випадку «досконалого» вирівнювання можуть бути отримані дуже точні моделі[69]. Багато методів передбачення структури призначені для використання в новій галузі проєктування білків, що вже дозволила спроєктувати кілька нових типів білкових структур[70]. Складніша обчислювальна проблема — передбачення міжмолекулярних взаємодій, таких як молекулярний докінг і передбачення білок-білкової взаємодії.
Основним методом передбачення структури білків та білок-білкової взаємодії є симуляція процесів згортання та зв'язування білків із використанням методів молекулярної динаміки. Загалом ці методи вимагають величезних обчислювальних ресурсів. Для задоволення цієї потреби створюються сімейства найшвидших сучасних суперкомп'ютерів Blue Gene. Як альтернативу дослідники дедалі більше використовують розподілені обчислення, такі як проєкт Folding@Home («згортання вдома»). Згортання маленьких спіральних областей білків, наприклад «головки» віліну[71] і допоміжного білка ВІЛ[72] вже вдалося успішно просимулювати з атомною точністю in silico, а гібридні методи, що комбінують методи молекулярної динаміки із методами квантової хімії, дозволили просимулювати електронні стани родопсину[73].
Проєктування білків
Важливою областю досліджень сучасних молекулярної біології та генної інженерії стало не тільки вивчення білків, створених природою, або комбінування їх у штучних білках, але й проєктування принципово нових білків із потрібними властивостями. Методи проєктування білків можна розбити на дві головні групи: раціональне проєктування та направлену еволюцію.
В методі проєктування білків робота найчастіше починається із знаходження природного білка із відомою структурою, найближчого за властивостями до потрібного, після серії таких мутацій можна отримати новий білок[74]. Хоча невеликі зміни активно вносяться у білки починаючи з середини 1980-х років, зараз стало можливим конструювати відносно складні білки, наприклад, рецептори нових сполук[75], та конструювати білки de novo, без використання природного шаблону[76].
В альтернативному методі направленої еволюції використовується подібний до необхідного природний білок, до якого додаються випадкові мутації, а в результаті сконструйованого випробування відбираються найкращі примірники. Цей процес може бути повторений багаторазово, часто з додаванням рекомбінації частин різних успішних білків (аналог гомологічної рекомбінації). Перевагою методу є непотрібність будь-яких знань про структуру і методи роботи білка, проте його недоліком є неможливість легкого отримання деяких білків у великих кількостях та рекомбінантні маніпуляції з ними[77][78].
Використання людиною
Узагальнити
Перспектива
Харчування

Білки надходять в організм разом з їжею й служать основним джерелом амінокислот. Обов'язкове використання білків у їжі обумовлене потребою в незамінних амінокислотах, які не можуть синтезуватися людиною з інших речовин. Травлення починається з кислотної денатурації білків у шлунку — необхідної стадії для кулінарно неопрацьованої їжі. Денатуровані білки стають субстратом для протеаз, спочатку в шлунку, а потім у слаболужному середовищі тонкого кишечника. Продукти протеазного розщеплення — короткі пептиди й амінокислоти усмоктуються ентероцитами, розташованими в епітелії тонкого кишечника. Основним транспортером ди- і трипептидів служить мембранний білок Pept1, через який проходить 65—80 % усіх усмоктуваних людиною амінокислот. Активний перенос пептидів білком Pept1 здійснюється за рахунок одночасного транспорту протонів. Pept1 перебуває у дванадцятипалій і порожній кишках, і, меншою мірою, у клубовій кишці. Pept1 був виявлений у товстому кишечнику тільки у новонароджених. Інші 20—35 % амінокислот всмоктуються ентероцитами за допомогою набору амінокислотних транспортерів різної специфічності. Увесь процес усмоктування білкових продуктів триває близько чотирьох годин.
В ентероцитах частина пептидів розщеплюється до окремих амінокислот. Потім амінокислоти й пептиди переправляються транспортерами через протилежну мембрану й розносяться по всьому тілу з потоком крові. Амінокислотне харчування інших кліток організму відбувається за допомогою мембранних транспортерів амінокислот, а також заковтування й протеазного розщеплення зовнішніх білків і пептидів. Для запобігання надлишкових втрат амінокислот з організму в нирках відбувається усмоктування пептидів і амінокислот із крові в цілому схоже на усмоктування цих речовин у тонкому кишечнику.

Регуляція транспорту й метаболізму амінокислот — складний, ще не досить вивчений процес. У ньому беруть участь різні системи організму, у тому числі нервова система, що відповідає за формування відчуття голоду й ситості в головному мозку. Інтерес до механізму білкового травлення проявляють не тільки фізіологи й дієтологи. У медичній практиці виникають питання, пов'язані з персональною алергією до деяких білків. У складніших випадках розробляються спеціальні білкові дієти. У деяких випадках використовують суміші чистих амінокислот. Пептидні транспортери травної системи й нирок активно вивчаються фармакологами, оскільки ряд ліків всмоктується й утримується в організмі за рахунок Pept білків. Білкові й амінокислотні суміші викликають інтерес у спортсменів з метою нарощування м'язів. Слід зазначити, що засвоювання чистих амінокислот організмом сильно відрізняється від звичайного переварювання різноманітних білків їжі.
Білкові лікувальні препарати
Цей розділ потребує доповнення. (грудень 2019) |
Цей розділ не містить посилань на джерела. (грудень 2019) |
Значна кількість досліджень у медицині направлена на використання білків як терапевтичних препаратів та засобів діагностики захворювань. Фармацевтичне застосування білків почалося з природних білків отриманих з різноманітних живих організмів. Нові препарати створюються штучно, рекомбінантними методами або за допомогою проєктування білків. Фармацевтичні препарати, що знаходять широке використання, включають білки крові (наприклад, для лікування гемофілії), тромболітичні ферменти, гормони, цитокіни та фактори росту, білки імунної системи (інтерферони і антитіла, що використовуються для лікування інфекційних захворювань та деяких видів раку) і вакцини.
Прагнення до перемоги за будь-яку ціну штовхає деяких спортсменів, культуристів та спецпризначенців до вживання білкових ліків, що сприяють витривалості та росту м'язів. Найпопулярнішими є еритропоетин та гормон росту людини. Вживання цих препаратів заборонено в багатьох змаганнях, але скандали з відомими спортсменами з'являються щороку. Фармацевтичні білки, як і інші ліки, можуть являти загрозу здоров'ю.
Використання в промисловості
Серед всіх білків в харчовій промисловості активно використовуються численні ферменти. Так, у пекарській промисловості використовуються альфа-амілаза і протеази; у пивоварінні використовуються численні ферменти ячменю (амілаза, глюканази, протеази); целюлази і пектинази використовуються для освітлення соків; хімозин, ліпаза і лактаза використовуються для виготовлення кисломолочних продуктів; а папаїн застосовується для пом'якшення м'ясних продуктів. Для виготовлення крохмалю використовують амілазу і глюкоамілазу, а для виготовлення паперу — целюлази і ксиланазу. Також протео- і ліполітичні ферменти часто додаються до мийних засобів.
Іншим використанням білків є використання фібрилярних білків для виготовлення волокон, що використовуються, зокрема, в текстильній промисловості[79]. Інші застосування включають використання білків у ряді технологічних процесів в хімічній промисловості, створення біосенсорів та інші.
Див. також
Примітки
Джерела
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

