From Wikipedia, the free encyclopedia
Sistemi imunitar është një sistem mbrojtës dhe pritës që përfshin shumë struktura dhe procese biologjike brenda një organizmi që mbron nga sëmundjet . Për të funksionuar si duhet, një sistem imunitar duhet të zbulojë një larmi agjentësh, të njohur si sëmundjeshkaktues patogjenë, nga viruset te krimbat parazitare, dhe t'i dallojë ato nga indet e shëndetshme të organizmit. Në shumë specie, ekzistojnë dy nënsisteme kryesore të sistemit imunitar: sistemi imunitar i lindur dhe sistemi imun adaptiv . Të dy nënsistemet përdorin imunitetin humoral dhe imunitetin e ndërmjetësuar nga qelizat për të kryer funksionet e tyre. Tek njerëzit, pengesa gjaku-truri, pengesa e lëngut cerebrospinal të gjakut dhe pengesat e ngjashme me lëngun-tru ndan sistemin imunitar periferik nga sistemi neuroimmun, i cili mbron trurin
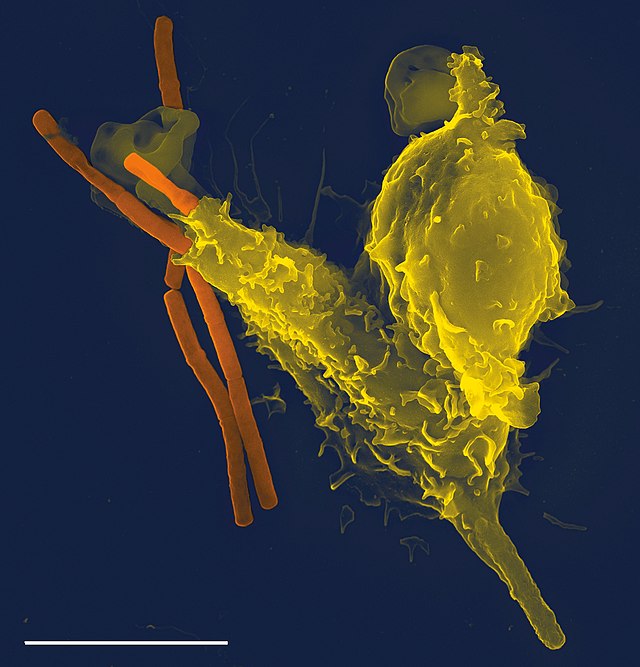
Patogjenët mund të evoluojnë dhe përshtaten me shpejtësi, dhe në këtë mënyrë shmangin zbulimin dhe neutralizimin nga sistemi imunitar; megjithatë, mekanizmat e shumëfishtë mbrojtës kanë evoluar gjithashtu për të njohur dhe neutralizuar patogjenët. Edhe organizmat e thjeshtë njëqelizorë të tillë si bakteret posedojnë një sistem imunitar rudimentar në formën e enzimave që mbrojnë nga infeksionet bakteriofage . Mekanizmat e tjerë themelorë të imunitetit evoluan në eukariotët e lashtë dhe mbeten në pasardhësit e tyre modernë, siç janë bimët dhe jovertebrorët. Këto mekanizma përfshijnë fagocitozën, peptidet antimikrobikë të quajtur defensins, dhe sistemin plotësues . Vertebrorët e nofullave, përfshirë njerëzit, kanë mekanizma mbrojtës edhe më të sofistikuar,[1] duke përfshirë aftësinë për t'u përshtatur me kalimin e kohës për të njohur patogjene specifikë në mënyrë më efikase. Imuniteti adaptues (ose i fituar) krijon memorje imunologjike pas një reagimi fillestar ndaj një patogjeni specifik, duke çuar në një përgjigje të zgjeruar ndaj takimeve pasuese me të njëjtin patogjen. Ky proces i imunitetit të fituar është baza e vaksinimit.
Disrregullimet e sistemit imunitar mund të rezultojnë në sëmundje autoimune, sëmundje inflamatore dhe kancer .[2] Imuniteti i pamjaftueshëm ndodh kur sistemi imunitar është më pak aktiv se normal, duke rezultuar në infeksione të përsëritura dhe të rrezikshme për jetën. Tek njerëzit, imuniteti mund të jetë ose pasojë e një sëmundje gjenetike, siç është imuniteti i rëndë i kombinuar, kushteve të fituara siç është HIV / AIDS, ose përdorimi i ilaçeve imunosupresive. Në të kundërt, autoimuniteti rezulton nga një sistem imunitar hiperaktiv që sulmon indet normale sikur të ishin organizma të huaj. Sëmundjet e zakonshme autoimune përfshijnë tiroiditin e Hashimotos, artritin reumatoid, diabetin mellitus tip 1 dhe lupusin eritematoz sistemik . Imunologjia mbulon studimin e të gjitha aspekteve të sistemit imunitar.
Sistemi imunitar mbron organizmat nga infeksioni me mbrojtje shtresore të specifikës në rritje. Me fjalë të thjeshta, pengesat fizike parandalojnë patogjenët siç janë bakteret dhe viruset të hyjnë në organizëm. Nëse një patogjen shkel këto pengesa, sistemi imunitar i lindur siguron një përgjigje të menjëhershme, por jo specifike. Sistemet imune imune gjenden në të gjitha bimët dhe kafshët.[3] Nëse patogjenët shmangin me sukses reagimin e lindur, vertebrorët posedojnë një shtresë të dytë të mbrojtjes, sistemin imunitar adaptues, i cili aktivizohet nga përgjigja e lindur. Këtu, sistemi imunitar përshtat përgjigjen e tij gjatë një infeksioni për të përmirësuar njohjen e tij të patogjenit. Kjo përgjigje e përmirësuar mbahet më pas pasi të jetë eliminuar patogjeni, në formën e një kujtese imunologjike, dhe lejon sistemin imunitar adaptues të montojë sulme më të shpejta dhe më të forta sa herë që haset në këtë patogjen.[4][5]
| Sistemi imunitar i lindur | Sistemi imunitar adaptues |
|---|---|
| Përgjigja është jo specifike | Reagimi specifik i patogjenit dhe antigjenit |
| Përbëhet nga leukocitet | Përbëhet nga antigjenet, qelizat B, qelizat T |
| Ekspozimi çon në përgjigje maksimale të menjëhershme | Koha e vonesës midis ekspozimit dhe përgjigjes maksimale |
| Komponentët e ndërmjetësuar nga qeliza dhe humori | Komponentët e ndërmjetësuar nga qeliza dhe humori |
| Asnjë memorje imunologjike | Ekspozimi çon në kujtesën imunologjike |
| Gjetur pothuajse në të gjitha format e jetës | Gjendet vetëm në vertebrorët e nofullave |
Imuniteti i lindur dhe adaptiv varen nga aftësia e sistemit imunitar për të bërë dallimin midis molekulave vetjake dhe jo-vetjake. Në imunologjinë, molekulat vetjake janë ato përbërës të trupit të një organizmi që mund të dallohen nga substancat e huaja nga sistemi imunitar.[6] Në të kundërt, molekulat jo-vetjake janë ato të njohura si molekula të huaja. Një klasë e molekulave jo-vetë quhen antigjene (të shkurtër për anti trup eratorët gen) dhe janë të përcaktuara si substanca që lidh në specifike receptoreve imune dhe të nxjerr një përgjigje imune.[7]
Foshnjat e porsalindura nuk kanë ekspozim paraprak ndaj mikrobeve dhe janë veçanërisht të prekshëm nga infeksioni. Disa shtresa të mbrojtjes pasive sigurohen nga nëna. Gjatë shtatëzanisë, një lloj i veçantë i antitrupave, i quajtur IgG, transportohet nga nëna tek fëmija direkt përmes placentës, kështu që foshnjat njerëzore kanë nivele të larta të antitrupave edhe gjatë lindjes, me të njëjtën gamë të specifikave të antigjenit si nëna e tyre[8] Qumështi i gjirit ose kolostrum gjithashtu përmbajnë antitrupa që transferohen në zorrë të foshnjës dhe mbrojnë nga infeksionet bakteriale derisa i porsalinduri të sintetizojë antitrupat e vet.[9] Ky është imunitet pasiv sepse fetusi nuk krijon asnjë qelizë kujtese ose antitrupa - ai vetëm i merr hua. Ky imunitet pasiv është zakonisht afatshkurtër, që zgjat nga disa ditë deri në disa muaj. Në mjekësi, imuniteti mbrojtës pasiv gjithashtu mund të transferohet artificialisht nga një individ në tjetrin përmes serumit të pasur me antitrupa.[10]
Mikroorganizmat ose toksinat që hyjnë me sukses në një organizëm, ndeshin qelizat dhe mekanizmat e sistemit imunitar të lindur. Përgjigja e lindur zakonisht shkaktohet kur mikrobet identifikohen nga receptorët e njohjes së modelit, të cilët njohin përbërës që ruhen midis grupeve të gjera të mikroorganizmave,[11] ose kur qelizat e dëmtuara, të dëmtuara ose të stresuara dërgojnë sinjale alarmi, shumë prej të cilave (por jo të gjitha ) njihen nga të njëjtët receptorë si ata që njohin patogjenët. [12] Mbrojtja imune e lindur është jo specifike, domethënë këto sisteme reagojnë ndaj patogjenëve në një mënyrë gjenerike. [7] Ky sistem nuk jep imunitet të qëndrueshëm ndaj një patogjeni. Sistemi imunitar i lindur është sistemi mbizotërues i mbrojtjes së nikoqirit në shumicën e organizmave. [3]
Qelizat në sistemin imunitar të lindur përdorin receptorë të njohjes së modelit (PRR) për të njohur strukturat molekulare që prodhohen nga patogjenët mikrobikë. PRR janë sensorë të hostit të koduar nga germin, të cilat zbulojnë molekula tipike për patogjenët.[13] Ato janë proteina të shprehura, kryesisht, nga qelizat e sistemit imunitar të lindur, siç janë qelizat dendritike, makrofagët, monocitet, neutrofilet dhe qelizat epiteliale, [14][15] për të identifikuar dy klasa të molekulave: modelet molekulare të lidhura patogjene (PAMPs), të cilat shoqërohen me patogjenë mikrobikë dhe modele molekulare të lidhura me dëmtimin (DAMPs), të cilat shoqërohen me përbërës të qelizave të hostit që lëshohen gjatë dëmtimit të qelizave ose vdekjes.
Njohja e modeleve molekulare patogjene ekstracelulare ose endosomale të lidhura me patogjenin (PAMPs) ndërmjetësohet nga proteina transmembrane të njohura si receptorë të ngjashëm me tarifat (TLR). [16] TLR-të ndajnë një motiv tipik strukturor, përsëritjet e pasura me Leucine (LRR), të cilat u japin atyre pamjen e tyre specifike dhe janë gjithashtu përgjegjës për funksionalitetin TLR. [17] Receptorët me një numër të madh u zbuluan për herë të parë në Drosophila dhe shkaktojnë sintezën dhe sekretimin e citokinave dhe aktivizimin e programeve të tjera të mbrojtjes së pritësit që janë të domosdoshme për përgjigjet imune të lindura ose adaptive. Deri më tani, dhjetë anëtarë funksionalë të familjes TLR janë përshkruar tek njerëzit.[18]
Qelizat në sistemin imunitar të lindur kanë receptorë të njohjes model që zbulojnë infeksionin ose dëmtimin e qelizave në citosol. Tri klasa kryesore të këtyre receptorëve citosolikë janë receptorë të ngjashëm me NOD, receptorë të ngjashëm me RIG (gjen i indukueshëm ndaj acidit retinoik) dhe sensorë të ADN citosolike.[19]
Inflammasomet janë komplekse multiproteinore (përbëhen nga një NLR, proteina adapter ASC, dhe molekula efektore pro-kasapazë-1) që formojnë si përgjigje ndaj PAMPs citosolike dhe DAMPs, funksioni i të cilave është gjenerimi i formave aktive të citokinave inflamatore IL-1β dhe IL-18. [20]
Disa barriera mbrojnë organizmat nga infeksioni, përfshirë barrierat mekanike, kimike dhe biologjike. Lëmuar cuticle e shumicës së gjetheve, i exoskeleton e insekteve, nga predha dhe membranat e depozituara jashtë vezëve, dhe lëkura janë shembuj të pengesave mekanike që janë vija e parë e mbrojtjes kundër infeksionit.[7] Sidoqoftë, pasi organizmat nuk mund të vulosen plotësisht nga mjediset e tyre, sistemet e tjera veprojnë për të mbrojtur hapjet e trupit siç janë mushkëritë, zorrët dhe trakti gjenitourinar . Në mushkëri, kollitja dhe teshtitja mekanike nxjerr patogjenë dhe irritues të tjerë nga trakti respirator . Veprimi i rrjedhjes së lotëve dhe urinës gjithashtu mekanikisht largon patogjenët, ndërsa mukozat e sekretuara nga trakti respirator dhe gastrointestinal shërben për të bllokuar dhe ngatërruar mikroorganizmat. [21]
Barrierat kimike mbrojnë gjithashtu kundër infeksionit. Lëkura dhe trakti respirator sekretojnë peptide antimikrobikë si β- defensins.[22] Enzimat si lizozima dhe fosfolipaza A2 në pështymë, lotët dhe qumështin e gjirit janë gjithashtu antitrupa.[23][24] Sekretet vaginale shërbejnë si një pengesë kimike pas menarkes, kur ato bëhen pak acide, ndërsa sperma përmban defensins dhe zink për të vrarë patogjenët.[25][26] Në stomak, acidi i stomakut shërben si një mbrojtje e fuqishme kimike kundër patogjenëve të gëlltitur. [27]
Brenda traktit gjenitourinar dhe gastrointestinal, flora kommenale shërben si barriera biologjike duke garuar me baktere patogjene për ushqim dhe hapësirë dhe, në disa raste, duke ndryshuar kushtet në mjedisin e tyre, siç është pH ose hekuri i disponueshëm.[28] Si rezultat i marrëdhënies simbiotike midis commensals dhe sistemit imunitar, zvogëlohet mundësia që patogjenët të arrijnë numra të mjaftueshëm për të shkaktuar sëmundje. Sidoqoftë, pasi që shumica e antibiotikëve baktere jo-specifike synojnë dhe nuk ndikojnë në kërpudhat, antibiotikët oral mund të çojnë në një "rritje të madhe" të kërpudhave dhe të shkaktojnë kushte të tilla si një kandidaturë vaginale (një infeksion maja).[29] Ekzistojnë dëshmi të mira që rivendosja e florës probiotike, siç janë kulturat e pastra të laktobacileve që gjenden normalisht në kosin e pa pastruar, ndihmon në rivendosjen e një ekuilibri të shëndetshëm të popullsisë mikrobike në infeksionet e zorrëve tek fëmijët dhe inkurajimin e të dhënave paraprake në studimet mbi gastroenteritin bakterial, zorrën inflamatore sëmundjet, infeksioni i traktit urinar dhe infeksionet post-kirurgjikale .[30][31][32]

Leukocitet (qelizat e bardha të gjakut) veprojnë si organizma të pavarur, njëqelizorë dhe janë krahu i dytë i sistemit imunitar të lindur. [7] Leukocitet e lindura përfshijnë fagocitet ( makrofagët, neutrofilet dhe qelizat dendritike ), qelizat limfoide të lindura, qelizat master, eozinofilet, bazofilet dhe qelizat natyrore vrasëse . Këto qeliza identifikojnë dhe eliminojnë patogjenët, qoftë duke sulmuar patogjenë më të mëdhenj përmes kontaktit ose duke përfshirë dhe duke vrarë mikroorganizma.[33] Qelizat e lindura janë gjithashtu ndërmjetës të rëndësishëm në zhvillimin e organeve limfoide dhe aktivizimin e sistemit imunitar adaptues. [34]
Fagocitoza është një veçori e rëndësishme e imunitetit qelizor lindor të kryer nga qelizat e quajtura fagocitet që gllabërojnë, ose hanë, patogjenë ose grimca. Fagocitet në përgjithësi patrullojnë trupin në kërkim të patogjenëve, por mund të thirren në vende specifike nga citokinat.[7]Sapo një patogjen të jetë përfshirë nga fagociti, ai bëhet i bllokuar në një vezulë ndërqelizore të quajtur fagosome, e cila më pas bashkohet me një vezikul tjetër të quajtur lizozome për të formuar një fagolizozome . Patogjeni vritet nga aktiviteti i enzimave tretëse ose pas një shpërthimi të frymëmarrjes që lëshon radikalet e lira në fagolizozom.[35][36] Fagocitoza evoluoi si një mjet për të përvetësuar lëndët ushqyese, por ky rol u shtri në fagocitet për të përfshirë përfshirjen e patogjenëve si një mekanizëm mbrojtës. [37] Fagocitoza ndoshta paraqet formën më të vjetër të mbrojtjes së hostit, pasi fagocitet janë identifikuar në të dy kafshët vertebrorë dhe jovertebrorë. [38]
Neutrofilet dhe makrofagët janë fagocitet që udhëtojnë nëpër të gjithë trupin në ndjekje të patogjenëve pushtues. [39] Neutrofilet normalisht gjenden në rrjedhën e gjakut dhe janë lloji më i bollshëm i fagociteve, që përfaqësojnë normalisht 50% deri 60% të leukociteve totale që qarkullojnë, [40] dhe që përbëhen nga nënpopullime neutrofile-vrasëse dhe neutrofile-cager. Gjatë fazës akute të inflamacionit, veçanërisht si rezultat i infeksionit bakterial, neutrofilet migrojnë drejt vendit të inflamacionit në një proces të quajtur kemotaksë, dhe zakonisht janë qelizat e para që arrijnë në skenën e infeksionit. Makrofagët janë qeliza të gjithanshme që banojnë brenda indeve dhe prodhojnë një grup të gjerë të kimikateve përfshirë enzima, proteina plotësuese dhe citokina, ndërsa ato gjithashtu mund të veprojnë si pastrues që heqin trupin nga qelizat e lodhura dhe mbeturinat e tjera, dhe si qeliza antigjene që paraqesin që aktivizojnë sistemin imunitar adaptues.[41]
Qelizat dendritike (DC) janë fagocitet në indet që janë në kontakt me mjedisin e jashtëm; prandaj, ato janë të vendosura kryesisht në lëkurë, hundë, mushkëri, stomak dhe zorrë. [42] Ata janë emëruar për ngjashmërinë e tyre me dendritët neuronal, pasi që të dy kanë shumë projeksione të ngjashme me shpinë, por qelizat dendritike nuk janë në asnjë mënyrë të lidhura me sistemin nervor . Qelizat dendritike shërbejnë si një lidhje midis indeve trupore dhe sistemit imunitar të lindur dhe adaptues, pasi ato paraqesin antigjene në qelizat T, një nga llojet kryesore të qelizave të sistemit imunitar adaptiv.[42]
Granulocitet janë leukocite që kanë granula në citoplazmën e tyre. Në këtë kategori janë neutrofilet, qelizat master, bazofilet dhe eozinofilet. Qelizat mastikë banojnë në indet lidhës dhe mukozën, dhe rregullojnë përgjigjen inflamatore.[43] Ato më shpesh shoqërohen me alergji dhe anafilaksi.[40] Bazofilet dhe eozinofilet lidhen me neutrofilet. Ata sekretojnë ndërmjetësues kimikë që janë të përfshirë në mbrojtjen kundër parazitëve dhe luajnë një rol në reaksionet alergjike, siç është astma . [44]
Qelizat limfoide të lindura (ILC) janë një grup qelizash imune të lindura që rrjedhin nga progresi i zakonshëm limfoide (CLP) dhe i përkasin vijës limfoide . Këto qeliza përcaktohen nga mungesa e receptorit të qelizave B ose T të veçantë të antigjenit për shkak të mungesës së gjenit aktivizues të rekombinimit (RAG). ILC nuk shprehin shënuesit e qelizave mieloide ose dendritike.[45]
Qelizat vrasëse natyrore, një nga ILC-të anëtare, janë limfocitet dhe një përbërës i sistemit imunitar të lindur i cili nuk sulmon drejtpërdrejt mikrobet pushtuese.[46] Përkundrazi, qelizat NK shkatërrojnë qelizat pritëse të kompromentuara, të tilla si qelizat e tumorit ose qelizat e infektuara nga virusi, duke njohur qelizat e tilla nga një gjendje e njohur si "vetja që mungon". Ky term përshkruan qelizat me nivele të ulëta të një shënuesi të sipërfaqes qelizore të quajtur MHC I ( kompleksi kryesor i histokompatibilitetit ) - një situatë që mund të lindë në infeksione virale të qelizave pritëse.[33] Ata u emëruan "vrasës natyral" për shkak të nocionit fillestar se ata nuk kërkojnë aktivizim në mënyrë që të vrasin qelizat që janë "të humbur vetë". Për shumë vite ishte e paqartë se si qelizat NK njohin qelizat e tumorit dhe qelizat e infektuara. Tashmë dihet që përbërja MHC në sipërfaqen e atyre qelizave është ndryshuar dhe qelizat NK aktivizohen përmes njohjes së "vetvetes që mungon". Qelizat normale të trupit nuk njihen dhe sulmohen nga qelizat NK, sepse ato shprehin antigjene MHC të paprekshëm. Ato antigjene MHC njihen nga receptorët e imunoglobulinave të qelizave vrasëse (KIR) të cilat në thelb i vendosin frenat në qelizat NK. [47]
Inflamacioni është një nga përgjigjet e para të sistemit imunitar ndaj infeksionit. [48] Simptomat e inflamacionit janë skuqja, ënjtja, nxehtësia dhe dhimbja, të cilat janë shkaktuar nga rritja e rrjedhjes së gjakut në inde. Inflamacioni prodhohet nga eikosanoidet dhe citokinat, të cilat lëshohen nga qelizat e dëmtuara ose të infektuara. Eikosanoidet përfshijnë prostaglandinat që prodhojnë ethe dhe dilatimin e enëve të gjakut të shoqëruara me inflamacion, dhe leukotrienet që tërheqin qeliza të caktuara të bardha të gjakut (leukocitet).[49][50] Citokinat e zakonshëm përfshijnë interleukinat që janë përgjegjës për komunikimin midis qelizave të bardha të gjakut; kemokinat që promovojnë kemotaksën ; dhe interferonët që kanë efekte anti-virale, siç është mbyllja e sintezës së proteinave në qelizën pritëse.[51] Faktorët e rritjes dhe faktorët citotoksikë gjithashtu mund të lëshohen. Këto citokina dhe kimikate të tjera rekrutojnë qelizat imune në vendin e infeksionit dhe promovojnë shërimin e çdo indi të dëmtuar pas heqjes së patogjenëve. [52]
Sistemi plotësues është një kaskadë biokimike që sulmon sipërfaqet e qelizave të huaja. Ai përmban mbi 20 proteina të ndryshme dhe është emëruar për aftësinë e tij për të "komplementuar" vrasjen e patogjenëve nga antitrupat . Komplementi është përbërësi kryesor humor i përgjigjes imune të lindur.[53][54] Shumë specie kanë sisteme plotësuese, duke përfshirë jo- gjitarë si bimë, peshq dhe disa jovertebrorë . [33]
Tek njerëzit, kjo përgjigje aktivizohet duke u lidhur me plotësimin e antitrupave që i janë bashkangjitur këtyre mikrobeve ose nga lidhja e proteinave plotësuese për karbohidratet në sipërfaqet e mikrobeve . Ky sinjal njohjeje shkakton një reagim të shpejtë të vrasjes.[55] Shpejtësia e përgjigjes është rezultat i amplifikimit të sinjalit që ndodh pas aktivizimit vijues proteolitik të molekulave komplementare, të cilat janë edhe proteaza. Pasi proteinat plotësuese fillimisht lidhen me mikrobin, ato aktivizojnë aktivitetin e tyre të proteazës, e cila nga ana tjetër aktivizon proteazat e tjera plotësuese, etj. Kjo prodhon një kaskadë katalitike që përforcon sinjalin fillestar përmes reagimeve të kontrolluara pozitive .[56] Kaskada rezulton në prodhimin e peptideve që tërheqin qelizat imune, rrisin përshkueshmërinë vaskulare dhe opsonizojnë (shtresën) sipërfaqen e një patogjeni, duke e shënuar atë për shkatërrim. Ky depozitim i komplementit gjithashtu mund të vrasë qelizat drejtpërdrejt duke prishur membranën e tyre plazmatike .[53]
Sistemi imunitar adaptues evoluoi në vertebrorët e hershëm dhe lejon një reagim më të fortë imunitar, si dhe memorie imunologjike, ku çdo patogjen "mbahet mend" nga një antigjen nënshkrimi. [57] Përgjigja imunitare adaptive është specifike ndaj antigjenit dhe kërkon njohjen e antigjeneve specifikë "jo-vetë" gjatë një procesi të quajtur prezantim i antigjenit. Specifikimi i antigjenit lejon gjenerimin e përgjigjeve që janë përshtatur ndaj patogjenëve specifikë ose qelizave të infektuara nga patogjeni. Aftësia për të montuar këto përgjigje të përshtatura ruhet në trup nga "qelizat e kujtesës". Nëse një patogjen infekton trupin më shumë se një herë, këto qeliza të veçanta të kujtesës përdoren për ta eliminuar shpejt atë.
Qelizat e sistemit imunitar adaptues janë lloje të veçanta të leukociteve, të quajtura limfocitet. Qelizat B dhe qelizat T janë llojet kryesore të limfociteve dhe rrjedhin nga qelizat burimore hematopoietike në palcën e eshtrave .[33] Qelizat B janë të përfshira në reagimin imunitar humor, ndërsa qelizat T janë të përfshira në reagimin imunitar të ndërmjetësuar nga qelizat .
Qelizat T Vrasës njohin vetëm antigjenet e shoqëruar me molekulat MHC të Klasit I, ndërsa qelizat ndihmëse T dhe qelizat rregulluese T njohin vetëm antigjenet e shoqëruar me molekulat MHC të Klasës II . Këto dy mekanizma të paraqitjes së antigjenit pasqyrojnë rolet e ndryshme të dy llojeve të qelizës T. Një nën-tip i tretë, i vogël janë qelizat γδ T që njohin antigjenet e paprekur që nuk janë të lidhur me receptorët MHC.[58] Qelizat T pozitive të dyfishta janë të ekspozuara ndaj një larmi të vetë-antigjeneve në timus, në të cilin jodi është i domosdoshëm për zhvillimin dhe aktivitetin e tij të timusit. [59]
Në të kundërt, receptori specifik i antigjenit në qelizën B është një molekulë antitrupi në sipërfaqen e qelizës B dhe njeh patogjenë të tërë pa ndonjë nevojë për përpunim të antigjenit. Secila prejardhje e qelizës B shpreh një antitrup të ndryshëm, kështu që grupi i plotë i receptorëve të antigjenit të qelizës B përfaqësojnë të gjitha antitrupat që trupi mund të prodhojë.[33]
Të dy qelizat B dhe qelizat T mbajnë molekula të receptorit që njohin caqe specifike. Qelizat T njohin një objektiv "jo vetë", siç është një patogjen, vetëm pasi antigjenet (fragmente të vogla të patogjenit) të jenë përpunuar dhe paraqitur në kombinim me një receptor "vetë" të quajtur një molekulë kryesore komplekse histokompatibiliteti (MHC).
Ekzistojnë dy nëntipe të mëdha të qelizave T: qeliza T vrasëse dhe qeliza T ndihmëse . Për më tepër, ekzistojnë qeliza T rregulluese të cilat kanë një rol në modulimin e përgjigjes imune.
Qelizat T Vrasës janë një nën-grup i qelizave T që vrasin qelizat që janë të infektuar me viruse (dhe patogjenë të tjerë), ose dëmtohen ndryshe ose jofunksional. [60] Ashtu si me qelizat B, çdo lloj qelizë T njeh një antigjen të ndryshëm. Qelizat T Vrasës aktivizohen kur receptori i tyre i qelizës T (TCR) lidhet me këtë antigjen specifik në një kompleks me receptorin MHC Class I të një qelize tjetër. Njohja e këtij kompleksi antigjen MHC: ndihmohet nga një bashkëpranimues në qelizën T, i quajtur CD8 . Qeliza T më pas udhëton në të gjithë trupin në kërkim të qelizave ku receptorët MHC I mbajnë këtë antigjen. Kur një qelizë e aktivizuar T kontakton qelizat e tilla, ajo lëshon citotoksina, të tilla si perforin, të cilat formojnë poret në membranën plazmatike të qelizës së synuar, duke lejuar që jonet, uji dhe toksinat të hyjnë. Hyrja e një toksine tjetër të quajtur granulysin (një proteazë) bën që qeliza e synuar t’i nënshtrohet apoptozës .[61] Vrasja e qelizave T të qelizave pritëse është veçanërisht e rëndësishme në parandalimin e përsëritjes së viruseve. Aktivizimi i qelizave T kontrollohet fort dhe në përgjithësi kërkon një sinjal shumë të fortë të aktivizimit të MHC / antigjenit, ose sinjale shtesë të aktivizimit të dhëna nga qelizat T "ndihmëse" (shiko më poshtë). [61]

Qelizat Helper T rregullojnë si përgjigjet imune të lindura ashtu dhe ato adaptive dhe ndihmojnë në përcaktimin se cilat reagime imune i bën trupi një patogjeni të veçantë [62][63] Këto qeliza nuk kanë aktivitet citotoksik dhe nuk vrasin qelizat e infektuara ose patogjenë të pastër drejtpërdrejt. Në vend të kësaj ata kontrollojnë përgjigjen imune duke drejtuar qelizat e tjera për të kryer këto detyra.
Qelizat Helper T shprehin receptorë të qelizave T (TCR) që njohin antigjen të lidhur me molekulat MHC të Klasës II. Kompleksi antigjen MHC: njihet gjithashtu nga bashkë-receptori CD4 i qelizës ndihmëse, i cili rekruton molekula brenda qelizës T (p.sh., Lck ) që janë përgjegjës për aktivizimin e qelizës T. Qelizat Helper T kanë një lidhje më të dobët me MHC: kompleksi antigjen sesa vërehet për qelizat T vrasëse, që do të thotë shumë receptorë (rreth 200–300) në qelizën T ndihmëse duhet të jenë të lidhur nga një MHC: antigjen me qëllim aktivizimin e qelizës ndihmëse, ndërsa qelizat T vrasëse mund të aktivizohen me angazhimin e një MHC të vetme: molekulë antigjeni. Aktivizimi i qelizave T ndimëse gjithashtu kërkon kohëzgjatje më të gjatë të angazhimit me një qelizë që paraqet antigjen.[64] Aktivizimi i një qelize T ndihmëse të pushimit bën që ajo të lëshojë citokina që ndikojnë në aktivitetin e shumë llojeve të qelizave. Sinjalet e citokinës të prodhuara nga qelizat T ndihmëse rrisin funksionin mikrobicid të makrofagëve dhe aktivitetin e qelizave T vrasëse. [7] Për më tepër, aktivizimi i qelizave ndihmëse T shkakton një rregullim të molekulave të shprehura në sipërfaqen e qelizës T, siç është lidhja CD40 (e quajtur edhe CD154 ), të cilat ofrojnë sinjale shtesë stimuluese që zakonisht kërkohen për të aktivizuar qelizat B që prodhojnë antitrupa.[65]
Qelizat T delta gamma ( qelizat γδ T) posedojnë një receptor alternative të qelizave T (TCR) në krahasim me qelizat T CD4 + dhe CD8 + (αβ) dhe ndajnë karakteristikat e qelizave T ndihmëse, qelizave T citotoksike dhe qelizave NK. Kushtet që prodhojnë përgjigje nga qelizat γδ T nuk janë kuptuar plotësisht. Ashtu si nën-grupet e tjera 'jokonvencionale' të qelizave T që mbajnë TCR të pandryshueshme, të tilla si CD1d, të kufizuara në qelizat T natyrore të vrasjes, qelizat γδ T shtrëngojnë kufirin midis imunitetit të lindur dhe adaptiv.[66] Nga njëra anë, qelizat γδ T janë një përbërës i imunitetit adaptues pasi rregullojnë gjenet TCR për të prodhuar diversitetin e receptorëve dhe gjithashtu mund të zhvillojnë një fenotip të kujtesës. Nga ana tjetër, nënsektet e ndryshme janë gjithashtu pjesë e sistemit imunitar të lindur, pasi receptorët TCR ose NK të kufizuar mund të përdoren si receptorë të njohjes së modelit . Për shembull, një numër i madh i qelizave njerëzore Vγ9 / Vδ2 T përgjigjen brenda orëve molekulave të zakonshëm të prodhuar nga mikrobet, dhe qelizat shumë të kufizuara Vδ1 + T në epitelinë i përgjigjen qelizave epiteliale të stresuar.[58]

Një qelizë B identifikon patogjenët kur antitrupat në sipërfaqen e saj lidhen me një antigjen specifik të huaj. [68] Ky kompleks antigjen / antitrupi merret nga qeliza B dhe përpunohet nga proteoliza në peptide. Qeliza B më pas shfaq këto peptide antigjene në molekulat e saj MHC të klasës II të sipërfaqes. Ky kombinim i MHC dhe antigjen tërheq një qelizë ndihmëse T që përputhet, e cila lëshon limfokinat dhe aktivizon qelizën B.[69] Ndërsa qeliza B e aktivizuar atëherë fillon të ndahet, pasardhësit e saj ( qelizat plazmatike ) sekretojnë miliona kopje të antitrupit që njeh këtë antigjen. Këto antitrupa qarkullojnë në plazmën e gjakut dhe në limfat, lidhen me patogjenët që shprehin antigjenin dhe i shënojnë ato për shkatërrim me anë të aktivizimit të komplementit ose për marrjen dhe shkatërrimin nga fagocitet. Antitrupat gjithashtu mund të neutralizojnë sfidat drejtpërdrejt, duke u lidhur me toksinat bakteriale ose duke ndërhyrë në receptorët që përdorin viruset dhe bakteret për të infektuar qelizat.[70]
Kur qelizat B dhe qelizat T aktivizohen dhe fillojnë të përsëriten, disa prej pasardhësve të tyre bëhen qeliza kujtese për jetëgjatësi. Gjatë gjithë jetës së një kafshe, këto qeliza të kujtesës kujtojnë çdo patogjen specifik të hasur dhe mund të japin një përgjigje të fortë nëse patogjeni zbulohet përsëri. Kjo është "adaptive" sepse ndodh gjatë jetës së një individi si një përshtatje ndaj infeksionit me atë patogjen dhe përgatit sistemin imunitar për sfidat në të ardhmen. Kujtesa imunologjike mund të jetë në formën e kujtesës pasive afatshkurtër ose memorjes aktive afatgjatë.

Sistemi imunitar është i përfshirë në shumë aspekte të rregullimit fiziologjik në trup. Sistemi imunitar bashkëvepron ngushtë me sistemet e tjera, siç janë sistemet endokrine [71][72] dhe ato nervore. [73][74][75] Sistemi imunitar gjithashtu luan një rol vendimtar në embryogenesis (zhvillimi i embrionit), si dhe në indeve riparimin dhe rigjenerimin .
Hormonet mund të veprojnë si imunomodulues, duke ndryshuar ndjeshmërinë e sistemit imunitar. Për shembull, hormonet e seksit femëror janë imunostimulatorë të njohur si të përgjigjeve imune adaptive [76] ashtu edhe të lindura.[77] Disa sëmundje autoimune, siç është eritematoza lupus, godasin gratë me preferencë, dhe fillimi i tyre shpesh përkon me pubertetin . Në të kundërt, hormonet e seksit mashkull si testosteroni duket se janë imunosupresivë . [78] Hormonet e tjera duket se rregullojnë sistemin imunitar gjithashtu, më së shumti prolaktina, hormoni i rritjes dhe vitamina D. [79][80]
Kur një qelizë T takon një patogjen të huaj, ajo zgjat një receptor të vitaminës D. Kjo është në thelb një pajisje sinjalizuese që lejon që qeliza T të lidhet me formën aktive të vitaminës D, kalcitriolin e hormoneve steroide. Qelizat T kanë një marrëdhënie simbiotike me vitaminën D. Jo vetëm që qeliza T zgjat një receptor të vitaminës D, në thelb duke kërkuar të lidhet me versionin e hormoneve steroide të vitaminës D, kalcitriolit, por T-qeliza shpreh gjenin CYP27B1, i cili është gjeni përgjegjës për shndërrimin e versionit para-hormonal të vitaminës D, kalcidiolit në versionin e hormoneve steroide, kalcitriol. Vetëm pasi të lidhen me kalcitriol, qelizat T mund të kryejnë funksionin e tyre të synuar. Qelizat e tjera të sistemit imunitar që dihet se shprehin CYP27B1 dhe kështu aktivizojnë kalcidiolin e vitaminës D, janë qeliza dendritike, keratinocitet dhe makrofagët .[81][82]
Supozohet se një rënie progresive e niveleve të hormoneve me moshën është pjesërisht përgjegjëse për përgjigjet e dobësuara imune në individët në plakje. [83] Në të kundërt, disa hormone rregullohen nga sistemi imunitar, veçanërisht aktiviteti i hormonit tiroide .[84] Rënia në lidhje me moshën në funksionin imunitar lidhet gjithashtu me uljen e niveleve të vitaminës D tek të moshuarit. Ndërsa njerëzit plaken, dy gjëra ndodhin që ndikojnë negativisht në nivelin e tyre të vitaminës D. Së pari, ata qëndrojnë brenda më shumë për shkak të uljes së niveleve të aktivitetit. Kjo do të thotë që ata marrin më pak diell dhe për këtë arsye prodhojnë më pak kolecalciferol përmes rrezatimit UVB . Së dyti, ndërsa një person plaket, lëkura bëhet më pak e aftë në prodhimin e vitaminës D.[85]
Sistemi imunitar ndikohet nga gjumi dhe pushimi, [86] dhe privimi i gjumit është i dëmshëm për funksionin imunitar. [87] Sythe komplekse të reagimeve që përfshijnë citokinat, të tilla si interleukin-1 dhe faktori i nekrozës së tumorit-α i prodhuar si përgjigje ndaj infeksionit, duket se gjithashtu luajnë një rol në rregullimin e gjumit të lëvizjes jo të shpejtë të syve ( REM ). [88] Kështu, përgjigjja imune ndaj infeksionit mund të rezultojë në ndryshime në ciklin e gjumit, duke përfshirë një rritje të gjumit me valë të ngadaltë në lidhje me gjumin REM. .[89]
Kur vuani nga privimi i gjumit, imunizimet aktive mund të kenë një efekt të zvogëluar dhe mund të rezultojnë në prodhim më të ulët të antitrupave, dhe një reagim imunitar më të ulët, sesa do të vërehej në një individ të mirë-pushuar. Për më tepër, proteina të tilla si NFIL3, të cilat janë treguar se ndërthuren ngushtë me diferencimin e qelizave T dhe ritmet tona cirkiane, mund të preken përmes shqetësimit të cikleve të lehta natyrore dhe të errëta përmes rasteve të privimit të gjumit, punës në ndërrim, etj. Si rezultat, këto ndërprerje mund të çojnë në një rritje të kushteve kronike siç janë sëmundja e zemrës, dhimbja kronike dhe astma.[90]
Përveç pasojave negative të privimit të gjumit, gjumi dhe sistemi i ndërthurur cirkadian janë treguar se kanë efekte rregullatore të forta në funksionet imunologjike që prekin si imunitetin e lindur ashtu edhe atë imun adaptiv. Së pari, gjatë fazës së hershme të gjumit të valës së ngadaltë, një rënie e papritur e nivelit të gjakut të kortizolit, epinefrinës dhe norepinefrinës shkakton rritjen e niveleve të gjakut të leptinës së hormoneve, hormonit të rritjes së hipofizës dhe prolaktinës. Këto sinjale shkaktojnë një gjendje pro-inflamatore përmes prodhimit të citokinave pro-inflamatore interleukin-1, interleukin-12, TNF-alfa dhe IFN-gamma . Këto citokinë më pas stimulojnë funksionet imune si aktivizimi i qelizave imune, përhapja dhe diferencimi. Shtë gjatë kësaj kohe që e padiferencuar, ose më pak e diferencuar, si qelizat T naive dhe të kujtesës qendrore, kulmin (d.m.th. gjatë një kohe të një reagimi imunitar adaptivisht ngadalë evoluues). Përveç këtyre efekteve, grupi i hormoneve të prodhuar në këtë kohë (leptina, hormoni i rritjes së hipofizës dhe prolaktina) mbështesin ndërveprimet midis APCs dhe qelizave T, një zhvendosje e ekuilibrit të citokinës T h 1 / T h 2 drejt asaj që mbështet T h 1, një rritje në e përgjithshëm të përhapjes së qelizave T h, dhe naive migrimin e qelizave T në nyjet limfatike. Ky mjedis gjithashtu mendohet të mbështesë formimin e kujtesës imunitare të zgjatur përmes fillimit të përgjigjeve imune Th1.[91]
Në të kundërt, gjatë periudhave të zgjimit qelizat e efektshme të diferencuara, siç janë qelizat vrasëse natyrale citotoksike dhe CTL (limfocitet T citotoksike), arrijnë kulmin në mënyrë që të nxisin një përgjigje efektive kundër çdo patogjen ndërhyrës. Si dhe gjatë kohëve të zgjuara aktive, molekulat anti-inflamatore, të tilla si kortizoli dhe katekolaminat, arrijnë kulmin. Ekzistojnë dy teori se pse gjendja pro-inflamatore rezervohet për kohën e gjumit. Së pari, inflamacioni do të shkaktonte dëmtime serioze njohëse dhe fizike nëse do të ndodhte gjatë kohës së zgjimit. Së dyti, inflamacioni mund të ndodhë gjatë kohërave të gjumit për shkak të pranisë së melatoninës . Inflamacioni shkakton një stres të madh oksidativ dhe prania e melatoninës gjatë kohërave të gjumit mund të kundërveprojë në mënyrë aktive prodhimin e radikalit të lirë gjatë kësaj kohe.[91][92]
Mbiushqyerja shoqërohet me sëmundje të tilla si diabeti dhe mbipesha, të cilat dihet se ndikojnë në funksionin imunitar. Kequshqyerja më e moderuar, si dhe mangësi të caktuara specifike minerale dhe ushqyese, gjithashtu mund të komprometojnë reagimin imunitar.[93]
Ushqimet e pasura me acide yndyrore të caktuara mund të nxisin një sistem të shëndetshëm imunitar. [94] Po kështu, nënvlerësimi i fetusit mund të shkaktojë një dëmtim të përjetshëm të sistemit imunitar. [95]
Sistemi imunitar, veçanërisht komponenti i lindur, luan një rol vendimtar në riparimin e indeve pas një fyerje. [96][97][98][99][100] Aktorët kryesorë përfshijnë makrofagët dhe neutrofilet, por aktorët e tjerë qelizorë, përfshirë qelizat γδ T, qelizat limfoide të lindura (ILC) dhe qelizat rregulluese T (Tregët) janë gjithashtu të rëndësishëm. Plasticiteti i qelizave imune dhe ekuilibri midis sinjaleve pro-inflamator dhe anti-inflamator janë aspekte thelbësore të riparimit efikas të indeve.[100] Përbërësit dhe rrugët imune janë të përfshirë në rigjenerimin, si për shembull në amfibë. Sipas një hipoteze, organizmat që mund të rigjenerohen mund të jenë më pak imunokompetent sesa organizmat që nuk mund të rigjenerohen.[101][102]
Sistemi imunitar është një strukturë jashtëzakonisht e efektshme që përfshin specifikën, induktueshmërinë dhe adaptimin. Dështimet e mbrojtjes së pritësit ndodhin, dhe bien në tre kategori të gjera: imunodeficiencat, autoimunitetin dhe mbindjeshmërinë.
Imunodeficiencat ndodhin kur një ose më shumë nga përbërësit e sistemit imunitar janë joaktiv. Aftësia e sistemit imunitar për t'iu përgjigjur patogjenëve zvogëlohet si tek të rinjtë ashtu edhe tek të moshuarit, imuniteti fillon të bie në moshën rreth 50 vjeç për shkak të imunozes .[103][104] Në vendet e zhvilluara, mbipesha, alkoolizmi dhe përdorimi i drogës janë shkaqe të zakonshme të funksionimit të dobët të imunitetit. [104] Sidoqoftë, kequshqyerja është shkaku më i zakonshëm i imunitetit në vendet në zhvillim . [104] Dietat që kanë mungesë të proteinave të mjaftueshme shoqërohen me imunitet të dëmtuar të ndërmjetësuar nga qelizat, aktivitetin e komplementit, funksionin e fagociteve, përqendrimet e antitrupave IgA dhe prodhimin e citokinës. Për më tepër, humbja e timusit në moshë të re përmes mutacionit gjenetik ose heqjes kirurgjikale sjell imunitet të rëndë dhe një ndjeshmëri të lartë ndaj infeksionit.[105]
Imuniteti i mangësive gjithashtu mund të trashëgohet ose ' fitohet' . [7] Sëmundja kronike granulomatoze, ku fagocitet kanë një aftësi të zvogëluar për të shkatërruar patogjenët, është një shembull i një imuniteti të trashëguar, ose kongjenital,. SIDA dhe disa lloje të kancerit shkaktojnë imunitet të fituar. [106][107]
Përgjigjet imunitare tepër aktive formojnë fundin tjetër të mosfunksionimit imunitar, veçanërisht çrregullimet autoimune . Këtu, sistemi imunitar nuk arrin të bëjë dallimin e duhur midis vetvetes dhe jo-vetvetes, dhe sulmon një pjesë të trupit. Në rrethana normale, shumë qeliza T dhe antitrupa reagojnë me peptide "vet".[108] Një nga funksionet e qelizave të specializuara (të vendosura në timus dhe palcën e eshtrave ) është paraqitja e limfociteve të reja me antigjene vetë të prodhuara në të gjithë trupin dhe eliminimi i atyre qelizave që njohin vetë-antigjenet, duke parandaluar autoimunitetin.[68]
Hipersensitiviteti është një përgjigje imune që dëmton indet e trupit. Ata janë të ndarë në katër klasa (Tipi I - IV) bazuar në mekanizmat e përfshirë dhe rrjedhën kohore të reaksionit mbindjesiv. Hipersensitiviteti i tipit I është një reagim i menjëhershëm ose anafilaktik, i shoqëruar shpesh me alergji . Simptomat mund të shkojnë nga siklet të butë deri në vdekje. Hipersensitiviteti i tipit I ndërmjetësohet nga IgE, e cila shkakton degranulimin e qelizave master dhe bazofileve kur ndërlidhen me antigjen.[109] Hipersensitiviteti i tipit II ndodh kur antitrupat lidhen me antigjenet në qelizat e vetë pacientit, duke i shënuar ato për shkatërrim. Kjo quhet gjithashtu mbindjeshmëri e varur nga antitrupat (ose citotoksik) dhe ndërmjetësohet nga antitrupat IgG dhe IgM .[109] Komplekset imune (grumbullime të antigjeneve, proteina plotësuese dhe antitrupa IgG dhe IgM) të depozituar në inde të ndryshme shkaktojnë reaksione të mbindjeshmërisë së tipit III. [109] Hipersensitiviteti i tipit IV (i njohur gjithashtu si hipersensitiviteti i tipit të ndërmjetësuar nga qeliza ose i vonuar ) zakonisht zgjat nga dy deri në tre ditë për tu zhvilluar. Reagimet e tipit IV janë të përfshira në shumë sëmundje autoimune dhe infektive, por mund të përfshijnë edhe dermatitin e kontaktit ( dredhinë e helmit ). Këto reagime ndërmjetësohen nga qelizat T, monocitet dhe makrofagët .[109]
Inflamacioni është një nga përgjigjet e para të sistemit imunitar ndaj infeksionit,[48] por mund të shfaqet pa ndonjë shkak të njohur.
Inflamacioni prodhohet nga eikosanoidet dhe citokinat, të cilat lëshohen nga qelizat e dëmtuara ose të infektuara. Eikosanoidet përfshijnë prostaglandinat që prodhojnë ethe dhe dilatimin e enëve të gjakut të shoqëruara me inflamacion, dhe leukotrienet që tërheqin qeliza të caktuara të bardha të gjakut (leukocitet).[49][50] Citokinat e zakonshëm përfshijnë interleukinat që janë përgjegjës për komunikimin midis qelizave të bardha të gjakut; kemokinat që promovojnë kemotaksën ; dhe interferonët që kanë efekte anti-virale, siç është mbyllja e sintezës së proteinave në qelizën pritëse..[51] Faktorët e rritjes dhe faktorët citotoksikë gjithashtu mund të lëshohen. Këto citokina dhe kimikate të tjera rekrutojnë qelizat imune në vendin e infeksionit dhe promovojnë shërimin e çdo indi të dëmtuar pas heqjes së patogjenëve. [52]
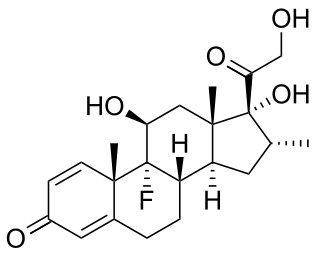
Reagimi imunitar mund të manipulohet për të shtypur përgjigjet e padëshiruara që vijnë nga autoimuniteti, alergjia dhe refuzimi i transplantit, dhe për të stimuluar përgjigjet mbrojtëse kundër patogjenëve që kryesisht largojnë sistemin imunitar (shiko imunizimin ) ose kancerin.
Drogat imunosupresive përdoren për të kontrolluar çrregullimet autoimune ose inflamacionin kur ndodh dëmtimi i tepërt i indeve dhe për të parandaluar refuzimin e transplantit pas një transplanti të organeve . [33][110]
Ilaçet anti-inflamatore shpesh përdoren për të kontrolluar efektet e inflamacionit. Glukokortikoidet janë më të fuqishmit nga këto ilaçe; megjithatë, këto ilaçe mund të kenë shumë efekte anësore të padëshirueshme, të tilla si obeziteti qendror, hiperglicemia, osteoporoza dhe përdorimi i tyre duhet të kontrollohet fort.[111] Dozat më të ulëta të ilaçeve anti-inflamatore shpesh përdoren në lidhje me ilaçet citotoksike ose imunosupresive si metotreksat ose azathioprine . Ilaçet citotoksike pengojnë reagimin imunitar duke vrarë qelizat ndarëse siç janë qelizat T të aktivizuara. Sidoqoftë, vrasja është diskriminuese dhe qelizat e tjera që ndahen vazhdimisht dhe organet e tyre preken, gjë që shkakton efekte anësore toksike.[110] Ilaçet shtypëse imunosupresive si ciklosporina parandalojnë që qelizat T t’i përgjigjen saktë sinjaleve duke penguar rrugët e transduksionit të sinjalit . [112]
Imunoterapia e kancerit mbulon mënyrat mjekësore për të stimuluar sistemin imunitar për të sulmuar tumoret e kancerit.
Kujtesa aktive afatgjatë fitohet pas infeksionit nga aktivizimi i qelizave B dhe T. Imuniteti aktiv gjithashtu mund të gjenerohet artificialisht, përmes vaksinimit . Parimi pas vaksinimit (i quajtur edhe imunizim ) është të futni një antigjen nga një patogjen në mënyrë që të stimuloni sistemin imunitar dhe të zhvilloni imunitet specifik kundër këtij patogjeni të veçantë pa shkaktuar sëmundje të lidhur me atë organizëm.[7] Ky induksion i qëllimshëm i një përgjigje imune është i suksesshëm sepse shfrytëzon specifikimin natyror të sistemit imunitar, si dhe indukueshmërinë e tij. Me sëmundjen infektive që mbetet një nga shkaqet kryesore të vdekjes në popullatën njerëzore, vaksinimi paraqet manipulimin më efektiv të sistemit imunitar që njerëzimi ka zhvilluar. [33][113]
Shumica e vaksinave virale bazohen në viruse të dobësuara të gjalla, ndërsa shumë vaksina bakteriale bazohen në përbërës acellular të mikroorganizmave, duke përfshirë përbërësit e toksinave të padëmshëm. [7] Meqenëse shumë antigjenë që rrjedhin nga vaksinat acelulare nuk shkaktojnë forcë përgjigjen adaptive, shumica e vaksinave bakteriale sigurohen me ndihmës shtesë që aktivizojnë qelizat antigjene të sistemit imunitar të lindur dhe maksimizojnë imunogjenitetin .[114]

Një tjetër rol i rëndësishëm i sistemit imunitar është identifikimi dhe eliminimi i tumoreve . Kjo quhet mbikëqyrje imune . Qelizat e transformuara të tumoreve shprehin antigjene që nuk gjenden në qelizat normale. Për sistemin imunitar, këto antigjene shfaqen të huaj, dhe prania e tyre bën që qelizat imune të sulmojnë qelizat e transformuara të tumorit. Antigjenet e shprehur nga tumoret kanë disa burime;[116] disa prej tyre rrjedhin nga viruse onkogjene si papillomavirus njerëzor, i cili shkakton kancer të qafës së mitrës [117],vulvë, vaginë, penis, anus, gojë dhe fyt, [118]ndërsa të tjerët janë vetë proteinat e organizmit që ndodhin në nivele të ulëta nivele në qelizat normale por arrijnë nivele të larta në qelizat tumorale. Një shembull është një enzimë e quajtur tirozinaza që, kur shprehet në nivele të larta, shndërron qelizat e caktuara të lëkurës (p.sh. melanocitet ) në tumore të quajtura melanoma .[119][120] Një burim i tretë i mundshëm i antigjeneve të tumorit janë proteina që janë normalisht të rëndësishme për rregullimin e rritjes dhe mbijetesës së qelizave, që zakonisht mutatojnë në molekula që shkaktojnë kancer, të quajtura onkogjene . [116][121][122]
Përgjigja kryesore e sistemit imunitar ndaj tumoreve është shkatërrimi i qelizave anormale duke përdorur qelizat T vrasëse, ndonjëherë me ndihmën e qelizave ndihmëse T. [120][123] Antigjenet e tumorit paraqiten në molekulat e klasës I të MHC në një mënyrë të ngjashme me antigjenet virale. Kjo lejon që qelizat T vrasëse të njohin qelizën e tumorit si anormale. [124] Qelizat NK gjithashtu vrasin qelizat tumorale në një mënyrë të ngjashme, veçanërisht nëse qelizat e tumorit kanë më pak molekula MHC të klasës I në sipërfaqen e tyre sesa normalja; ky është një fenomen i zakonshëm me tumoret. [125] Ndonjëherë antitrupat gjenerohen kundër qelizave të tumorit që lejojnë shkatërrimin e tyre nga sistemi plotësues . [121]
Çështë e qartë se disa tumore i shmangen sistemit imunitar dhe vazhdojnë të bëhen kancere. [126][127] Qelizat tumore shpesh kanë një numër të zvogëluar të molekulave MHC të klasës I në sipërfaqen e tyre, duke shmangur kështu zbulimin nga qelizat T vrasëse. [124][126] Disa qeliza tumore lëshojnë gjithashtu produkte që pengojnë përgjigjen imune; për shembull duke sekretuar citokinën TGF-β, e cila shtyp aktivitetin e makrofagëve dhe limfociteve . [126][128]Përveç kësaj, toleranca imunologjike mund të zhvillohet kundër antigjeneve të tumorit, kështu që sistemi imunitar nuk sulmon më qelizat e tumorit. [126][127]
Paradoksalisht, makrofagët mund të promovojnë rritjen e tumorit [129] kur qelizat e tumorit dërgojnë citokina që tërheqin makrofagët, të cilët më pas gjenerojnë citokina dhe faktorë të rritjes siç janë faktori i nekrozës tumorale alfa që ushqejnë zhvillimin e tumorit ose promovojnë plasticitetin e qelizave burimore.[126] Për më tepër, një kombinim i hipoksisë në tumor dhe një citokine e prodhuar nga makrofagët bën që qelizat e tumorit të ulin prodhimin e një proteine që bllokon metastazën dhe në këtë mënyrë ndihmon përhapjen e qelizave kancerogjene. [126]
Drogat më të mëdha (> 500 Da ) mund të provokojnë një reagim imunizues neutralizues, veçanërisht nëse ilaçet administrohen në mënyrë të përsëritur, ose në doza më të mëdha. Kjo kufizon efektivitetin e barnave bazuar në peptide dhe proteina më të mëdha (të cilat zakonisht janë më të mëdha se 6000 Da). Në disa raste, ilaçi në vetvete nuk është imunogjen, por mund të bashkë-administrohet me një përbërës imunogjenik, siç ndodh ndonjëherë me taksolin . Metodë llogaritëse janë zhvilluar për të parashikuar imunogjenitetin e peptideve dhe proteinave, të cilat janë veçanërisht të dobishme në hartimin e antitrupave terapeutik, vlerësimin e virulencës së mundshme të mutacioneve në grimcat e shtresës virale, si dhe vlefshmërinë e trajtimeve të propozuara me bazë peptidesh. Teknikat e hershme mbështeteshin kryesisht në vëzhgimin se aminoacidet hidrofile janë të mbingarkuara në rajonet epitopë sesa aminoacidet hidrofobike ;[130] megjithatë, zhvillimet më të fundit mbështeten në teknikat e mësimit të makinerive duke përdorur bazën e të dhënave të epitopeve ekzistuese të njohura, zakonisht në proteinat e virusit të studiuar mirë, si një grup trajnimi .[131] Ashtë krijuar një bazë e të dhënave të arritshme publikisht për katalogimin e epitopeve nga patogjenët që dihet të njihen nga qelizat B. [132] Fusha në zhvillim e studimeve të bazuara në bioinformatikë të imunogjenitetit quhet imunoinformatikë . [133] Imunoproteomika është studimi i grupeve të mëdha të proteinave ( proteomics ) të përfshira në reagimin imunitar.
Është e mundshme që një sistem imunitar adaptues shumëkomponent, u ngrit me vertebrorët e parë, pasi jovertebrorët nuk gjenerojnë limfocitet ose një përgjigje humore të bazuar në antitrupa. [1] Sidoqoftë, shumë specie përdorin mekanizmat që duket se janë pararendës të këtyre aspekteve të imunitetit vertebror. Sistemet imune shfaqen edhe në format strukturore më të thjeshta të jetës, me baktere që përdorin një mekanizëm unik mbrojtës, të quajtur sistemi i modifikimit të kufizimit për të mbrojtur veten nga patogjenët viralë, të quajtur bakteriofagë.[134] Prokariotët gjithashtu posedojnë imunitet të fituar, përmes një sistemi që përdor sekuencat CRISPR për të ruajtur fragmente të gjenomit të fagut me të cilët kanë rënë në kontakt në të kaluarën, gjë që u lejon atyre të bllokojnë përsëritjen e virusit përmes një forme të ndërhyrjes ARN .[135][136] Prokariotët posedojnë edhe mekanizma të tjerë mbrojtës. [137][138] Elementet fyese të sistemit imunitar janë gjithashtu të pranishme në eukariotet njëqelizore, por studimet për rolet e tyre në mbrojtje janë të pakta. [139]
Receptorët e njohjes së modelit janë proteina të përdorura nga pothuajse të gjithë organizmat për të identifikuar molekulat që lidhen me patogjenët. Peptidet antimikrobikë të quajtur defensins janë një përbërës i ruajtur evolucionarisht i përgjigjes imune të lindur që gjendet në të gjitha kafshët dhe bimët, dhe përfaqësojnë formën kryesore të imunitetit sistematik jovertebror.[1] Sistemi i komplementit dhe qelizat fagocitike përdoren gjithashtu nga shumica e formave të jetës jovertebrore. Ribonukleazat dhe rruga e ndërhyrjes ARN janë të ruajtura në të gjithë eukariotët, dhe mendohet se luajnë një rol në reagimin imunitar ndaj viruseve.[140]
Për dallim nga kafshët, bimëve u mungojnë qelizat fagocitike, por shumë reagime imune të bimëve përfshijnë sinjale kimike sistemike që dërgohen përmes një bime. [141] Qelizat e bimëve individuale i përgjigjen molekulave të shoqëruara me patogjene të njohura si modele molekulare të lidhura me patogjenin ose PAMP. [142] Kur një pjesë e një bimë infektohet, bima prodhon një reagim të lokalizuar të mbindjeshëm, me anë të së cilit qelizat në vendin e infeksionit i nënshtrohen apoptozës së shpejtë për të parandaluar përhapjen e sëmundjes në pjesë të tjera të bimës. Rezistenca e fituar sistemike (SAR) është një lloj reagimi mbrojtës i përdorur nga bimët që e bëjnë tërë bimën rezistente ndaj një agjenti infektiv të veçantë.[141] Mekanizmat e heshtjes së ARN- së janë veçanërisht të rëndësishme në këtë reagim sistematik pasi ato mund të bllokojnë replikimin e virusit. [143]
Evolucioni i sistemit imunitar adaptues ndodhi në një paraardhës të vertebrorëve të nofullave. Shumë nga molekulat klasike të sistemit imunitar adaptues (p.sh., imunoglobulinat dhe receptorët e qelizave T ) ekzistojnë vetëm në vertebrorët e nofullës. Sidoqoftë, një molekulë e dallueshme e prirë nga limfocitet është zbuluar në vertebrat primitive pa nofulla, të tilla si llambra dhe rrushi . Këto kafshë posedojnë një grup të madh molekulash të quajtura Reciporë të ndryshueshëm limfocitet (VLR) që, ashtu si receptorët antigjenë të vertebrorëve të nofullës, prodhohen nga vetëm një numër i vogël (një ose dy) gjenesh . Këto molekula besohet se lidhin antigjene patogjene në një mënyrë të ngjashme me antitrupat, dhe me të njëjtën shkallë të specifikës..[144]
Suksesi i çdo patogjeni varet nga aftësia e tij për të shmangur përgjigjet imune të hostit. Prandaj, patogjenët evoluan disa metoda që i lejojnë ata të infektojnë me sukses një host, ndërsa shmangin zbulimin ose shkatërrimin nga sistemi imunitar.[145] Bakteret shpesh kapërcejnë pengesat fizike duke sekretuar enzima që tretin pengesën, për shembull, duke përdorur një sistem sekretimi të tipit II . [146] Përndryshe, duke përdorur një sistem sekretimi të tipit III, ata mund të futin një tub të uritur në qelizën pritëse, duke siguruar një rrugë të drejtpërdrejtë për proteinat që të lëvizin nga patogjeni në host. Këto proteina shpesh përdoren për të mbyllur mbrojtjen e hostit.[147]
Një strategji evazioni e përdorur nga disa patogjenë për të shmangur sistemin imunitar të lindur është të fshihet brenda qelizave të hostit të tyre (i quajtur edhe patogjenezë ndërqelizore ). Këtu, një patogjen kalon pjesën më të madhe të ciklit të tij jetësor brenda qelizave pritëse, ku mbrohet nga kontakti i drejtpërdrejtë me qelizat imune, antitrupat dhe plotësimin. Disa shembuj të patogjenëve ndërqelizorë përfshijnë viruse, bakterin helmues të ushqimit Salmonella dhe parazitët eukariotikë që shkaktojnë malarie ( Plasmodium falciparum ) dhe leishmaniasis ( Leishmania spp. ). Baktere të tjera, të tilla si Mycobacterium tuberculosis, jetojnë brenda një kapsulë mbrojtëse që parandalon lizën me anë të komplementit.[148] Shumë patogjenë sekretojnë përbërës që zvogëlojnë ose drejtojnë përgjigjen imune të hostit.[145] Disa baktere formojnë biofilma për të mbrojtur veten nga qelizat dhe proteinat e sistemit imunitar. Biofilma të tilla janë të pranishme në shumë infeksione të suksesshme, p.sh., infeksionet kronike Pseudomonas aeruginosa dhe Burkholderia cenocepacia karakteristike për fibrozën cistike .[149] Bakteret e tjera gjenerojnë proteina sipërfaqësore që lidhen me antitrupa, duke i bërë ato joefektive; shembuj përfshijnë Streptococcus (proteina G), Staphylococcus aureus (proteinë A) dhe Peptostreptococcus magnus (proteina L). [150]
Mekanizmat e përdorur për të shmangur sistemin imunitar adaptues janë më të ndërlikuara. Qasja më e thjeshtë është të ndryshoni me shpejtësi epitopet jo thelbësore ( aminoacidet dhe / ose sheqernat) në sipërfaqen e patogjenit, duke i mbajtur të fshehur epitopet thelbësore. Kjo quhet variacion antigjenik . Një shembull është HIV, i cili ndryshon me shpejtësi, kështu që proteinat në zarfin e saj viral që janë thelbësore për hyrjen në qelizën e saj pritëse të ndryshimit janë vazhdimisht. Këto ndryshime të shpeshta në antigjene mund të shpjegojnë dështimet e vaksinave të drejtuara ndaj këtij virusi..[151] Paraziti Trypanosoma brucei përdor një strategji të ngjashme, duke ndërprerë vazhdimisht një lloj proteine sipërfaqësore për një tjetër, duke e lejuar atë të qëndrojë një hap përpara përgjigjes së antitrupave. [152] Maskimi i antigjeneve me molekulat pritëse është një strategji tjetër e zakonshme për të shmangur zbulimin nga sistemi imunitar. Në HIV, zarfi që mbulon virionin formohet nga membrana më e jashtme e qelizës pritëse; viruse të tilla "të vetë-mbuluara" e bëjnë të vështirë për sistemin imunitar t'i identifikojë ato si struktura "jo-vetjake".[153]
Imunologjia është një shkencë që shqyrton strukturën dhe funksionin e sistemit imunitar. Ai buron nga mjekësia dhe studimet e hershme mbi shkaqet e imunitetit ndaj sëmundjeve. Referimi më i hershme i njohur për imunitetin ishte gjatë murtajës së Athinës në 430 para Krishtit. Thucydides vuri në dukje se njerëzit që ishin shëruar nga një periudhe e mëparshme e sëmundjes, mund të infermierin të sëmurin pa kontraktuar sëmundjen për herë të dytë.[154] Në shekullin e 18-të, Pierre-Louis Moreau de Maupertuis bëri eksperimente me helmin e akrepit dhe vëzhgoi se qentë dhe minjtë e caktuar ishin imunë ndaj këtij helmi.[155] Në shekullin e 10-të, mjeku persian al-Razi (i njohur edhe si Rhazes) shkroi teorinë e parë të regjistruar të imunitetit të fituar, [156][157]:6 duke vërejtur se një periudhë e madhe e LI mbronte të mbijetuarit e saj nga infeksionet e ardhshme. Megjithëse ai shpjegoi imunitetin në kuptimin e "lagështisë së tepërt" të dëbuar nga gjaku - prandaj parandalimin e sëmundjes të ndodhë për herë të dytë - kjo teori shpjegoi shumë vëzhgime në lidhje me LI të njohura gjatë kësaj kohe.[157]:7
Këto dhe vëzhgime të tjera të imunitetit të fituar u shfrytëzuan më vonë nga Louis Pasteur në zhvillimin e tij të vaksinimit dhe teorinë e tij të propozuar të mikrobit të sëmundjes . [158] Teoria e Pasteur ishte në kundërshtim të drejtpërdrejtë me teoritë bashkëkohore të sëmundjes, siç është teoria e miasma . Jo vetëm provat e Robert Koçit në 1891, për të cilat iu dha një çmim Nobel në 1905, që mikroorganizmat u konfirmuan si shkaku i sëmundjes infektive .[159] Viruset u konfirmuan si patogjene njerëzore në 1901, me zbulimin e virusit të etheve të verdha nga Walter Reed.[160]
Imunologjia bëri një përparim të madh drejt fundit të shekullit XIX, përmes zhvillimeve të shpejta, në studimin e imunitetit humor dhe imunitetit qelizor . [161] Veçanërisht e rëndësishme ishte puna e Paul Ehrlich, i cili propozoi teorinë e zinxhirit anësor për të shpjeguar specifikën e reagimit antigjen-antitrup ; kontributet e tij për të kuptuar imunitetin humoristik u njohën me dhënien e një çmimi Nobel në 1908, e cila u dha së bashku për themeluesin e imunologjisë qelizore, Elie Metchnikoff .[162]
Imunologjia është fuqimisht eksperimentale në praktikën e përditshme, por karakterizohet gjithashtu nga një qëndrim i vazhdueshëm teorik. Shumë teori janë sugjeruar në imunologji nga fundi i shekullit XIX e deri në kohën e sotme. Fundi i shekullit XIX dhe fillimi i shekullit të 20-të panë një betejë midis teorive "celulare" dhe "humorale" të imunitetit. Sipas teorisë celulare të imunitetit, të përfaqësuar në mënyrë të veçantë nga Elie Metchnikoff, ishin qelizat - më saktë, fagocitet - që ishin përgjegjëse për përgjigjet imune. Në të kundërt, teoria humore e imunitetit, e mbajtur, ndër të tjera, nga Robert Koç dhe Emil von Behring, deklaroi se agjentët aktivë të imunitetit ishin përbërës të tretshëm (molekula) që gjendeshin në "humorët" e organizmit sesa në qelizat e tij.[157][163][164]
Në mesin e viteve 1950, Frank Burnet, i frymëzuar nga një sugjerim i bërë nga Niels Jerne, [165] formuloi teorinë e përzgjedhjes klonale (CST) të imunitetit. [166] Në bazë të CST, Burnet zhvilloi një teori se si shkaktohet një përgjigje imunitare sipas dallimit të vetvetes / vetvetes: përbërësit e "vetvetes" (përbërësit e trupit) nuk shkaktojnë përgjigje shkatërruese imune, ndërsa "entet" vetjake (patogjene, etj.) një alograft) të shkaktojë një reagim shkatërrues imunitar. [167] Teoria u modifikua më vonë për të pasqyruar zbulime të reja në lidhje me histokompatibilitetin ose aktivizimin kompleks "dy-sinjal" të qelizave T. [168] Teoria e imunitetit për imunitetin dhe fjalorin e vetë / vetvetes janë kritikuar[164][169][170] por mbeten shumë ndikuese. [171][172]
Kohët e fundit, disa korniza teorike janë sugjeruar në imunologji, duke përfshirë edhe " autopoietic pikëpamjet", [173] "imune njohëse" Vështrimet, [174]e " modeli rreziku " (ose "teoria rrezik"), [169] dhe "shkëputje "teori. [175][176][177] Modeli i rrezikut, i sugjeruar nga Polly Matzinger dhe kolegët e tij, ka qenë shumë me ndikim, duke ngjallur shumë komente dhe diskutime. [178][179][180][181]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.