Лучшие вопросы
Таймлайн
Чат
Перспективы
Вода
химическое вещество, оксид водорода Из Википедии, свободной энциклопедии
Remove ads
Вода́ (в химии — монооксид водорода, гидроксид водорода; химическая формула — H2O) — химическое вещество, представляющее собой бинарное неорганическое соединение, молекула которого состоит из двух атомов водорода и одного атома кислорода, соединённых между собой ковалентной связью. Вода является продуктом горения (окисления) водорода при реакции с кислородом, но также может выступать конечным результатом и иных химических реакций, таких как горение углеводородов и других органических соединений.
Remove ads
При нормальных условиях вода представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. При переходе в твёрдое агрегатное состояние вода преобразуется в лёд (кристаллы льда могут образовывать снег или иней), а в газообразное — в водяной пар. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях)[8][9]. Она совершенно не токсична и безопасна для здоровья человека по причине стабильности вещества и негорючести воды (невосприимчивость к горению, наподобие углекислого газа).
Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии[10], возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Она является важнейшим веществом для всех живых существ на Земле[11]. В среднем, в организме растений и животных содержится более 50 % воды[12].
Всего на Земле около 1400 млн км³ воды; она покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн км²[13][14]). Бо́льшая часть земной воды (97,54 %) принадлежит Мировому океану — это солёная вода, непригодная для сельского хозяйства и питья. Пресная же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) — в реках и озёрах. Материковые солёные воды составляют 0,007 %, в атмосфере содержится 0,001 % от всей воды планеты Земля[15][16]. В составе мантии Земли воды содержится в 10—12 раз больше, чем в Мировом океане[17].
Вода — это одно из немногих веществ в природе, которые расширяются при переходе из жидкой фазы в твёрдую (кроме воды, таким свойством обладают сурьма[18], висмут, галлий, германий и некоторые соединения и смеси).
Remove ads
Этимология
В письменных источниках слово «вода» встречается ещё в «Изборнике Святослава» (1076 год)[19].
Слово происходит от др.-русск. вода, далее — от праславянского *voda[20] (ср. ст.-слав. вода, болг. вода́, сербохорв. во̀да, словен. vóda, чеш. voda, слвц. voda, польск. woda, в.-луж., н.-луж. woda), затем — от праиндоевропейского *wed-, родственного лит. vanduõ, жем. unduo, д.-в.-н. waʒʒar «вода», гот. watō, англ. water, греч. ὕδωρ, ὕδατος, арм. գետ «река», фриг. βέδυ, др.-инд. udakám, uda-, udán- «вода», unátti «бить ключом», «орошать», ṓdman- «поток», алб. uj «вода»[21][22]. Русские слова «ведро», «выдра» имеют тот же корень.
В рамках необщепринятой гипотезы о существовании некогда праностратического языка слово может сравниваться с гипотетическим прауральским *wete (ср., например, фин. vesi, эст. vesi, коми va, венг. víz), а также с предполагаемыми праалтайскими, прадравидийским и прочими словами, и реконструироваться как *wetV для праязыка[23].
Remove ads
Химические названия
С формальной точки зрения вода имеет несколько различных корректных химических названий:
- оксид водорода: бинарное соединение водорода с атомом кислорода в степени окисления −2, встречается также устаревшее название «окись водорода»;
- гидроксид водорода: соединение гидроксильной группы OH− и катиона (H+);
- гидроксильная кислота: воду можно рассматривать как соединение катиона H+, который может быть замещён металлом, и «гидроксильного остатка» OH−;
- монооксид дигидрогена;
- дигидромонооксид,
Remove ads
Свойства
Суммиров вкратце
Перспектива
Физические свойства
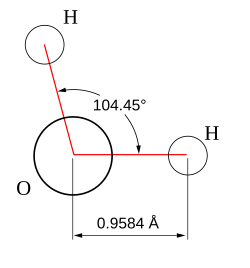
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, угол между ними 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте и диметилсульфоксиду). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[24].
Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[24]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °C, а замерзала при −100 °C[25].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один килограмм воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель.
Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
Физические свойства разных изотопных модификаций воды при различных температурах[26]:
Вода является хорошим растворителем веществ с молекулами, обладающими электрическим дипольным моментом. При растворении молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды важно для живых существ. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде[27]. Вода необходима для жизни всех без исключения живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности[уточнить].

Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, чем обусловлен нагрев пищевых продуктов в микроволновой печи.
Агрегатные состояния

По состоянию различают:
- «твёрдое» — лёд
- «жидкое» — вода
- «газообразное» — водяной пар

При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной.
С ростом давления температура кипения воды растёт[28]:
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Также вода может существовать в виде двух разных жидкостей («вторая вода» возникает при температуре около −70 °C и давлении в тысячи атмосфер), которые при определённых условиях даже не смешиваются друг с другом; гипотеза, что вода может существовать в двух различных жидких состояниях, была предложена примерно 30 лет назад на основе результатов компьютерного моделирования и экспериментально проверена только в 2020 году[29].
Удельная теплоёмкость
Эти данные можно аппроксимировать эмпирической формулой:
- [31].

Диэлектрическая проницаемость воды
Статическая (для постоянного электростатического поля) диэлектрическая проницаемость воды при разной абсолютной температуре при давлении 1 бар в диапазоне температур −13…100 °C выражается эмпирической формулой[33]:
Результаты вычислений по этой формуле[34]:
Электропроводность воды

При нормальных условиях очень чистая вода или Чистая вода имеет низкую электропроводность, так как слабо диссоциирована на ионы и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов OH− составляет 10−7 моль/л и представляет собой хороший изолятор. При повышении температуры электропроводность воды нарастает и приблизительно удваивается при увеличении температуры на каждые 10 °С.
Электропроводность чистой воды резко увеличивается при растворении в ней даже ничтожного количества вещества, подвергаемого электролитической диссоциации, например, поваренной соли. Поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные вещества, например, соли, то есть, в растворе присутствуют ионы. Поэтому обычная вода хорошо проводит электрический ток. По электропроводности воды можно определить её солесодержание.
Оптические свойства
Они оцениваются по прозрачности воды, которая, в свою очередь, зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5 % солнечных лучей, в то время как снег — около 85 %. Под лёд океана проникает только 2 % солнечного света[35][36].
Изотопные модификации
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
- лёгкая вода (основная составляющая привычной людям воды) ;
- тяжёлая вода (дейтериевая) ;
- сверхтяжёлая вода (тритиевая) ;
- тритий-дейтериевая вода ;
- тритий-протиевая вода ;
- дейтерий-протиевая вода .
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а. е. м., тритий — самый тяжёлый, атомная масса 3,0160492777 а. е. м. В воде из-под крана тяжелокислородной воды ( и ) содержится больше, чем воды : их содержание, соответственно, 1,8 кг и 0,15 кг на тонну[25].
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней[25].
По стабильным изотопам кислорода , и существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 разновидностей молекул воды. В действительности природная вода содержит все разновидности молекул.
Химические свойства
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Воду иногда рассматривают как амфолит — и кислоту и основание одновременно (катион H+ анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa = p(1,8⋅10−16) ≈ 15,74. Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Воду можно получать:
- В ходе реакций —
- В ходе реакций нейтрализации —
- Восстановлением водородом оксидов металлов —
Под воздействием очень высоких температур или электрического тока (при электролизе)[37], а также под воздействием ионизирующего излучения, как установил в 1902 году[38] Фридрих Гизель[англ.] при исследовании водного раствора бромида радия[39], вода разлагается на молекулярный кислород и молекулярный водород:
Вода реагирует при комнатной температуре:
- со фтором и межгалоидными соединениями
- (при низких температурах)
- с солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз
- с ангидридами и галогенангидридами карбоновых и неорганических кислот
- с активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- с карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
- со многими солями, образуя гидраты
- с боранами, силанами
- с кетенами, недоокисью углерода
- с фторидами благородных газов
Вода реагирует при нагревании:
- с углём, метаном
- с некоторыми алкилгалогенидами
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
Волновая функция основного состояния воды
В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
В валентном приближении электронная конфигурация молекулы в основном состоянии: Молекула имеет замкнутую оболочку, неспаренных электронов нет. Заняты электронами четыре молекулярные орбитали (МО) — по два электрона на каждой МО , один со спином , другой со спином , или 8 спин-орбиталей . Волновая функция молекулы, , представленная единственным детерминантом Слэтера Ф, имеет вид
Симметрия этой волновой функции определяется прямым произведением НП, по которым преобразуются все занятые спин-орбитали
Принимая во внимание, что прямое произведение невырожденного НП самого на себя является полносимметричным НП и прямое произведение любого невырожденного представления Г на полносимметричное есть Г, получаем:

Remove ads
Виды
Суммиров вкратце
Перспектива
Вода на Земле может существовать в трёх основных состояниях:
- твёрдом
- жидком
- газообразном
Вода может приобретать различные формы, которые могут одновременно соседствовать и взаимодействовать друг с другом:
- водяной пар и облака в небе;
- морская вода и айсберги;
- ледники и реки на поверхности земли;
- водоносные слои в земле.
Вода способна растворять в себе множество органических и неорганических веществ. Из-за важности воды как источника жизни, её нередко подразделяют на типы по различным принципам.
Виды воды по особенностям происхождения, состава или применения.
- По содержанию катионов кальция и магния:
- По изотопам водорода в молекуле:
- лёгкая вода (по составу почти соответствует обычной)
- тяжёлая вода (дейтериевая)
- сверхтяжёлая вода (тритиевая)
- Другие виды:
- водопроводная вода
- деионизированная вода
- дистиллированная вода
- минеральная вода
- морская вода
- питьевая вода
- поверхностные воды
- подземные воды
- пресная вода
- солоноватая вода
- сточные воды
- апирогенная вода
- поливода
- структурированная вода — термин, применяемый в неакадемических теориях
- талая вода
- мёртвая вода и живая вода — виды воды со сказочными свойствами
Вода, входящая в состав другого вещества и связанная с ним физическими связями, называется влагой. В зависимости от вида связи, выделяют:
- сорбционную, капиллярную и осмотическую влагу в твёрдых веществах,
- растворённую и эмульсионную влагу в жидкостях,
- водяной пар или туман в газах.
Вещество, содержащее влагу, называют влажным веществом. Влажное вещество, не способное более сорбировать (поглощать) влагу, — насыщенное влагой вещество.
Вещество, в котором содержание влаги пренебрежимо мало при данном конкретном применении, называют сухим веществом. Гипотетическое вещество, совершенно не содержащее влагу, — абсолютно сухое вещество. Сухое вещество, составляющее основу данного влажного вещества, называют сухой частью влажного вещества.
Смесь газа с водяным паром носит название влажный газ (парогазовая смесь — устаревшее название)[40].

Remove ads
В природе
Суммиров вкратце
Перспектива
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, ледники — 1,81 %, подземные воды — около 0,63 %, реки и озёра — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %[14].
Атмосферные осадки
Это пустой раздел, который еще не написан. |
Вода за пределами Земли
Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не любая водная среда, однако, пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах[42].
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе[43][44], Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы)[45], атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия)[46], Венеры (0,002 %)[47], Луны[48], Марса (0,03 %)[49], Юпитера (0,0004 %)[50], Европы[51], Сатурн, Урана (следы)[52] и Нептуна[53] (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках и до 2·10−5% в Антарктиде[54].
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b[55], HD 209458 b[56] и GJ 1214 b[57].
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет — наиболее вероятно, на Европе — спутнике Юпитера.
Remove ads
Биологическая роль
Суммиров вкратце
Перспектива

Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений.
Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.
Поскольку у льда плотность меньше, чем у жидкой воды, вода в водоёмах замерзает сверху, а не снизу. Образовавшийся слой льда препятствует дальнейшему промерзанию водоёма, это позволяет его обитателям выжить. Существует и другая точка зрения: если бы вода не расширялась при замерзании, то не разрушались бы клеточные структуры, соответственно замораживание не наносило бы ущерба живым организмам. Некоторые существа (тритоны) переносят замораживание/оттаивание — считается, что этому способствует особый состав клеточной плазмы, не расширяющейся при замораживании.
Remove ads
Применение
Суммиров вкратце
Перспектива
В земледелии
Выращивание достаточного количества сельскохозяйственных культур на открытых засушливых землях требует значительных расходов воды на ирригацию.
Для питья и приготовления пищи

Живое человеческое тело содержит от 50 % до 75 % воды[58], в зависимости от веса и возраста. Потеря организмом человека более 10 % воды может привести к смерти. В зависимости от температуры и влажности окружающей среды, физической активности и т. д. человеку нужно выпивать разное количество воды; ведётся много споров о том, сколько воды нужно потреблять для оптимального функционирования организма.
Питьевая вода представляет собой воду из какого-либо источника, очищенную от микроорганизмов и вредных примесей. Пригодность воды для питья при её обеззараживании перед подачей в водопровод оценивается по количеству кишечных палочек на литр воды, поскольку кишечные палочки распространены и достаточно устойчивы к антибактериальным средствам, и если кишечных палочек будет мало, то будет мало и других микробов. Если кишечных палочек не больше, чем 3 на литр, вода считается пригодной для питья[59][60].

В спорте
Многими видами спорта занимаются на водных поверхностях, на льду, на снегу и даже под водой. Это подводное плавание, хоккей, лодочные виды спорта, биатлон, шорт-трек и др.

Для смазки
Вода применяется как смазочный материал для смазки подшипников из древесины, пластиков, текстолита, подшипников с резиновыми обкладками и др. Воду также используют в эмульсионных смазках[61].
Remove ads
Исследования
Суммиров вкратце
Перспектива
Происхождение воды на планете
Происхождение воды на Земле является предметом научных споров. Некоторые учёные[кто?] считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В 2010-е годы было установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад[62].
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных водах.
Также гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию:
- Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
- Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
- Гидрогеология — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
Remove ads
См. также
Примечания
Литература
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads











 ,
, 



































