Алкины
углеводороды, содержащие тройную связь между атомами углерода Из Википедии, свободной энциклопедии
Алки́ны (ацетиле́новые углеводоро́ды) — ациклические непредельные углеводороды, содержащие одну тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации и имеют валентный угол 180°. Простейшим алкином является ацетилен (C2H2).
По номенклатуре «IUPAC», названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабской цифрой.


История открытия
Впервые ацетилен был получен в 1836 году английским химиком Эдмундом Дэви (двоюродным братом знаменитого английского химика Гемфри Дэви), при нагревании уксуснокислого калия с древесным углём и последующей реакцией с водой образовавшегося карбида калия[1]. Дэви назвал свой газ «двууглеродистым водородом».
В 1862 году немецкий химик и врач Ф. Вёлер вновь открыл ацетилен, взаимодействуя водой на карбид кальция.
В 1863 году французский химик М. Бертло получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами[2]. Именно он дал газу имя «ацетилен» (от латинских слов acetum — «уксус» и греческого иле — «дерево»). Русское название «ацетилен» впервые было применено русским химиком Д. И. Менделеевым[3].
Большую роль в изучении химии ацетилена и его производных в конце XIX века сыграл русский химик-органик А. Е. Фаворский.
В 1895 году французский химик Луи Ле Шателье обнаружил, что ацетилен, сгорая в кислороде, даёт очень горячее пламя, что впоследствии легло в основу ацетиленовой технологии сварки и резки тугоплавких металлов[4].
Номенклатура алкинов
Простейшим алкином является этин (ацетилен C2H2). По номенклатуре «IUPAC» названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Углеводородные радикалы, образованные от алкинов имеют суффикс «-ини́л», так CH≡C- называется ««этини́л»».
Ниже представлены некоторые представители алкинов и их названия:
Различают внутреннюю тройную связь (пример: бут-2-ин) и концевую (пример: бут-1-ин).
Гомологический ряд алкинов:
- Этин (ацетилен): C2H2;
- Пропин: C3H4;
- Бутин-1: C4H6;
- Пентин-1: C5H8;
- Гексин-1: C6H10;
- Гептин-1: C7H12;
- Октин-1: C8H14;
- Нонин-1: C9H16;
- Децин-1: C10H18.
- В противном случае, разница в положении тройной связи в двух разных молекулах алкинов (например, бутин-1 и пентин-2) будет сигнализировать о том, что эти вещества будут являтся структурными изомерами по положению связи.
Структура тройной связи
У алкинов связь −С≡С− линейна (угол 180°) и находится в одной плоскости. Атомы углерода связаны одной σ- и двумя π-связями, максимальная электронная плотность которых расположена в двух взаимно перпендикулярных плоскостях[5]. Длина тройной связи примерно 0,121 нм, энергия связи 836 кДж/моль.
На представленной выше диаграмме приведены молекулярные орбитали этилена и ацетилена.
Физические свойства
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше — в органических растворителях.
| Физические свойства некоторых алкинов[6][7] | |||||
|---|---|---|---|---|---|
| № | Название | Формула | Т плавления,°С | Т кипения,°С | Плотность, d204 |
| 1 | Этин | С2H2 | −81,8 | −75 | 0,565* |
| 2 | Пропин | C3H4 | −101,5 | −23 | 0,670* |
| 3 | 1-Бутин | HC≡C−CH2CH3 | −125,9 | 8,1 | 0,678* |
| 4 | 2-Бутин | CH3−C≡C−CH3 | −32,3 | 27,0 | 0,694 |
| 5 | 1-Пентин | HC≡C−C3H7 | −90,0 | 39,3 | 0,695 |
| 6 | 2-Пентин | CH3−C≡C−C2H5 | −101,0 | 55,0 | 0,714 |
| 7 | 3-Метилбутин-1 | HC≡C−CH(CH3)CH3 | н/д | 28,0 | 0,665 |
| 8 | 1-Гексин | HC≡C−C4H9 | −132,4 | 71,4 | 0,719 |
* Значения измерены при температуре кипения.
Нахождение в природе и физиологическая роль алкинов
В природе алкины практически не встречаются. В некоторых видах грибов Basidiomycetes были обнаружены в крайне малом количестве соединения, содержащие полиацетиленовые структуры[8].
Ацетилен обнаружен в атмосфере Урана[9], Юпитера[10] и Сатурна[11].
Алкины обладают слабым наркозным действием. Жидкие алкины вызывают судороги[12].
Способы получения
Суммиров вкратце
Перспектива
Основным промышленным способом получения ацетилена является электро- или термокрекинг метана, пиролиз природного газа и карбидный метод.
Карбидный метод (промышленный способ)
Прокаливание смеси оксида кальция с коксом в электрических печах при 1800—2000°С приводит к образованию карбида кальция:
При действии на полученный карбид воды образуется гидроксид кальция и ацетилен:
Пиролиз углеводородов (промышленный способ)
Суть способа заключается в пропускании над специальной огнеупорной насадкой смеси природного газа с воздухом, который, сгорая, поднимает температуру до 1500 °C. Затем на насадке происходит пиролиз метана[13]:
Крекинг природного газа (промышленный способ)
Электрокрекинг
Метод заключается в пропускании метана между двумя металлическими электродами с огромной скоростью. Температура 1500—1600°С. С химической точки зрения метод аналогичен методу пиролиза, отличаясь лишь технологическим и аппаратным исполнением[14].
Термоокислительный крекинг
В данном методе используется частичное окисление метана благодаря использованию теплоты, образующейся при его сгорании[14]:
Метод прямого синтеза
Взаимодействие углерода напрямую с водородом при очень высоких температурах приводит к образованию ацетилена:
Этот метод имеет чисто историческое значение (получение ацетилена в 1863 году французским химиком М. Бертло).
Электролиз солей непредельных карбоновых кислот
В 1864 году Ф.А. Кекуле получил ацетилен электролизом фумарата и малеата натрия[15]:
Аналогично ацетилен образуется из акрилата натрия.
Этот метод носит чисто историческое значение.
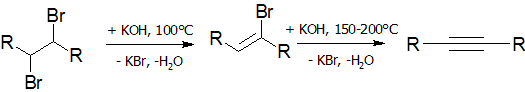
Дегидрогалогенирование галогеналканов и галогеналкенов (лабораторный способ)
Реакция дегидрогалогенирования проводят действием сильного основания на дигалогеналканы:
В качестве дегидрогалогенирующего агента удобно использовать амид натрия в жидком аммиаке[16]:
Алкилирование алкинов (лабораторный способ)
Алкилирование алкинов с концевой тройной связью производится по следующей схеме:
Прочие лабораторные способы получения алкинов
- Реакция Кори-Фукса — синтез алкинов из альдегидов[17]:
На первой стадии идёт образование дибромалкена:
На второй стадии происходит обмен брома на литий и альфа-элиминирование с последующим превращением винилидена в алкин в результате перегруппировки Фрича-Буттенбергера-Вихеля:
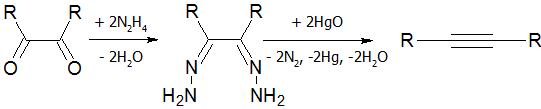
- Разложение дигидразонов[18]:
- Перегруппировка Фрича-Буттенберга-Вихелля — превращение 1,1-диарил-2-дигалогенэтиленов в производные ацетилена под действием сильных оснований[19]:
Химические свойства
Суммиров вкратце
Перспектива
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обусловливает кислотные свойства алкинов в реакциях замещения.
Кислотные свойства алкинов и реакции нуклеофильного замещения
Образование алкинидов
Алкины с концевой тройной связью являются С-H кислотами (сильнее чем аммиак и алкены, но слабее, чем спирты) которые с очень сильными основаниями могут образовывать соли — алкиниды[6]:
(пропинилмагнийбромид)
Реакция алкинов с аммиакатами серебра или одновалентной меди является качественной реакцией на наличие концевой тройной связи[6]:
Пропинид серебра представляет собой осадок белого цвета, пропинид меди — осадок жёлтого цвета, наконец, диацетиленид меди — осадок красного цвета.
Алкинид серебра легко растворяется при добавлении цианида натрия с выделением соответствующего алкина[8]:
Реакции нуклеофильного замещения алкинидов
Алкиниды являются сильными нуклеофилами и легко вступают в реакции нуклеофильного замещения:
Это, в частности, широко используется для синтеза гомологов ацетилена:
Получение алкингалогенидов
Взаимодействие галогена на монозамещённые ацетилены в щелочной среде приводит к получению галогеналкинов[14]:
Реакция нуклеофильного замещения алкинидов
В препаративном синтезе часто используют комплекс ацетиленида лития с этилендиамином как удобный источник ацетиленид-аниона[8].
В случае реакции с вторичными или третичными галогеналканами реакция во многом идёт по альтернативному пути (элиминирование):
Прочие реакции
Хлорирование ацетилена хлоридом меди (II) в водных растворах CuCl приводит к образованию дихлорацетилена[20]:
Ацетиленовая конденсация
Ацетиленовая конденсация или иначе реакция Ходкевича-Кадио, заключается во взаимодействии ацетиленовых углеводородов с бром- или йодалкинами с образованием диацетиленов[21]:
Аналогично протекает и реакция Куртца (катализатор — ацетиленид меди):
Получение ацетиленаминов
Реакция идёт в присутствии солей меди (I).
Реакции электрофильного присоединения
Электрофильное присоединение к алкинам инициируется под воздействием положительно заряженной частицы — электрофила. В общем случае, катализатором таких реакций являются кислоты.
Общая схема первой стадии реакции электрофильного присоединения:
Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:
Галогенирование алкинов идёт как транс-присоединение (как правило) и протекает по аналогии с галогенированием алкенов.
Вместе с тем, присоединение по тройной связи идёт труднее, чем по двойной, в связи с чем при наличии в соединении как двойной, так и тройной связи, возможно провести избирательное присоединение:
Реакции гидрогалогенирования
Присоединение хлороводорода и бромоводорода к алкинам происходит по аналогии с алкенами. Реакция идёт в две стадии: сперва образуется галогеналкен, который далее переходит в дигалогеналкан:
Несмотря на бо́льшую электроотрицательность галогенов, обе стадии реакции идут по правилу Марковникова.
Гидратация
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов). Эта реакция известна как «реакция Кучерова».
Считается, что процесс гидратации идёт через стадию образования енола:
Реакции карбонилирования
Реакции карбонилирования были открыты в лаборатории немецким химиком В. Реппе в 1939 году[20].
где Х: ОН, OR, OCOR, NH2 и пр.
Катализатором реакции являются карбонилы никеля или палладия[22].
Отдельно стоит упомянуть реакцию окислительного карбохлорирования:
Прочие реакции электрофильного присоединения
- Присоединение карбоновых кислот с образованием диэфиров:
Взаимодействие уксусной кислоты с ацетиленом образует винилацетат:
Ацетиленовые углеводороды присоединяют CO2 и вторичные амины с образованием амидов:
- Взаимодействие ацетилена с цианистым водородом в присутствии солей одновалентной меди приводит к образованию акрилонитрила:
- Ацетилен способен в присутствии катализаторов присоединять углеводороды с образованием новых С-С связей[20]:
или
Реакции нуклеофильного присоединения
Нуклеофильное присоединение к алкинам инициируется под воздействием отрицательно заряженной частицы — нуклеофила. В общем случае, катализатором таких реакций являются основания. Общая схема первой стадии реакции нуклеофильного присоединения:
Типовые реакции нуклеофильного присоединения
- Характерным примером реакции нуклеофильного присоединения является «реакция Фаворского» — присоединение спиртов в присутствии щелочей с образованием алкенильных эфиров:
По аналогии ацетилен реагирует с аммиаком, образуя этилиденимин[20]:
При высокой температуре в присутствии катализатора имин дегидрируется и превращается в ацетонитрил:
- В среде очень сильных оснований (например: КОН+ДМСО) ацетилен реагирует с сероводородом, образуя дивинилсульфид[20]:
Реакции радикального присоединения
В присутствии перекисей или других условиях, способствующих образованию свободных радикалов, присоединение к алкинам идёт по радикальному механизму — против правила Марковникова («эффект Караша»):
По свободнорадикальному механизму* может протекать реакция алкинов с тиолами:
* — В присутствии оснований реакция идёт по нуклеофильному механизму.
Аналогично происходит присоединение карбенов:
Реакции этинилирования
Реакциями этинилирования называют реакции увеличения углеродного скелета алкинов с сохранением тройной связи. Они могут протекать как по электрофильному, так и нуклеофильному механизму в зависимости от среды и условий реакции, характера субстрата, а также типа используемого катализатора.
Получение ацетиленовых спиртов
В присутствии сильных оснований алкины с концевой тройной связью способны присоединять карбонильные соединения с образованием спиртов[14] («реакция Фаворского»):
Важнейшей реакцией из этой группы является присоединения формальдегида к ацетилену с образованием пропаргилового спирта и далее бутин-2-диола-1,4*:
* Бутин-2-диол-1,4 является важным промежуточным полупродуктом для получения бутиленгликоля, γ-Бутиролактона, изопрена и тетрагидрофурана.
Эту реакцию разработал в 1925 году В. Реппе («реакция Фаворского-Реппе»). Она протекает при высоком давлении в присутствии ацетиленида меди.
Получение ацетиленовых эфиров и кислот
Ацетиленовые кислоты или их эфиры можно получить по реакции Цужи[20]:
Реакции гидрирования
Гетерогенное гидрирование
Гидрирование алкинов водородом на гетерогенных катализаторах, как правило, приводит к образованию цис-присоединения[6]. Катализаторами гидрирования служат Ni, Pd, Pt, а также оксиды или комплексы Ir, Ru, Rh и некоторых других металлов.
На первой стадии образуется алкен, который практически сразу же гидрируется до алкана:
Для остановки реакции на стадии получения алкена используют катализаторы Линдлара (Pd/PbO/CaCO3) или борид никеля.
При гидрировании ацетилена на никель-кобальтовом катализаторе можно получить изобутилен:
Гомогенное гидрирование
Гомогенное гидрирование проводят с амидом натрия в жидком аммиаке или алюмогидридом лития в тетрагидрофуране. В ходе реакции образуются транс-алкены.
Гидроборирование
Алкины легко присоединяют диборан против правила Марковникова, образуя цис-алкенилбораны:
Реакция интересна тем, что далее алкенилбораны легко перевести в соответствующие цис-алкены простым действием уксусной кислоты[18]:
или окислить H2O2 до альдегида или кетона[18]:
Восстановительное карбоксилирование
По аналогии с реакциями алкенов, алкины вступают в реакцию восстановительного карбоксилирования.
В зависимости от условий реакции и типов катализаторов, конечными продуктами могут стать спирты, альдегиды или алканы:
Реакции окисления
Реакции окислительного присоединения
Алкины окисляются более трудно чем алкены, однако при контролируемом окислении можно сохранить C-C связь и получить в качестве продуктов реакции карбонильные соединения[16]:
В качестве окислителя может выступать озон (с последующим восстановлением и гидролизом озонида), KMnO4 в слабощелочной или нейтральной среде и некоторые другие вещества[16].
Ацетилен, в зависимости от окислителя может давать три продукта:
(глиоксаль) — окисление разбавленной HNO3 в присутствии PdCl2 и NaNO2[20].
(глиоксалевая кислота) — окисление KClO3 в субстрате вода+диэтиловый эфир[16].
(щавелевая кислота) — окисление KMnO4 в кислой среде или HNO3 в присутствии PdCl2.
Отдельный тип реакций — реакции окислительного карбоксилирования.
В растворах комплексов палладия образуются эфиры малеиновой кислоты:
Реакции окислительного расщепления
При действии сильных окислителей в жёстких условиях алкины окисляются с разрывом тройной связи. В ходе реакции образуются карбоновые кислоты и CO2:
Реакции окислительного сочетания
В присутствии солей одновалентной меди в спиртовом растворе аммиака алкины окисляются кислородом воздуха до диацетиленов («реакция Глазера»):
Реакция для ацетилена может идти c образованием полиинов:
Реакции изомеризации
В 1887 году А.Е Фаворским была открыта изомеризация алкинов под действием сильных оснований (нуклеофильная атака)[6]. Эта реакция носит название Реакция Фаворского или ацетилен-алленовой перегруппировки:
Реакции олигомеризации, полимеризации и циклообразования
Реакции олигомеризации
В присутствии солей меди(I) и хлорида аммония в водной среде ацетилен вступает в реакцию олигомеризации с образованием винилацетилена:
Реакция может идти дальше с образованием дивинилацетилена:
Реакция была впервые открыта Ю. Ньюлендом и служит первой промышленной стадией для синтеза хлоропрена.
Реакции полимеризации
Впервые полимеризацию ацетилена осуществил Дж. Натта в 1957 году, пропуская газ над раствором катализатора Al(C2H5)3-Ti(OC4H9)4[25]:
В ходе реакции был получен полукристаллический полиацетилен.
Полиацетилен интересен тем, что введением в него определённых добавок (допирование) можно получить электропроводящий полимер с металлическими свойствами[25].
Реакции циклообразования
Ацетилен под действием катализаторов — раскалённого активированного угля при 500 °С (реакция Зелинского) или органоникелевого катализатора (например, тетракарбонила никеля) при 60 °С и повышенном давлении (реакция Реппе) — достаточно легко циклотримеризуется, образуя бензол, а в других условиях (катализатор — цианид никеля(II) в ТГФ) — циклооктатетраен:
Циклообразование в присутствии оксида углерода(II) приводит к получению бензохинона[13]:
Важной способностью алкинов является их возможность вступать в реакцию Дильса-Альдера:
Реакции образования гетероциклов
Образование производных пиррола
Взаимодействие ацетилена с оксимами кетонов в присутствии супероснования приводит к получению пиррольного кольца (Реакция Трофимова)[26]:
Гетероциклизация протекает при температуре 70—120 °С в среде диметилсульфоксида.
Существуют и альтернативные варианты синтеза[27]:
Образование производных фурана
При обработке алкинов водяным паром и CO в присутствии родиевого катализатора при давлении 10 МПа и 100 °C образуются производные фурана[28]:
Образование прочих гетероциклов
Приведём ещё несколько примеров образования гетероциклов с использованием алкинов[29][30]:
Идентификация алкинов
Качественной реакцией на алкины с концевой тройной связью является взаимодействие алкина с аммиакатом серебра или меди (подробнее см. подраздел: «Образование алкинидов»).
Для подтверждения наличия тройной связи в соединении используют методы спектроскопии. ИК спектры асимметричных алкинов имеют характеристические полосы при 2260—2100 см−1 (валентные колебания тройной связи), 3310-3300 см−1 (колебания С-Н связей) и деформационные колебания C-H при 700—610 см−1[13].
Применение
Суммиров вкратце
Перспектива
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём.
Ацетилен используют для синтеза следующих продуктов:
- тетрахлорэтан, трихлорэтилен, дихлорэтилен (хлорирование ацетилена) — растворители;
- акрилонитрил (конденсация ацетилена с циановодородом) — для получения полиакрилонитрила;
- акриламид (конденсация ацетилена с CO и аммиаком) — для получения полиакриламида;
- тетрагидрофуран (конденсация ацетилена с формальдегидом с последующим гидрированием и дегидратацией) — важный растворитель, сырьё для уретановых полимеров;
- винилхлорид (гидрохлорирование ацетилена) — для получения поливинилхлорида;
- винилацетат (конденсация с уксусной кислотой) — для получения поливинилацетата;
- ацетальдегид (гидратация ацетилена) — для дальнейшего получения уксусной кислоты, ацетона и др. продуктов;
- бутиленгликоль (конденсация ацетилена с формальдегидом с последующим гидрированием) — для получения полиуретанов, полиэфиров, пластификаторов.
- винилацетилен (димеризация ацетилена) — полупродукт для синтеза полимеров;
- хлоропрен (гидрохлорирование винилацетилена) — для получения хлоропреновых каучуков;
- бутадиен (дегидратация бутиленгликоля) — для получения бутадиеновых каучуков;
При горении ацетилена выделяется много тепла, что используется для резки и сварки металлов в ацетилен-кислородной сварке (расходуется до 30 % всего производимого ацетилена)[13].
В конце XIX — начале XX века широкой популярностью пользовались многочисленные ацетиленовые светильники (источником ацетилена служил дешёвый карбид кальция), используемые на железнодорожном и водном транспорте, для освещения улиц, в быту[31]. Несмотря на то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их выпуск и потребление не прекратились. Они производятся в небольших количествах как походное снаряжение[32].
См. также
Примечания
Литература
Ссылки
Wikiwand - on
Seamless Wikipedia browsing. On steroids.











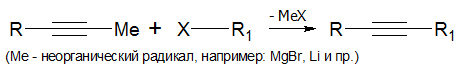
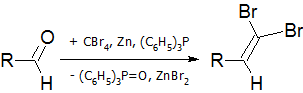








![{\displaystyle {\mbox{CH}}_{3}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{C}}\!\!-\!\!{\mbox{Ag}}+2{\mbox{NaCN}}+{\mbox{H}}_{2}{\mbox{O}}\rightarrow {\mbox{CH}}_{3}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{CH}}\!\uparrow +{\mbox{Na}}[{\mbox{Ag(CN)}}_{2}]+{\mbox{NaOH}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/7dc9eb0c6df7c85aa7c6d143aab6dd331a1d4d23)













































![{\displaystyle {\mbox{RC}}\!\!\equiv \!\!{\mbox{CR}}+2[{\mbox{O}}]\rightarrow {\mbox{R}}\!\!-\!\!{\mbox{C}}({\mbox{O}})\!\!-\!\!{\mbox{C}}({\mbox{O}})\!\!-\!\!{\mbox{R}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/82da449b588c8a5950072f3694cce95d96e34dfd)
![{\displaystyle {\mbox{HC}}\!\!\equiv \!\!{\mbox{CH}}+2[{\mbox{O}}]\rightarrow {\mbox{CHO}}\!\!-\!\!{\mbox{CHO}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/4e59442dedf86e7f65045e5fbea81f47e34b30eb)
![{\displaystyle {\mbox{HC}}\!\!\equiv \!\!{\mbox{CH}}+3[{\mbox{O}}]\rightarrow {\mbox{CHO}}\!\!-\!\!{\mbox{COOH}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/0850b7d67e8eaa2f517468e1e20f8c7fc4a3298d)
![{\displaystyle {\mbox{HC}}\!\!\equiv \!\!{\mbox{CH}}+4[{\mbox{O}}]\rightarrow {\mbox{HOOC}}\!\!-\!\!{\mbox{COOH}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/70f9a7fe621232ec7d4e63368486bbc4fbeb315e)

![{\displaystyle {\mbox{RC}}\!\!\equiv \!\!{\mbox{CR}}'+3[{\mbox{O}}]+{\mbox{H}}_{2}{\mbox{O}}\rightarrow {\mbox{RCOOH}}+{\mbox{R}}'{\mbox{COOH}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/c75b60c32a3fa656ea69e23c377b7d2576a60870)
![{\displaystyle {\mbox{RC}}\!\!\equiv \!\!{\mbox{CH}}+4[{\mbox{O}}]\rightarrow {\mbox{RCOOH}}+{\mbox{CO}}_{2}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/2f966501384b13d56ca9ba897061144c944bc5c5)


![{\displaystyle {\mbox{CH}}_{3}\!\!-\!\!{\mbox{CH}}_{2}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{CH}}\rightleftarrows [{\mbox{CH}}_{3}\!\!-\!\!{\mbox{CH}}\!\!=\!\!{\mbox{C}}\!\!=\!\!{\mbox{CH}}_{2}]\rightleftarrows {\mbox{CH}}_{3}\!\!-\!\!{\mbox{C}}\!\!\equiv \!\!{\mbox{C}}\!\!-\!\!{\mbox{CH}}_{3}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/d57c99f9b1ee32791acd3ed13a85fc0c5e43c8ec)











