Tritlenek siarki
związek chemiczny Z Wikipedii, wolnej encyklopedii
Tritlenek siarki (nazwa Stocka: tlenek siarki(VI)), SO
3 – nieorganiczny związek chemiczny z grupy tlenków kwasowych, w którym siarka występuje na VI stopniu utlenienia.
| |||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
SO3 | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
80,06 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwna, lotna ciecz | ||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki |
tritlenek selenu | ||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||
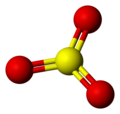
Budowa cząsteczki
Monomeryczna cząsteczka tritlenku siarki w stanie gazowym ma płaską budowę trójkąta równobocznego. Długość wiązań S−O wynosi 142 pm, a kąty pomiędzy wiązaniami O−S−O wynoszą po 120°[2][1].
Otrzymywanie
Tritlenek siarki powstaje jako produkt pośredni w procesie otrzymywania kwasu siarkowego metodą kontaktową poprzez katalityczne utlenianie SO
2 (z uwagi na małą szybkość reakcji pomiędzy SO
2 i tlenem stosuje się katalizator w postaci V
2O
5, który zastąpił używaną wcześniej platynę)[2][7]. SO
3 nie jest jednak zazwyczaj izolowany, a dalej wykorzystywany do otrzymania pożądanego kwasu[1].
Laboratoryjne metody otrzymywania tego tlenku obejmują odwadnianie kwasu siarkowego przy użyciu P
4O
10:
- 2H
2SO
4 + P
4O
10 → 4HPO
3 + 2SO
3
oraz ogrzewanie disiarczanu potasu[2]:
- K
2S
2O
7 → K
2SO
4 + SO
3
a także utlenianie SO
2 przy użyciu SeO
2:
- 2SO
2 + SeO
2 → 2SO
3 + Se
Właściwości
Podsumowanie
Perspektywa
Tritlenek siarki jest w warunkach pokojowych bezbarwną cieczą. Może występować w trzech formach: α-SO
3, β-SO
3, γ-SO
3. Poniżej temperatury 16,86 °C tworzy się forma γ jako rombowe kryształy przypominające lód, w których cząsteczki tritlenku siarki występują jedynie w postaci cyklicznych trimerów (SO
3)
3. Pod wpływem niewielkich ilości wilgoci forma γ przekształca się do formy β będąca w rzeczywistości mieszaniną kwasów polisiarkowych HO(SO
2O)
xH (gdzie x jest bardzo duże, około 105). Do wytworzenia się formy α (bardziej usieciowanej i przypominającej azbest) także potrzebna jest obecność wilgoci. W stanie gazowym monomeryczne cząsteczki SO
3 występują w równowadze z trimerami[2][1].
Skłonność do polimeryzacji powoduje, że sprzedawany tritlenek siarki wzbogacany jest o dodatki hamujące tę reakcję. Są to zazwyczaj m.in. związki boru lub krzemu (w ilościach ok. 0,03–1,5%)[1].

Tritlenek siarki jest bardzo reaktywny. Reaguje gwałtownie i egzotermicznie z wodą tworząc kwas siarkowy. Ma właściwości utleniające (utlenia m.in. fosfor do P
4O
10) i jest silnym kwasem Lewisa[2]. Z halogenowodorami daje odpowiednie kwasy halogenosiarkowe (HSO
3X)[1].
Stały SO
3 ma dość dużą lotność, przez co jego pary mogą tworzyć z wilgocią H
2SO
4[2].
Zastosowanie
Tritlenek siarki stosuje się do otrzymywania kwasu siarkowego oraz innych związków (m.in. poprzez sulfonowanie związków organicznych, np. alkilobenzenów do kwasów alkilobenzenosulfonowych)[7]. Znajduje zastosowanie także przy produkcji materiałów wybuchowych[8].
Przypisy
Linki zewnętrzne
Wikiwand - on
Seamless Wikipedia browsing. On steroids.