Ditlenek selenu
związek chemiczny Z Wikipedii, wolnej encyklopedii
Ditlenek selenu (nazwa Stocka: tlenek selenu(IV)), SeO2 – nieorganiczny związek chemiczny, w którym selen znajduje się na IV stopniu utlenienia. Tlenek ten jest najczęściej spotykanym związkiem selenu.
| |||||||||||||||||||||||||||||||||||||||||||||||||
 Pojemnik z ditlenkiem selenu | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
SeO2 | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
110,96 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||
Właściwości
Podsumowanie
Perspektywa
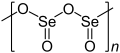
W temperaturze pokojowej jest to białe, krystaliczne ciało stałe o ostrym zapachu, przypominającym zapach sosu chrzanowego, przy inhalacji może dojść do poparzenia nosa czy gardła. SeO2 jest cząsteczką polarną, z momentem dipolowym skierowanym od atomów tlenu do środkowego atomu selenu. Stały SeO2 jest jednowymiarowym polimerem, którego łańcuch składa się naprzemiennie z atomów selenu i tlenu. Każdy atom Se, który wpisuje się w piramidę, posiada końcowe grupy tlenowe. Względna stereochemia przy Se zmienia się wraz z łańcuchem polimeru (syndiotaktyczność). Ciało stałe z łatwością sublimuje w 315 °C. Gazowy dwutlenek selenu przybiera podobną, zagiętą postać cząsteczki jak gazowy dwutlenek siarki. Rozpuszczenie SeO2 w tlenodichlorku selenu SeOCl2 daje trimer [Se(O)O]3.
SeO2 jest tlenkiem kwasowym; rozpuszcza się w wodzie tworząc słaby, nietrwały kwas selenawy, o wzorze analogicznym do kwasu siarkawego:
- SeO2 + H2O → H2SeO3
Tlenek reagując z zasadami tworzy sole nazywane selenianami zawierające anion SeO2−3. Na przykład w reakcji z wodorotlenkiem sodu powstaje selenian sodu:
- SeO2 + 2NaOH → Na2SeO3 + H2O
Posiada właściwości utleniające. Może utlenić SO2 do SO3:
- 2SO2 + SeO2 → 2SO3 + Se
- H2SeO3 + 2SO2 + H2O → 2H2SO4 + Se
Otrzymywanie
Ditlenek selenu jest otrzymywany poprzez utlenienie selenu poprzez spalenie w powietrzu, kwas azotowy lub reakcję z nadtlenkiem wodoru, ale najwygodniejszą metodą jest odwodnienie kwasu selenawego.
- 3Se + 4HNO3 + H2O → 3H2SeO3 + 4NO
- 2H2O2 + Se → SeO2 + 2H2O
- H2SeO3 ⇌ SeO2 + H2O
Zastosowanie
Ditlenek selenu nadaje szkłu czerwoną barwę. W małych ilościach jest używany w celu zneutralizowania niebieskiego zabarwienia spowodowanego zanieczyszczeniami kobaltem, aby wytworzyć bezbarwne szkło. W większych ilościach nadaje głęboki, czerwony, rubinowy kolor. Ditlenek selenu jest także aktywnym składnikiem roztworów służących do oksydowania (oksydowanie na zimno) stali. Jest stosowany również jako toner w fotograficznym wywoływaniu.
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.