Białka
wielkocząsteczkowy związek organiczny zbudowany z reszt aminokwasów połączonych wiązaniami peptydowymi Z Wikipedii, wolnej encyklopedii
Białka, proteiny – wielkocząsteczkowe biopolimery o masie cząsteczkowej od ok. 10 tys. do kilku mln Da, a właściwie biologiczne polikondensaty, zbudowane z aminokwasów połączonych ze sobą wiązaniami peptydowymi. Występują we wszystkich żywych organizmach oraz wirusach. Synteza białek w komórkach żywych odbywa się przy udziale specjalnych struktur komórkowych, zwanych rybosomami.

po lewej – prezentacja rozmieszczenia poszczególnych atomów, rozróżnionych kolorami
w środku – wstążkowy model struktury drugorzędowej podjednostki,
po prawej – prezentacja właściwości powierzchni dostępnej dla rozpuszczalnika po zwinięciu białka (kolor czerwony – reszty kwasowe, niebieski – reszty zasadowe, zielony – reszty polarne, biały – reszty niepolarne)

Głównymi pierwiastkami wchodzącymi w skład białek są C, O, H, N, S, także P oraz niekiedy kationy metali Mn2+, Zn2+, Mg2+, Fe2+, Cu2+, Co2+ i inne.
Skład ten nie pokrywa się ze składem aminokwasów. Wynika to stąd, że większość białek (są to tzw. białka złożone lub proteidy) ma dołączone do reszt aminokwasowych różne inne cząsteczki. Regułą jest przyłączanie cukrów, a ponadto kowalencyjnie lub za pomocą wiązań wodorowych dołączane może być wiele różnych związków organicznych pełniących funkcje koenzymów oraz jony metali.
Budowa białek
Podsumowanie
Perspektywa
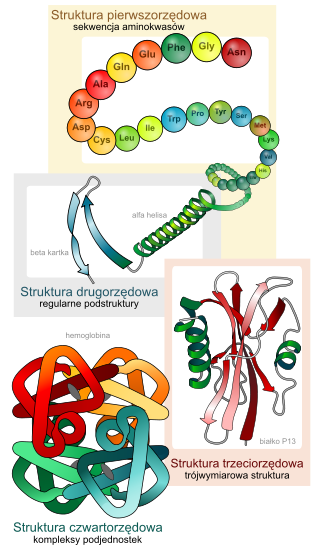

Zsyntetyzowany w komórce łańcuch białkowy przypomina unoszącą się swobodnie w roztworze „nitkę”, która może przyjąć dowolny kształt (w biofizyce nazywa się to kłębkiem statystycznym), ale ulega procesowi tzw. zwijania białka (ang. protein folding) tworząc mniej lub bardziej sztywną strukturę przestrzenną, zwaną strukturą lub konformacją białka „natywną”. Zwykle tylko cząsteczki, które uległy zwinięciu do takiej struktury, mogą pełnić właściwą danemu białku rolę biochemiczną; istnieją jednak białka pozbawione struktury trzeciorzędowej stanowiące wyjątek od tej reguły.
Ze względu na skalę przestrzenną pełną strukturę białka można opisać na czterech poziomach:
- Struktura pierwszorzędowa białka (sekwencja aminokwasów, struktura pierwotna białka) – kolejność aminokwasów w łańcuchu polipeptydowym[1]
- Struktura drugorzędowa białka – przestrzenne ułożenie fragmentów łańcuchów polipeptydowych. Do struktur drugorzędowych zaliczana jest[1]:
- helisa alfa (ang. α helix)[1]
- harmonijka beta (ang. β sheet)[1]
- beta zakręt (pętle omega) (ang. β hairpin)[1]
- Struktura trzeciorzędowa białka – wzajemne położenie elementów struktury drugorzędowej[2].
- Struktura czwartorzędowa białka – wzajemne położenie łańcuchów polipeptydowych oraz ewentualnie struktur niebiałkowych[2] (grupa prostetyczna):
- cukrów w glikoproteidach
- lipidów w lipoproteidach
- kwasów nukleinowych w nukleoproteidach
- barwników w chromoproteidach
- resztę kwasu fosforowego w fosfoproteidach.
Oprócz klasycznego czteropoziomowego opisu struktury białka niekiedy użyteczne jest wyróżnienie dodatkowych poziomów organizacji:
Skład pierwiastkowy
Najczęściej skład pierwiastkowy białek przedstawiany jest następująco[5]:
Właściwości fizyczne i chemiczne
Podsumowanie
Perspektywa
Białka nie posiadają charakterystycznej dla siebie temperatury topnienia. Przy ogrzewaniu w roztworze, a tym bardziej w stanie stałym, ulegają, powyżej pewnej temperatury, nieodwracalnej denaturacji (ścinanie się włókien białka) – zmianie struktury, która czyni białko nieaktywnym biologicznie (codziennym przykładem takiej denaturacji jest smażenie lub gotowanie jajka)[2]. Jest to spowodowane nieodwracalną utratą trzeciorzędowej lub czwartorzędowej budowy białka. Z tej przyczyny dla otrzymania suchej, ale niezdenaturowanej próbki danego białka, stosuje się metodę liofilizacji, czyli odparowywania wody lub innych rozpuszczalników z zamrożonej próbki pod zmniejszonym ciśnieniem. Denaturacja białek może również zachodzić pod wpływem soli metali ciężkich, mocnych kwasów i zasad, niskocząsteczkowych alkoholi, aldehydów oraz napromieniowania. Wyjątek stanowią proste białka, które mogą ulegać także procesowi odwrotnemu, tzw. renaturacji – po usunięciu czynnika, który tę denaturację wywołał. Niewielka część białek ulega trwałej denaturacji pod wpływem zwiększonego stężenia soli w roztworze, jednak proces wysalania jest w większości przypadków w pełni odwracalny, dzięki czemu umożliwia izolowanie lub rozdzielanie białek.
Białka są na ogół rozpuszczalne w wodzie. Do białek nierozpuszczalnych w wodzie należą tzw. białka fibrylarne, występujące w skórze, ścięgnach, włosach (kolagen, keratyna) lub mięśniach (miozyna). Niektóre z białek mogą rozpuszczać się w rozcieńczonych kwasach lub zasadach, jeszcze inne w rozpuszczalnikach organicznych. Na rozpuszczalność białek ma wpływ stężenie soli nieorganicznych w roztworze, przy czym małe stężenie soli wpływa dodatnio na rozpuszczalność białek. Jednak przy większym stężeniu następuje uszkodzenie otoczki solwatacyjnej, co powoduje wysalanie białek z roztworu. Proces ten nie narusza struktury białka, więc jest odwracalny i nosi nazwę wysalania białek.
Białka posiadają zdolność wiązania cząsteczek wody. Efekt ten nazywamy hydratacją. Nawet po otrzymaniu próbki suchego białka zawiera ona związane cząsteczki wody.
Białka, ze względu na obecność zasadowych grup NH2 oraz kwasowych COOH mają charakter obojnaczy – w zależności od pH roztworu będą zachowywały się jak kwasy (w roztworze zasadowym) lub jak zasady (w roztworze kwaśnym). Dzięki temu białka mogą pełnić rolę bufora stabilizującego pH, np. krwi[6]. Różnica pH nie może być jednak znaczna, gdyż białko może ulec denaturacji. Wypadkowy ładunek białka zależy od ilości aminokwasów kwaśnych i zasadowych w cząsteczce. Wartość pH, w której ładunki dodatnie i ujemne aminokwasów równoważą się nazywany jest punktem izoelektrycznym białka.
Białka odgrywają zasadniczą rolę we wszystkich procesach biologicznych. Biorą udział w katalizowaniu wielu przemian w układach biologicznych (enzymy są białkami), uczestniczą w transporcie wielu małych cząsteczek i jonów (np. 1 cząsteczka hemoglobiny przenosząca 4 cząsteczki tlenu), służą jako przeciwciała oraz biorą udział w przekazywaniu impulsów nerwowych jako białka receptorowe. Białka pełnią także funkcję mechaniczno-strukturalną. Wszystkie białka zbudowane są z aminokwasów. Niektóre białka zawierają nietypowe, rzadko spotykane aminokwasy, które uzupełniają ich podstawowy zestaw. Wiele aminokwasów (zazwyczaj ponad 100) połączonych ze sobą wiązaniami peptydowymi tworzy łańcuch polipeptydowy, w którym można wyróżnić dwa odmienne końce. Na jednym końcu łańcucha znajduje się niezablokowana grupa aminowa (tzw. N-koniec), na drugim niezablokowana grupa karboksylowa (C-koniec).
Podział białek
Podsumowanie
Perspektywa
Istnieje wiele kryteriów podziału białek.
Ze względu na budowę i skład, dzielimy białka na proste i złożone.
Białka proste (proteiny) zbudowane są wyłącznie z aminokwasów. Dzielimy je na następujące grupy:
- protaminy – są silnie zasadowe, charakteryzują się dużą zawartością argininy oraz brakiem aminokwasów zawierających siarkę. Są dobrze rozpuszczalne w wodzie. Najbardziej znanymi protaminami są: klupeina, salmina, cyprynina, ezocyna, gallina.
- histony – podobnie jak protaminy są silnie zasadowe i dobrze rozpuszczają się w wodzie; składniki jąder komórkowych (w połączeniu z kwasem deoksyrybonukleinowym), czyli są obecne także w erytroblastach. W ich skład wchodzi duża ilość takich aminokwasów jak lizyna i arginina.
- albuminy – białka obojętne, spełniające szereg ważnych funkcji biologicznych: są enzymami, hormonami i innymi biologicznie czynnymi związkami. Dobrze rozpuszczają się w wodzie i rozcieńczonych roztworach soli, łatwo ulegają koagulacji. Znajdują się w tkance mięśniowej, osoczu krwi i mleku.
- globuliny -w ich skład wchodzą wszystkie aminokwasy białkowe, z tym że kwas asparaginowy i kwas glutaminowy w większych ilościach; w odróżnieniu od albumin są źle rozpuszczalne w wodzie, natomiast dobrze w rozcieńczonych roztworach soli; posiadają podobne właściwości do nich. Występują w dużych ilościach w płynach ustrojowych i tkance mięśniowej.
- prolaminy – są to typowe białka roślinne, występują w nasionach. Charakterystyczną właściwością jest zdolność rozpuszczania się w 70% etanolu.
- gluteliny – podobnie jak prolaminy – to typowe białka roślinne; posiadają zdolność rozpuszczania się w rozcieńczonych kwasach i zasadach.
- skleroproteiny – białka charakteryzujące się dużą zawartością cysteiny i aminokwasów zasadowych oraz kolagenu i elastyny, a także proliny i hydroksyproliny, nierozpuszczalne w wodzie i rozcieńczonych roztworach soli. Są to typowe białka o budowie włóknistej, dzięki temu pełnią funkcje podporowe. Do tej grupy białek należy keratyna.
Białka złożone (dawniej – proteidy):
- chromoproteiny – złożone z białek prostych i grupy prostetycznej – barwnika. Należą tu hemoproteidy (hemoglobina, mioglobina, cytochromy, katalaza, peroksydaza) zawierające układ hemowy oraz flawoproteiny.
- fosfoproteiny – zawierają około 1% fosforu w postaci reszt kwasu fosforowego. Do tych białek należą: kazeina mleka, witelina żółtka jaj, ichtulina ikry ryb.
- nukleoproteiny – składają się z białek zasadowych i kwasów nukleinowych. Rybonukleoproteiny są zlokalizowane przede wszystkim w cytoplazmie: w rybosomach, mikrosomach i mitochondriach, w niewielkich ilościach także w jądrach komórkowych, a poza jądrem tylko w mitochondriach. Wirusy są zbudowane prawie wyłącznie z nukleoproteidów.
- lipidoproteiny – połączenia białek z tłuszczami prostymi lub złożonymi, np. sterydami, kwasami tłuszczowymi. Lipoproteidy są nośnikami cholesterolu (LDL, HDL, VLDL). Wchodzą na przykład w skład błony komórkowej.
- glikoproteiny – ich grupę prostetyczną stanowią cukry, należą tu m.in. mukopolisacharydy (ślina). Glikoproteidy występują też w substancji ocznej i płynie torebek stawowych.
- metaloproteiny – zawierają jako kofaktor atomy metalu[6] (miedź, cynk, żelazo, wapń, magnez, molibden, kobalt). Atomy metalu stanowią grupę czynną wielu enzymów.
Białka dzielimy również ze względu na właściwości odżywcze – wyróżnia się białka doborowe i niedoborowe.
- Białka doborowe (Pełnowartościowe) – te które w swoim składzie zawierają wszystkie aminokwasy egzogenne. Do takich białek zaliczamy np. albuminę, kolagen, białko jaja kurzego, białko mleka i mięsa.
- Białka niedoborowe (Niepełnowartościowe) – te w których brakuje choćby jednego aminokwasu egzogennego. Przykładem takiego białka jest Żelatyna.
Funkcja białek

Białka mają następujące funkcje:
- kataliza enzymatyczna – od uwadniania dwutlenku węgla do replikacji chromosomów
- transport – hemoglobina, transferryna
- magazynowanie – ferrytyna
- kontrola przenikalności błon – regulacja stężenia metabolitów w komórce
- ruch uporządkowany – skurcz mięśnia, ruch – np. aktyna, miozyna
- wytwarzanie i przekazywanie impulsów nerwowych
- bufory
- kontrola wzrostu i różnicowania
- immunologiczna – np. immunoglobuliny
- budulcowa, strukturalna – np. &-keratyna, elastyna, kolagen
- przyleganie komórek (np. kadheryny)
- regulatorowa (regulacja hormonalna i regulacja przebiegu procesów genetycznych) – reguluje przebieg procesów biochemicznych – np. hormon wzrostu, insulina, czynniki transkrypcyjne i inne.
Trawienie białek
U ludzi trawienie białek zaczyna się dopiero w żołądku, gdzie komórki główne komórek gruczołowych żołądka wydzielają nieczynny enzym pepsynogen. Komórki okładzinowe wydzielają kwas solny, w obecności którego pepsynogen przekształca się w postać czynną – pepsynę. W dwunastnicy działają trypsyna i chymotrypsyna, które rozkładają cząsteczki polipeptydów do tripeptydów i dipeptydów. Te z kolei rozkładane są przez peptydazy ściany jelita cienkiego do aminokwasów, które zostają wchłaniane do krwi za pomocą odpowiednich przenośników znajdujących się w rąbku szczoteczkowym i żyłą wrotną wędrują do wątroby. Stamtąd większość aminokwasów dalej dostaje się z krwią do komórek ciała. Nadwyżka pozbawiana jest reszt aminowych, przez co powstaje amoniak i ketokwasy. Amoniak przekształcany jest w mniej toksyczny mocznik, który z krwią odtransportowywany jest do nerek. Natomiast ketokwasy mogą zostać wykorzystane do syntezy cukrów i niektórych aminokwasów, zużyte na cele energetyczne lub przekształcone w tłuszcze zapasowe.
Zobacz też
- białka rybosomalne
- białka pełnowartościowe (doborowe)
- białka niepełnowartościowe (niedoborowe)
- białko zielonej fluorescencji
- punkt izoelektryczny białek
- wartość odżywcza
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

