Najlepsze pytania
Chronologia
Czat
Perspektywa
Aminokwasy białkowe
aminokwas występujący w białkach Z Wikipedii, wolnej encyklopedii
Remove ads
Remove ads
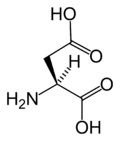
Aminokwasy białkowe – aminokwasy wchodzące w skład białek, łączące się z sobą wiązaniem peptydowym. Ze względu na pozycję grupy aminowej względem karboksylowej należą do tak zwanych α-aminokwasów, w których obie te grupy połączone są z atomem węgla α cząsteczki aminokwasu. Z wyjątkiem achiralnej glicyny, są to związki optycznie czynne o konfiguracji L, czyli mające grupę aminową po lewej stronie łańcucha głównego w projekcji Fischera.

Zazwyczaj wymienia się 20 podstawowych (tak zwanych kanonicznych) aminokwasów białkowych[1] kodowanych przez kodony. Niektóre źródła podają dodatkowo: selenometioninę[2], selenocysteinę oraz pirolizynę[3]. Selenocysteina ulega kotranslacyjnemu wbudowaniu w powstające białko, więc jest aminokwasem niekanonicznym, który nie powstaje poprzez modyfikacje potranslacyjne. W wyniku modyfikacji łańcuchów bocznych w trakcie translacji powstają: cystyna, hydroksylizyna, hydroksyprolina[4]. Istnieje kilka teorii ogólnych wyjaśniających czemu akurat te 20 konkretne aminokwasy zostały wybrane na drodze ewolucji[5][6][7]. W przypadku kilku aminokwasów znane są dokładne przyczyny np. ornityna i homoseryna ulegają cyklizacji zaburzając strukturę łańcucha głównego co skutkuje powstaniem białek o krótkim okresie półtrwania[8]. Inną przyczyną może być wysokie podobieństwo strukturalne niektórych aminokwasów przez co mogą być one omyłkowo włączone do białek np. kanawanina będąca bliskim analogiem argininy jest z tego powodu wysoce toksyczna[9].
Ze względu na zdolność organizmu do syntezy danego związku wyróżnia się aminokwasy endogenne i egzogenne.
Remove ads
D-Aminokwasy
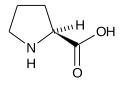
Mimo że w przyrodzie dominują L-aminokwasy, spotyka się także ich enancjomery o konfiguracji D. Występują one naturalnie, na przykład w mikroorganizmach, roślinach i bezkręgowcach morskich. Powstają także podczas obróbki żywności, w wyniku racemizacji L-aminokwasów. Białka zawierające reszty D-aminokwasowe są gorzej trawione i mają niższą wartość odżywczą. Aktywność biologiczna D-aminokwasów różni się od naturalnych enancjomerów L, przy czym niektóre D-aminokwasy wywierają korzystny wpływ na organizm człowieka, a inne szkodliwy[10][11].
Remove ads
Podstawowe aminokwasy białkowe
Podsumowanie
Perspektywa
Poniżej przedstawiono tabele zawierającą nazwy wraz ze skrótowymi oznaczeniami, podstawowe informacje oraz właściwości fizykochemiczne dla 20 standardowych aminokwasów.
* Masa cząsteczkowa na podstawie średniej ważonej uwzględniającej procentową zawartość izotopu danego pierwiastka w przyrodzie. Powstanie wiązania peptydowego powoduje zmniejszenie masy łańcucha polipeptydowego o jedną cząsteczkę wody (czyli o 18,01524 Da).
Ekspresja genetyczna
* UAG koduje normalnie kodon stopu (amber), jednak w przypadku niektórych bakterii i archeonów kodon ten skutkuje wstawieniem pirolizyny[13].
** UGA koduje normalnie kodon stopu (opal), jednak w przypadku niektórych bakterii i archeonów kodon ten skutkuje wstawieniem selenocysteiny[13].
† Kodony stopu zwykle nie kodują aminokwasów i zostały dodane dla kompletności kodu genetycznego.
†† Kodony UAG oraz UGA nie zawsze działają jako kodony stopu (patrz wyżej).
& Częstotliwość aminokwasów określono na podstawie średniej z proteomów (135 archeonów, 3775 bakterii, 614 eukariontów) oraz białek ludzkich (21006 białek)[14].
Remove ads
Produkcja przemysłowa
Roczna światowa produkcja podstawowych aminokwasów i ich soli wyniosła w 2005 r. ok. 3,3 mln ton, z czego ok. 95% stanowiła produkcja trzech z nich – kwasu glutaminowego i jego soli (głównie glutaminianu sodu), DL-metioniny i lizyny (głównie w postaci chlorowodorku)[15].
Zobacz też
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads