Najlepsze pytania
Chronologia
Czat
Perspektywa
Dwutlenek siarki
związek chemiczny Z Wikipedii, wolnej encyklopedii
Remove ads
Dwutlenek siarki, ditlenek siarki, nazwa Stocka: tlenek siarki (IV), SO
2 – nieorganiczny związek chemiczny z grupy tlenków siarki, w którym siarka znajduje się na IV stopniu utlenienia. W warunkach normalnych jest to bezbarwny gaz o ostrym, gryzącym i duszącym zapachu, silnie drażniący drogi oddechowe. Jest trujący dla zwierząt i szkodliwy dla roślin. Ma własności bakteriobójcze i pleśniobójcze. Jest produktem ubocznym spalania paliw kopalnych, przez co przyczynia się do zanieczyszczenia atmosfery (smog). Jego wzrost stężenia w powietrzu wpływa na liczbę ostrych zespołów wieńcowych[10]. Stosowany jako konserwant (E220), szczególnie powszechnie do win, także markowych. Dwutlenek siarki wykorzystuje się również do produkcji siarczynów, do bielenia (w przemyśle tekstylnym i papierniczym), dezynfekcji (znany już w starożytności) i jako czynnik chłodniczy. Jest produktem pośrednim podczas produkcji kwasu siarkowego. Rozpuszcza się m.in. w wodzie i acetonie.
Remove ads
Budowa cząsteczki
Podsumowanie
Perspektywa
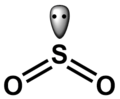
W fazie gazowej cząsteczka SO
2 ma kształt litery V[11]. Oba wiązania siarka–tlen mają długość 143 pm, a kąt między nimi wynosi 119,5°[12]. Atom siarki ma hybrydyzację sp2 i ma jedną wolną parą elektronową[11][13]. Struktury elektronowej cząsteczki SO
2 nie da się przedstawić jednym wzorem Lewisa z oktetem elektronów wokół atomu siarki[14] i cząsteczka bywa przedstawiana za pomocą struktur rezonansowych[13][14][15]:
Jednak długość wiązania siarka–tlen (143 pm) jest bardzo zbliżona do wiązania podwójnego (dS=O = 140 pm) i znacznie mniejsza niż wiązanie pojedyncze (dS−O = 163 pm), a kąt wiązań tlen–siarka–tlen wynosi 119°, wskazując na hybrydyzację sp2[11]. Także z porównania długości i energii wiązań w cząsteczkach SO
2 i SO z izoelektronowymi O
3 i O
2 można wnioskować, że rząd wiązania siarka–tlen w SO
2 wynosi co najmniej 2[16][17][18]:
Zgodnie z tymi informacjami budowę cząsteczki można zobrazować wzorem[17][18][11][19]:
W celu wyjaśnienia takiej struktury cząsteczki przywołuje się czasem udział pustego orbitalu 3d, co jednak jest zbędne[20] i nie znalazło potwierdzenia w modelach teoretycznych[21]. Wiązania siarka–tlen w SO
2 o rzędzie co najmniej 2 tłumaczy natomiast wkład wiązania kowalencyjnego rzędu ok. 1,5 wzmocnionego przez wiązanie jonowe rzędu ok. 1, spowodowanego różnicą elektroujemności atomów S i O[21][17][18]. Ponieważ w cząsteczce ozonu brak jest takich oddziaływań jonowych, ma ona odmienną geometrię, pomimo izoelektronowej struktury[16][11][19].
Remove ads
Charakterystyka chemiczna
Przemysłowo otrzymywany jest przez spalanie siarki[14][16]:
- S + O
2 → SO
2
lub siarkowodoru[16]:
- 2H
2S + 3O
2 → 2SO
2 + 2H
2O
lub podczas prażenia rud siarczkowych w obecności powietrza, np.[14][16]:
- 4FeS
2 + 11O
2 → 2Fe
2O
3 + 8SO
2
W obecności katalizatora (np. V2O5) powstały dwutlenek utlenia się do trójtlenku siarki:
- 2SO
2 + O
2 → 2SO
3
(podobna reakcja zachodzi także w atmosferze z udziałem promieniowania UV lub ozonu)
Dwutlenek siarki dobrze rozpuszcza się w wodzie, dając słaby kwas siarkawy:
- SO
2 + H
2O ⇄ H
2SO
3
Remove ads
Przypisy
Bibliografia
Linki zewnętrzne
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads