minste elementære masseenhet som innehar grunnstoffets egenskaper From Wikipedia, the free encyclopedia
Et atom er en submikroskopisk struktur som ikke kan deles i mindre elementer via kjemiske reaksjoner og beholde sine kjemiske egenskaper. Atomer er bestanddeler i molekyler (kjemiske stoffer). Ordet atom kommer fra det greske ordet atomos som betyr udelelig. Et atoms radius er i området 31 (helium) til 215 (radium) picometer.
| Atom | ||||||||
|---|---|---|---|---|---|---|---|---|
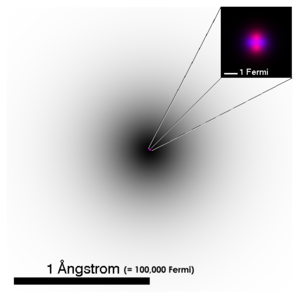 | ||||||||
| Figuren viser en representasjon av strukturen for et heliumatom. | ||||||||
| Klassifisering | ||||||||
| ||||||||
| Egenskaper | ||||||||
|
Tidligere forestillinger om stoffers fysiske struktur var basert på at fysisk deling i stadig mindre biter ville resultere i atomet som minste og udelelige bestanddel. I 1913 presenterte Bohr sin atommodell som deler atomet opp i tre underliggende elementærpartikler:
Kvantemekanikken beskriver nå materiens bølge-partikkel-dualitet og er det matematiske rammeverket for standardmodellen som beskriver krefter og partikler på subatomært nivå. Elementærpartiklene deles nå videre opp i flere typer partikler f.eks kvarker og kraftvirkning mellom partikler f.eks gluoner. Atomære og subatomære partikler kan ikke sees som distinkt avgrensede fysiske objekter, men som en romlig fordeling som angir sannsynligheten for partikkelens energi, utstrekning og posisjon til forskjellig tid. Partiklenes egenskaper er ikke lenger uavhengige, men avhenger av hvilke andre partikler de opptrer i kombinasjon med. Dette betegnes som resonanser eller interaksjoner.
Beskrivelsen av elementærpartikler brukes allikevel som modell for å forklare mange av atomets egenskaper og oppbygning. I figuren over viser den grå skyggen posisjonen for elektronene i 1s orbitalet som et integral over sannsynlighetsfordelingen for bølgefunksjonen langs en siktelinje. Den forstørrede atomkjernen viser tilsvarende for protonene i rødt og nøytronene i blått. I virkeligheten er kjernen for 4He rotasjonssymmetrisk, dette er ikke generelt tilfelle for mer komplekse kjerner.
Atomene er de grunnleggende byggeklossene i kjemien, og bevares ved kjemiske reaksjoner men ikke ved kjernereaksjoner.
Atomets bestanddeler har etter sin kvantemekaniske beskrivelse ingen klar avgrensing, men beskrives som energinivåer i et tredimensjonalt rom etter bølgefunksjonen ψ(x,y,z) som beskrives av Schrödinger-ligningen. Videre kan en partikkel etter uskarphetsrelasjonen befinne seg i en hvilken som helst avstand og retning. Men normalt er det høy sannsynlighet for at partikkelen befinner seg i et avgrenset volum, og det er dette volumet som danner bakgrunn for å angi størrelse, avstand osv.
Atomets størrelse beskriver statistisk radius for det ytterste stabile orbitalet når atomet er i likevekt. For hydrogen er dette radius for 1s orbitalet og benevnes Bohrs radius a0 = 5,3•10−11m. Men dette skal ikke forstås som et uttrykk for hvor stor plass atomet opptar. Faktisk avstand mellom to atomer vil være avhengig av om atomene er bundet eller ikke og med hvilken bindingstype. For eksempel er avstanden mellom H og O i vannmolekylet 9,6•10−11m, mens summen av atomradiene er (5,3+6,0)•10−11m = 11,3•10−11m
Atomkjernen består av protoner og nøytroner som benevnes nukleoner. Antallet protoner bestemmer hvilket grunnstoff atomet er og betegnes med atomnummer Z. Totalt antall nukleoner benevnes A. Antallet nøytroner N = A - Z bestemmer isotopvarianten. Det enkleste atomet er hydrogen som består av ett elektron bundet til ett proton. Et generelt atom av grunnstoffet X kan betegnes ganske enkelt som AX, men oftest mer fullstendig som
Elementærpartiklene i kjernen har en diameter på omkring 1,2•10−15m (Fermi radius r0) eller rundt 1/100 000 del av atomets radius. Kjernens typiske radius er rn = r0 A1/3 og atomet består derfor i stor grad av tomt rom. Forholdsmessig er dette sammenlignbart med størrelse og avstand mellom Solen og dvergplaneten Pluto (selv om partikkelsammenligningen som sådan ikke er holdbar).
Elektronene danner en elektronsky som omgir kjernen. Normalt er atomet nøytralt ved at det har like mange elektroner og protoner. Dersom atomet har et overskudd eller underskudd av elektroner, kalles det henholdsvis et anion (negativt ladd ion) eller et kation (positivt ion). Elektronene har flere energinivåer eller orbitaler. Bindingsenergien for elektronet i det laveste skall i hydrogen er 13,6 eV, og bindingsenergien blir mindre i høyere skall inntil elektronet er fritt og bindingsenergien er null (for hydrogen er EB = 13.6 eV/n2 der n er et naturlig tall som angir skallet.).
Nukleonene er bundet sammen med mye høyere energinivåer, typisk på 100 000 ganger høyere enn elektronbindingen og endres ved kjernefysisk fisjon, fusjon eller radioaktiv nedbrytning. Slike prosesser kalles også transmutasjon og omformer et grunnstoff til et annet.

Elektronene i de høyeste orbitalene har lav bindingsenergi og kan lett frigjøres. De vil derfor utveksles med nærliggende atomer eller deles mellom flere atomer. Orbitalene fylles opp fra laveste nivå, og spesielt antall elektroner i det øverste orbitalet bestemmer mange av atomets kjemiske egenskaper. Ved hjelp av disse mekanismene skapes kjemiske bindinger som danner molekyler og elektronparbundne krystallstrukturer.
Molekylene bygges opp av flere atomer; for eksempel er vann en kombinasjon av to hydrogen og ett oksygen atom (H2O), mens vanlig oksygen i luften er en kombinasjon av to oksygenatomer (O2). Disse har kjemiske egenskaper som ofte er forskjellige fra de grunnstoffene de består av. Molekyler er de minste enhetene som et stoff kan deles i og fremdeles bevare disse kjemiske egenskapene. I noen stoffer er atomene eller molekyler organisert i krystallstrukturer, dvs. at de er organisert i romlige mønstre som gjentas i forskjellige retninger. Krystallet kan bestå av samme eller forskjellige typer atomer og/eller molekyler. En spesiell type krystaller brukes i elektronikk-komponenter der krystallet bygges opp av halvledere med små mengder andre atomer som i stor grad endrer krystallgitterets elektriske egenskaper.
Atomer der ytterste orbital er helt fylt opp, danner vanligvis ikke kjemiske bindinger, og kalles derfor edelgasser. Her vil de enkelte atomene eksistere ubundet. Disse okkuperer gruppe 18 i det periodiske systemet.
I en del stoffer er det ikke noen egentlig molekyl- eller gitterstruktur. Disse har organiseringer uten noen finstruktur på molekylnivå. Dette er tilfellet for eksempel smeltede metaller og amorfe bergarter og mineraler.

Filosofiske funderinger over materiens oppbygning går tilbake til Antikkens Hellas og tidlig indisk kultur omkring 450 f.kr. Demokrit framsatte teorien om at alt kan deles i stadig mindre stykker, inntil man når en nedre grense. De minste udelelige stykkene kalte han for atomer som betød udelelig. Disse ideene gikk senere tapt og ble først gjenoppdaget nesten 2000 år senere, i forbindelse med ny interesse for naturvitenskap under renessansen.
John Dalton brukte i 1803 ideen om atomet for å forklare hvorfor grunnstoffene alltid reagerer i samme forhold, og hvorfor noen gasser løses bedre i vann enn andre. Han framsatte hypotesen at hvert grunnstoff består av atomer av en fast unik type, og at disse forenes og danner sammensatte kjemiske stoffer.
I 1897 oppdaget JJ Thomson elektronet som et resultat av arbeid med katodestråler. Dette viste at atomet kan deles i mindre enheter. Senere oppdaget Thomson eksistensen av isotoper gjennom arbeidet med ioniserte gasser. Thomson antok at elektronene var jevnt fordelt i et atom med en utstrakt positiv ladning som gjør atomet nøytralt. Denne beskrivelsen blir vanligvis omtalt som rosinbollemodellen eller "plum pudding modell" på engelsk.
Men i 1909 viste Rutherfords gullfolieeksperiment at atomets positive ladning og størstedelen av massen trolig er samlet i en atomkjerne, og at elektronene sirkler rundt denne som planeter rundt sola. Rutherfords atommodell ble framsatt i 1911, men allerede i 1913 presenterte Niels Bohr sin atommodell som innførte kvantebegrepet. Elektronene ble nå kvantifisert i klart definerte baner og kunne ikke lenger spiralisere inn og ut.
I 1926 foreslo Erwin Schrödinger at elektronene oppførte seg som bølger. Som en følge av dette viste Werner Heisenberg et år senere at det ikke er matematisk mulig å måle en partikkels tilstand (posisjon og moment) til en gitt tid helt nøyaktig. Dette usikkerhetsprinsippet medførte at Bohrs atommodell ble erstattet med en beskrivelse der det ikke er mulig å angi elektronenes posisjoner, kun sannsynligheten for at de befinner seg innen visse soner.
Fra tidlig på 1970-tallet har standardmodellen gitt en samlet beskrivelse av elementærpartikler og krefter på subatomært nivå. Den har gitt en rekke teoretiske forutsigelser som senere er blitt eksperimentelt verifisert med høy nøyaktighet. Teorien har imidlertid fortsatt en rekke svakheter som at den inneholder mange eksperimentelt bestemte (ikke beregnede) konstanter, og at den ikke inkluderer gravitasjon.

Inntil 1961 ble atomet antatt å bestå bare av elektroner, nøytroner og protoner. Standardmodellen som ble utviklet tidlig på 1970-tallet, beskriver de partikler og krefter som bygger opp subatomære partikler. Kvarker kommer i 3 par (6 varianter) med ladning henholdsvis +2/3 og −1/3 og spinn ½. De forekommer ikke fritt, men er alltid bundet sammen i baryoner med 3 kvarker som får ½ heltalls spinn og mesoner med 2 kvarker og heltalls spinn. Elektronet sammen med partikler som positroner og nøytrinoer er leptoner og påvirkes ikke av den sterke kjernekraften. Familiene leptoner og bosoner er begge fermioner som er partikler med ½ heltalls spinn.
Protonene og nøytronene er baryoner og bygges opp av u (opp) og d (ned) kvarker som har såkalt fargeladning i tillegg til at de har elektrisk ladning. Protonet får med kombinasjonen (uud) en positiv elektrisk elementærladning mens nøytronet med (udd) blir elektrisk nøytralt. Kvarkene holdes sammen av den såkalte fargekraften formidlet av gluoner som er vekselvirkningsbosoner. Størstedelen av energien i nøytronet og protonet kommer ikke fra opp ned kvarkene (med 4 og 8 MeV) men ligger i bindingsenergien som gir dem masser på respektive 938,3 og 939,6 MeV. Protonene og nøytronene er fargenøytrale. Men fargeladningen er ujevnt fordelt i dem slik den elektriske ladningen er ujevnt fordelt i molekyler. På tilsvarende måte som det gir opphav til bindingskrefter mellom molekyler, gir den ujevne fordelingen av fargeladning i protonene og nøytronene opphav til sterk kjernekraft eller nukleon-til-nukleon-kraften som holder atomkjernene sammen, til tross for den elektriske frastøtningen mellom protonene.
Fotoner er masseløse elektromagnetiske bølger (partikler) med heltalls spinn som formidler den elektromagnetiske kraften. Denne virker mellom elektronet og kjernen og sammen med elektronets bølgenatur dannes orbitalene.
Atomkjernene er omgitt av elektrontåker, og det er primært disse tåkene som bestemmer hvordan atomene virker på hverandre og hvilke kjemiske bindinger som oppstår. Disse tåkene representerer sannsynlighetsfordelinger for elektronene og deles opp i orbitaler som tilsvarer faste energinivåer for elektronene. Disse orbitalene kalles også elektronskall. Hvert orbital har bare plass til et bestemt antall elektroner fordi alle elektronene i samme atom må befinne seg i forskjellig kvantemekanisk tilstand (for elektronet er dette kombinasjonen av hoved-, bi- magnetisk- og spinn-kvantetall etter bestemte regler). Orbitalene øker i størrelse og kompleksitet med økende energinivå inntil elektronet er ionisert og dermed frigjort fra kjernen.

Elektronene kan i prinsippet befinne seg i et hvilket som helst orbital, men vil i grunntilstanden fylle opp orbitalene fra laveste (innerste) nivå. Et eksitert elektron befinner seg i et høyere orbital enn grunntilstanden, og vil raskt falle tilbake til en ledig plass i et lavere orbital og avgi energien i form av et foton.
Elektronene i ytterste "befolkede" skall i grunntilstanden kalles valenselektroner og bestemmer i vesentlig grad hvordan elektronet forbinder seg kjemisk med andre atomer. Generelt vil atomene som bindes sammen, dele på et eller flere elektroner i ytterste skall. Atomene søker å fylle opp dette skallet. I vann (H2O) er hydrogenets ytterste skall 1s1 og kan derfor avgi eller ta opp et elektron. Oksygen har ytterste skall 2p4 som kan avgi 4 eller ta opp 2 elektroner. Oksygenet kan derfor dele på et elektron fra hvert hydrogenatom for å fylle sitt ytterste skall, og hydrogenet dele et elektron med oksygenet for å fylle sitt. I hydrogengass (H2) vil begge hydrogenatomene fylle 1s skallet ved å dele på de to elektronene. Edelgassene har alle fullt ytterste skall og reagerer derfor vanskelig med andre stoffer.
Atomene plasseres i Grupper og Perioder i det periodiske system, der perioden tilsvarer antall orbitaler eller elektronskall, og antall ledige plasser i ytterste skall faller fra venstre mot høyre i gruppen. På denne måten viser man grunnstoffer med beslektede egenskaper nær hverandre.
Elektronene i skallene innenfor kalles kjerneelektronene og hovedeffekten av disse kommer i form av skjerming av kjernens positive ladning. Dette avgjør deler av atomets elektronegativitet og bestemmer evnen til å tiltrekke felles elektroner i en binding mellom flere atomer. Elektronegativteten øker med antall elektroner i ytterste skall, og minker med antall kjerneelektroner.
Dersom forskjellen i elektronegativitet er mindre enn 0.4 trekker atomene omtrent like mye på elektronene og disse vil fordele seg jevnt mellom atomene. Dette kalles en kovalent binding og opptrer for eksempel i vanlige gasser som O2, H2 og N2
Ved forskjell større enn 1,4 får man en ionebinding. Atomet med høyest elektronegativitet vil tiltrekke seg de fleste elektronene og bli mer negativt ladet. Samtidig trekkes elektroner fra de (det) andre atomene, noe som reduserer skjermingen av kjernen og gir positiv ladning. Slike molekyler er dipoler og organiserer seg i retningsorienterte strukturer med positive ender mot negative ender. Et eksempel er vanlig salt (NaCl) som vist i krystallgitteret tidligere.
Ved forskjell mellom 0,4 og 1,7 oppstår en polar kovalent binding. Spesielt dersom noen av atomene er hydrogenatomer er denne viktig ettersom protonkjernen lett blir avskjermet og derfor danner hydrogenbindinger til elektronegative atomer i andre eller samme molekyl, noe som gir opphav til spesielle egenskaper. Dette er for eksempel tilfelle i vann (H2O) og mer komplekse organiske molekyler som proteiner, DNA og polysakkarider. Proteiner har forskjellige egenskaper etter hvordan de er «kveilet opp» og denne strukturen stabiliseres av hydrogenbindingene.
Fargekraften binder kvarker sammen og bygger opp nukleoner som protoner og nøytroner som danner atomkjerner. Atomkjernen har en størrelse på rn = r0 A1/3 der r0 = 1,2×10−15m.
Fargekraften mellom kvarkene i protonene og nøytronene har en residuell kraft (sterk kjernekraft) som binder de enkelte nukleoner i atomkjernen sammen. Den faller meget raskt av på avstander over 1,4•10−15m og binder i det vesentlige nukleonet til dets nærmeste naboer. Den elektromagnetiske kraften har lang rekkevidde og får vesentlige bidrag fra alle protoner i kjernen. Ved høyere atomnummer kreves derfor relativt flere nøytroner (noe som styrker den sterke kjernekraften i atomkjernen) for å holde kjernen sammen og skape balanse mellom disse kreftene.
Forskjellige isotoper kan derfor være ustabile og endre antall nukleoner ved kjernereaksjoner som radioaktiv nedbrytning eller spaltning (kjernefysisk fisjon). Når dette skjer spontant kalles det radioaktivitet og har en karakteristisk halveringstid som beskriver gjennomsnittlig tid før halvparten av atomene i et utvalg er spaltet. Dette kan skje på forskjellige måter:
Kjernefysiske reakjoner kan også fremkalles ved hjelp av partikler med høy energi (nukleoner, elektroner eller fotoner). De foregår også ved at to kjerner smelter sammen ved kjernefysisk fusjon og når et proton tilføres energi og går over til et nøytron ved svak vekselvirkning.
 Atomenes størrelse er omkring 1/1000 av bølgelengden for synlig lys. Derfor kan ikke atomer observeres direkte i optiske instrumenter. Men atomenes struktur på overflaten av en tynn film kan registreres for eksempel med skannende tunnelerende mikroskop (STM), ved nukleær magnetisk resonans (NMR) og i røntgenstrålemikroskop.
Atomenes størrelse er omkring 1/1000 av bølgelengden for synlig lys. Derfor kan ikke atomer observeres direkte i optiske instrumenter. Men atomenes struktur på overflaten av en tynn film kan registreres for eksempel med skannende tunnelerende mikroskop (STM), ved nukleær magnetisk resonans (NMR) og i røntgenstrålemikroskop.
Fordi elektronskyen som omgir kjernen ikke har noen skarp avgrensning, er størrelsen på atomet et definisjonsspørsmål. Tall fra ulike kilder er ikke nødvendigvis sammenlignbare uten nærmere definisjon. Vanlige størrelser som oppgis er (generelt i stigende rekkefølge):
Basert på det som er beskrevet over har karbon(12C) en kjernestørrelse på ~2,8•10−15m mens kovalent radius er 7,0•10−11m eller en faktor 25 000 ganger større. Dette tilsvarer omtrent en ert (8 mm) i midten av et fotballstadion (200 m).
Elektronets klassiske radius er også ~2,8•10−15m, der elektronets størrelse er basert på elektromagnetisk energitetthet. I dag betraktes imidlertid elektronet kvantemekanisk som en punktladning uten definert utstrekning.
Atomkjernen har omtrent hele atomets masse, for 12C er massen ~2,0•10−26kg konsentrert innen et volum på ~9,2•10−44m³. Spesifikk vekt for kjernen er derfor ~2,2•1017kg/m³. Nøytronstjerner kan oppnå en slik pakketetthet når kjernen kollapser etter visse typer supernovaer.
Atommassen oppgis ofte i atommasseenheten u og stoffmengde i mol. Disse enhetene baseres på 12C som standard; 1 u er 1/12 av massen for 12C, og 1 mol er antall karbonatomer i 12 gram 12C, som er Avogadros tall 6,0221415•1023. Generelt er 1 mol av et stoff X gram når atomvekten i atommasseenheter er X.
Atomets radius står i liten grad i forhold til atommassen. Atomer med høyere atomnummer har høyere ladning i kjernen, og vil pakke elektronskyen tettere, noe som medfører at orbitalenes radius reduseres. Størrelsen har et gjennomsnitt på ~140 picometer (pm) for alle atomer, og med unntak av periode 1 og 2 ligger de aller fleste grunnstoffer i området 110-215 pm. Aluminium med atomvekt 27u har kovalent radius 118 pm. Iridium har omtrent samme radius (137 pm) men atommasse 192u, og dette forklarer i stor grad forskjellen i tetthet mellom aluminium (2700 kg/m³) og Iridum som har den høyeste tetthet av grunnstoffene med 22650 kg/m³.
Temperaturen i en samling atomer er et mål på midlere kinetisk energi (bevegelsesengergi) for atomene, utover den kvantemekaniske bevegelse som følger av usikkerhetsprinsippet. Midlere hastighet øker fra null ved 0 K til omkring 500 m/s ved romtemperatur. Bevegelsene er imidlertid uregelmessige Brownske bevegelser og fører ikke til netto forflytning av atomene.
Atomer med samme atomnummer Z har en lang rekke fysiske egenskaper til felles, og oppviser tilnærmet like kjemiske egenskaper. Derfor klassifiserer man alle atomer med samme antall protoner i kjernen og dermed samme atomnummer som samme grunnstoff. For eksempel vil alle atomer med seks protoner i kjernen (Z = 6) klassifiseres som karbon.
Massetallet A gir antallet nukleoner i atomkjernen, dvs. summen av protoner og nøytroner. Den er sammenlignbar med atommassen i atommasseenheter. Et spesifikt sett nukleoner med Z protoner og A-Z nøytroner kalles en nuklide.
Et grunnstoff kan ha flere forskjellige nuklider, alle med samme atomnummer Z (antall protoner og elektroner), men forskjellig antall nøytroner. Dette settet av nuklider kalles isotoper av grunnstoffet. Isotop betyr «samme sted», fordi de har samme kjemiske symbol og plass i det periodiske system. 14C eller Karbon-14 er en slik isotop av karbon og har 6 protoner og 8 nøytroner i kjernen, som gir massetall 14. Isotoptabellen viser alle kjente isotoper av grunnstoffene. Atommassen som oppgis er et snitt av isotopmassen for alle isotoper veiet etter deres relative vanlighet i naturen.
Det enkleste atomet er protium, den vanligste isotopen av løse hydrogener, med bare ett proton og ett elektron. Hydrogen med ett proton og ett nøytron kalles deuterium, mens tritium har ett proton og to nøytroner. Tritium er radioaktivt og har en halveringstid på 12.23 år og går da over til helium isotopen 3He samt et elektron og et elektron antinøytrino som alle er stabile. Mange isotoper er radioaktive, og antall stabile isotoper varierer sterkt fra grunnstoff til grunnstoff. Tinn (Sn, Z=50) har 10 stabile isotoper, mens Bly (Pb, Z=82) er det høyeste atomnummeret som har stabile isotoper. Høyere atomnummer Z≥83 har ingen stabile isotoper og er alle radioaktive.
De fleste atomer som er lettere enn uran (U, Z=92) har ett eller flere isotoper med lang nok levetid til å finnes på jorden. Noen unntak er technetium (Tc, Z=43) og Promethium (Pm, Z=61) som kun kan identifiseres i stjerner der de nylig er blitt syntetisert. Dette gjelder også transuraner, dvs. tyngre atomer enn uran med kort levetid.
Flere tyngre atomer som ikke forekommer naturlig har blitt framstilt ved bombardering av andre kjerner med høy energi. Nye grunnstoffer har blitt skapt på denne måten opp til atomnummer 116, med foreløpig navn ununhexium. (Nedbrytningsprodukter av ununoctium, Z=118 har også blitt observert) [1] Slike tunge grunnstoffer er svært ustabile og nedbrytes raskt.
Etter Big Bang besto vanlig masse i universet av 76 % hydrogen og 24 % helium, og mindre enn 1 % av noen få andre lette atomer. Alle andre grunnstoffer er dannet senere ved nukleosyntese i stjerner og supernovaer. Solen er en 3 generasjons stjerne, og solsystemet inneholder stoffer etter to tidligere generasjoner stjerner og har derfor en viss mengde tyngre grunnstoffer.
Atomene kan avgi eller oppta elektroner. Når antall elektroner er forskjellig fra antallet protoner i kjernen er atomet ikke elektrisk nøytralt. Atomer med underskudd på elektroner er positivt ladd og kalles kationer fordi de vil trekkes mot katoden (negativ elektrode). Når det er overskudd på elektroner er ladningen negativ, og ionet er et anion, navnet kommer fordi de trekkes mot den positive anoden.

Hvert grunnstoff har et spesifikt sett orbitaler for sin elektronkonfigurasjon. Disse orbitalene har energinivåer og sprang mellom disse energinivåene som er unike for samme grunnstoff og forskjellig for ulike atomnummere. Når et elektron eksiteres, dvs. tilføres energi fra et foton og går til et ledig høyere orbital vil dette kreve en fast energimengde som er lik energispranget mellom disse orbitalene. Atomer i et høyere orbital vil raskt gå til et lavere orbital dersom dette har en ledig plass, og vil da tilsvarende avgi et foton med en energi lik energispranget mellom orbitalene. Fotonets energi tilsvarer en spesifikk frekvens og bølgelende (=farge i det synlige området).
Hvert grunnstoff får på denne måten et unikt sett av bølgelengder som kan absorberes eller emitteres. Ved spektroskopi brukes dette ved at en prøvetagning bestråles fra en intensiv lyskilde. Elektronene vil da eksiteres, og når disse eller andre elektroner inntar den lavere ledige posisjonen avgis fotoner. Det resulterende emisjonsspekteret brukes til å analysere hvilke grunnstoffer som er tilstede og deres relative mengder.
Tilsvarende vil atomer som gjennomlyses med et kontinuerlig spektrum, vise et absorpsjonsspekter med mørke linjer tilsvarende kvantesprangene. Lys fra stjerner (og solen) som passerer gjennom stjernens fotosfære, interstellare gasståker eller planeters atmosfære vil kunne vise deres kjemiske sammensetning på denne måten. Stjernene selv er optisk opake til fotosfæren (den lysende solskiven) og lyset emitteres, absorberes og reemitteres derfor i mange omganger. Selve stjernens spektrum er derfor kontinuerlig. Linjene vil ofte være forskjøvet i spekteret på grunn av høy relativ hastighet eller universets ekspansjon og kan derfor gi ytterligere informasjon om dette.
Energinivåene finner man i hele det elektromagnetiske spektrum fra lav energi radiobølger til høyenergi røntgenstråling. Lave energinivåer oppstår ved små energisprang i høyere orbitaler eller i spinn som den viktige Hydrogenlinjen ved 0,21 m (1420,40575 MHz). Høyenergifotoner oppstår i tunge atomer når posisjoner i lave orbitaler frigjøres ved at elektronene eksiteres for eksempel av betastråling og elektroner fra høye orbitaler tar deres plass.
Noen eksempler som viser atomets størrelse:
Seamless Wikipedia browsing. On steroids.