ამონიუმის ქლორიდი
From Wikipedia, the free encyclopedia
Remove ads
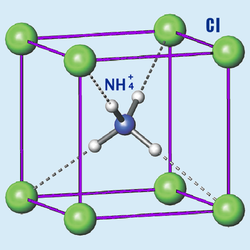
ამონიუმის ქლორიდი — არაორგანული ნივთიერება ქიმიური ფორმულით NH4Cl. არის თეთრი, კრისტალური მარილი, რომელიც წყალში ძალიან კარგად იხსნება. ძირითადად გამოიყენება როგორც სასუქი და არომატიზატორი ზოგიერთ ლიქიორში. ამონიუმის ქლორიდი მიიღება ქლორწყალბადმჟავისა და ამიაკის ურთიერთქმედებით.
Remove ads
წარმოება
- ამონიუმის ქლორიდი არის პროდუქტი „ამიაკ-სოდა პროცესის“ რეაქციისა, რომლითაც იღებენ ნატრიუმის კარბონატს:[2]
- CO2 + 2 NH3 + 2 NaCl + H2O → 2 NH4Cl + Na2CO3
გარდა იმისა, რომ ეს ამონიუმის ქლორიდის წარმოების ძირითადი მეთოდია, ეს მეთოდი გამოიყენება ზოგიერთ სამრეწველო ოპერაციაში ამიაკისგან განსათავისუფლებლად.
- ამონიუმის ქლორიდი ასევე მიიღება ამიაკის წყალბადის ქლორიდთან (აირი) ან ქლორწყალბადმჟავასთან(წყალხსნარი) რეაქციისას:[2]
- NH3 + HCl → NH4Cl
- ამონიუმის ქლორიდი ბუნებრივი სახით გავრცელებულია ვულკანურ რეგიონებში, ფორმირდება ვულკანურ ქვებში ფუმაროლებთან ახლოს. მისი მოლეკულები აირად ფაზაში დიდხანს ვერ არსებობენ, რადგან ისინი მარტივად იხსნებიან წყალში[3].
Remove ads
რეაქციები
- ამონიუმის ქლორიდი გაცხელებით იშლება ამიაკად და წყალბადის ქლორიდად:[2]
- NH4Cl → NH3 + HCl
- ამონიუმის ქლორიდი ურთიერთქმედებს ძლიერ ტუტეებთან როგორიცაა ნატრიუმის ჰიდროქსიდი და მიიღება აირადი ამიაკი.
- 2 NH4Cl + Na2CO3 → 2 NaCl + CO2 + H2O + 2 NH3
- ამონიუმის ქლორიდი მაღალ ტემპერატურაზე რეაქციაში შედის ტუტე ლითონების კარბონატებთან, მიიღება ამიაკი და ტუტე ლითონის ქლორიდი
- 2 NH4Cl + Na2CO3 → 2 NaCl + CO2 + H2O + 2 NH3
- ზოგიერთი ამონიუმის ქლორიდის რეაქცია სხვა ქიმიკატებთან ენდოთერმულია, როგორც ბარიუმის ჰიდროქსიდის შემთხვევაში.
Remove ads
სქოლიო
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads