Acido 4-idrossicinnamico
composto chimico Da Wikipedia, l'enciclopedia libera
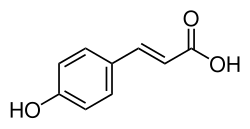
L'acido 4-idrossicinnamico o acido p-cumarico o 4-cumarato, in sigla dall'inglese 4HCA, è un acido fenolico con formula empirica C9H8O3. È il para isomero dell'acido cumarico con la struttura dell'acido cinnamico, in configurazione trans, e un gruppo idrossile sostituente in posizione 4 dell'anello benzenico. Essendo l'isomero dell'acido cumarico più abbondante in natura è spesso indicato impropriamente come acido cumarico. Esiste anche un meno comune stereoisomero cis-4-. L'acido 4-idrossicinnamico esiste in tutte le specie viventi, dai batteri all'uomo; nell'uomo può essere rilevato nel sangue, urina, feci.[1] Per la sua ampia diffusione è nominato con decine di diversi sinonimi compresi: acido naringeninico, acido 3-(4-idrossifenil)acrilico, acido (E)-p-cumarico, ecc..
| Acido 4-idrossicinnamico | |
|---|---|
 | |
| Nome IUPAC | |
| acido (E)-3-(4-idrossifenil)prop-2-enoico | |
| Nomi alternativi | |
| acido trans-p-idrossicinnamico;p-cumarato; acido paracumarico; 4-idrossicinnamato | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C9H8O3 |
| Massa molecolare (u) | 164,16 g/mol |
| Numero CAS | |
| Numero EINECS | 610-511-6 |
| PubChem | 637542 |
| DrugBank | DBDB04066 |
| SMILES | C1=CC(=CC=C1C=CC(=O)O)O |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | 1,02 mg/mL |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 315 - 317 - 319 - 335 |
| Consigli P | 261 - P260 - P264 - P270 - P271 - P272 - P280 - P301+P310 - P301+P312 - P301+P330+P331 - P302+P352 - P303+P361+P353 - P304+P340 - P305+P351+P338 |
È un solido cristallino leggermente solubile in acqua, ma ben solubile in etanolo ed etere dietilico.
Occorrenza in natura
Riepilogo
Prospettiva
| Concentrazione (mg/100g)
negli alimenti[2] | |
|---|---|
| Peperoncino | 54,00 |
| Ananas | 53,00 |
| Girasole | 50,55 |
| Curcuma | 34,50 |
| Basilico | 25,33 |
| Timo | 16,05 |
| Spinaci | 13,30 |
| Ossicocco | 13,23 |
| Noce | 12,78 |
| Mirtillo rosso | 9,72 |
| Ravanello | 9,10 |
| Chiodi di garofano | 8,49 |
Presente anche a livello subcellulare nei mitocondri e citoplasma[1], l'acido 4-idrossicinnamico è stato isolato in molte specie di diverse famiglie di piante: Asteraceae (Helianthus tuberosus, Taraxacum formosanum), Brassicaceae ( Wasabia japonica ), Crassulaceae (Rhodiola sachalinensis), Fabaceae ( Medicago sativa, Phaseolus aureus, Pisum sativum ), Labiatae ( Salvia officinalis, Scutellaria albida), Piperaceae (Peperomia duclouxii ), Vittariaceae (Vittaria anguste-elongata).[3]
Il 4HCA è stato isolato in molti funghi: Agaricus Bisporus, Coprinus Comatus, Cordyceps Sinensis, Ganoderma Applanatum, Pleurotus Eryngii, Pleurotus Ostreatus, Sparassis Crispa[4]
In natura il 4HCA si trova più frequentemente legato sotto forma di glicosidi o esteri piuttosto che in forma libera.[5][6]
Ridotto a alcole p-cumarico Insieme all'alcool sinapilico e all'alcool coniferilico, l'acido p-cumarico è un componente importante della lignina.
La presenza in tanti vegetali comporta la presenza anche nelle loro parti o derivati edibili. L'acido 4-idrossicinnamico si trova a concentrazioni significative all'interno di pochi cibi diversi alcuni dei quali riportati nella tabella a fianco.
Si trova anche nell'orzo[7], nel vino e nell'aceto.[8] Può essere trasferito dai pollini al miele.[9] L'acido 4-idrossicinnamico è stato anche rilevato, ma non quantificato, in molti altri alimenti.
Anche l'isomero cis-p-cumarico è stato rilevato in natura, ad esempio a concentrazioni relativamente alte (144 mg/100g) nel coriandolo.[10]
Metabolismo
Riepilogo
Prospettiva
In varie specie viventi, sono state individuate varie reazioni biochimiche di sintesi (anabolismo) e di degradazione (catabolismo) del 4HCA. È inoltre substrato o intermedio in molte reazioni biochimiche che avvengono in natura nella cosiddetta via dei fenilpropanoidi, che porta alla formazione di cumarine, flavonoidi, stilbenoidi, lignani, monolignoli.
| Enzima | Reazione |
|---|---|
| L-tirosina ammonia-liasi[11] | L-tirosina ⇄ 4HCA + ammoniaca |
| 4-cumarato:CoA ligasi[12] | ATP + 4HCA+ CoA ⇄ AMP + difosfato + 4-coumaroil-CoA |
| trans-cinnamato 4-monoossigenasi[13] | trans-cinnamato + [NADPH-emoproteina reduttasi]+ + O2 ⇄ 4HCA+ [NADP+-emoproteina reduttasi] + H2O |
| monofenolo monoossigenasi[14] | 4HCA+ O2 + caffeato ⇄ caffeato + H2O + caffeoquinone |
| idrossicinnamato 4-beta-glucosiltransferasi[15] | UDPG + 4HCA⇄ UDP + 4-O-beta-D-Glucosil-4-idrossicinnamato |
| acido fenilacrilico decarbossilasi[16] | 4HCA⇄ 4-idrossistirene + CO2 |
| 4-cumarato 3-idrossilasi | 4HCA⇄ caffeato[17] |
| idrossicinnamoil glucosiltransferasi[15] | UDPG+ 4HCA⇄ UDP + p-Coumaroil-D-glucosio |
| (E)-4-coumaroil-CoA:(R)-3-(4-idrossifenil)lattato CoA-transferasi[18] | p-Coumaroil-CoA + (R)-3-(4-idrossifenil)lattato ⇄ 4HCA+ (R)-3-(4-idrossifenil)lattoil-CoA |
| 3-(aril)acrilate reduttasi[19] | floretato + flavoproteina (trasferente elettroni)⇄ 4HCA+ flavoproteina (trasferente elettroni) ridotta |

L'acido p- cumarico è il precursore del 4-etilfenolo prodotto dal lievito Brettanomyces nel vino o nella birra. L'enzima fenilacrilato decarbossilasi[16] catalizza la conversione dell'acido p- cumarico in 4-vinilfenolo. Vinil fenolo riduttasi catalizza quindi la riduzione del 4-vinilfenolo a 4-etilfenolo. L'acido cumarico viene talvolta aggiunto ai terreni microbiologici, consentendo l'identificazione positiva di Brettanomyces all'olfatto.
Per saturazione del doppio legame della catena 2-propenoica si forma acido floretico, che si trova nel rumine delle pecore alimentate con erba, mentre per idrossilazione e metossilazione in posizione 3 dell'anello benzenico si formano rispettivamente acido caffeico e ferulico. L'acido caffeico, ferulico, floretico sono precursori di decine di altre reazioni biochimiche. L'isomero cis-p-cumarico prodotto per isomerizzazione trans-cis può essere un intermedio nella ciclizzazione interna da cui derivano le cumarine.
Applicazioni
Il 4HCA ha proprietà antiossidanti e può avere un ruolo nel ridurre il rischio di cancro allo stomaco riducendo la formazione di nitrosammine, cancerogene.[20][21]
Note
Voci correlate
Altri progetti
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

