Loading AI tools
unsur kimia dengan lambang Tc dan nomor atom 43 Dari Wikipedia, ensiklopedia bebas
Teknesium adalah sebuah unsur kimia dengan lambang Tc dan nomor atom 43. Ia adalah unsur paling ringan yang semua isotopnya bersifat radioaktif. Semua teknesium yang tersedia diproduksi sebagai unsur sintetis. Teknesium alami adalah produk fisi spontan dalam bijih uranium dan bijih torium, sumbernya yang paling umum, atau produk penangkapan neutron dalam bijih molibdenum. Logam transisi kristalin berwarna abu-abu keperakan ini berada di antara mangan dan renium pada golongan 7 tabel periodik, dan sifat kimianya merupakan intermediat antara kedua unsur yang berdekatan. Isotop alami yang paling umum adalah 99Tc, hanya dalam jumlah renik.
43Tc Teknesium | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Sampel teknesium di dalam ampul kaca tertutup, diisi dengan gas argon | |||||||||||||||||||||||||||||||||||||||||||||||||||
Garis spektrum teknesium | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengucapan | /tèknèsium/ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Penampilan | logam abu-abu berkilauan | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Teknesium dalam tabel periodik | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 43 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | periode 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | blok-d | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | logam transisi | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor massa | [97] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Kr] 4d5 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 13, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 2430 K (2157 °C, 3915 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik didih | 4538 K (4265 °C, 7709 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Kepadatan mendekati s.k. | 11 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 33,29 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 585,2 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 24,27 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||
Tekanan uap (diekstrapolasi)
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | −3, −1, 0, +1,[1] +2, +3,[1] +4, +5, +6, +7 (oksida asam kuat) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,9 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 702 kJ/mol ke-2: 1470 kJ/mol ke-3: 2850 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 136 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 147±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | dari peluruhan | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | susunan padat heksagon (hcp) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Kecepatan suara batang ringan | 16.200 m/s (suhu 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekspansi kalor | 7,1 µm/(m·K)[2] (pada s.k.) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 50,6 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Arah magnet | paramagnetik | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | +270,0×10−6 cm3/mol (298 K)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7440-26-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Prediksi | D. Mendeleev (1871) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuan dan isolasi pertama | E. Segrè dan C. Perrier (1937) | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop teknesium yang utama | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Banyak sifat teknesium telah diprediksi oleh Dmitri Mendeleev sebelum ia ditemukan. Mendeleev menyadari bahwa ada celah dalam tabel periodiknya dan memberi unsur yang belum ditemukan itu nama sementara ekamangan (Em). Pada tahun 1937, teknesium (khususnya isotop teknesium-97) menjadi unsur buatan pertama yang diproduksi, sehingga menjadi asal namanya (dari bahasa Yunani τεχνητός, technetos, dari techne, seperti dalam "kerajinan", "seni" dan memiliki arti "buatan", + -ium).
Satu isomer nuklir pemancar sinar gama berumur pendek, teknesium-99m, digunakan dalam kedokteran nuklir untuk berbagai macam tes, seperti diagnosis kanker tulang. Keadaan dasar nuklida itu, teknesium-99, digunakan sebagai sumber partikel beta bebas sinar gama. Isotop teknesium berumur panjang yang diproduksi secara komersial adalah produk sampingan dari fisi uranium-235 dalam reaktor nuklir dan diekstraksi dari batang bahan bakar nuklir. Karena isotop teknesium yang paling lama hidup pun memiliki waktu paruh yang relatif singkat (4,21 juta tahun), deteksi teknesium dalam raksasa merah pada tahun 1952 membantu membuktikan bahwa bintang dapat menghasilkan unsur yang lebih berat.
Dari tahun 1860-an hingga 1871, bentuk awal tabel periodik yang diusulkan oleh Dmitri Mendeleev berisi celah antara molibdenum (unsur 42) dan rutenium (unsur 44). Pada tahun 1871, Mendeleev meramalkan unsur yang hilang ini akan menempati tempat kosong di bawah mangan dan memiliki sifat kimia yang serupa. Mendeleev memberinya nama sementara ekamangan (dari eka-, kata Sanskerta untuk "satu") karena unsur yang diprediksi ini berada satu tingkat di bawah unsur mangan yang telah diketahui.[4]
Banyak peneliti awal, baik sebelum maupun sesudah tabel periodik diterbitkan, sangat ingin menjadi yang pertama menemukan dan menamai unsur yang hilang tersebut. Lokasinya di tabel periodik membuatnya seperti lebih mudah ditemukan daripada unsur lain yang belum ditemukan.
| Tahun | Pengklaim | Nama yang disarankan | Bahan sebenarnya |
|---|---|---|---|
| 1828 | Gottfried Osann | Polinium | Iridium |
| 1846 | R. Hermann | Ilmenium | Paduan niobium–tantalum |
| 1847 | Heinrich Rose | Pelopium[5] | Paduan niobium–tantalum |
| 1877 | Serge Kern | Davyum | Paduan iridium–rodium–besi |
| 1896 | Prosper Barrière | Lucium | Itrium |
| 1908 | Masataka Ogawa | Nipponium | Mungin renium, yang merupakan dwi-mangan yang belum diketahui,[6] meskipun buktinya tidak cukup meyakinkan[7] |

Kimiawan Jerman Walter Noddack, Otto Berg, dan Ida Tacke melaporkan penemuan unsur 75 dan unsur 43 pada tahun 1925, dan menamai unsur 43 dengan masurium (dari Masuria di Prusia timur, sekarang di Polandia, wilayah asal keluarga Walter Noddack).[8] Nama ini menimbulkan kebencian yang signifikan dalam komunitas ilmiah, karena diartikan mengacu pada kemenangan tentara Jerman atas tentara Rusia di wilayah Masuria selama Perang Dunia I; karena Noddack tetap dalam posisi akademis mereka saat Nazi berkuasa, kecurigaan dan permusuhan terhadap klaim mereka atas penemuan unsur 43 terus berlanjut.[7] Grup tersebut membombardir kolumbit dengan seberkas elektron dan menyimpulkan bahwa unsur 43 hadir dengan memeriksa spektogram emisi sinar-X mereka.[9] Panjang gelombang sinar-X yang dihasilkan dikaitkan dengan nomor atom dengan sebuah rumus yang diturunkan oleh Henry Moseley pada tahun 1913. Grup itu mengklaim telah mendeteksi sinyal sinar-X yang samar pada panjang gelombang yang dihasilkan oleh unsur 43. Eksperimen selanjutnya tidak dapat mereplikasi penemuan tersebut, dan eksperimen itu diberhentikan sebagai kesalahan.[10][11] Namun, pada tahun 1933, serangkaian artikel tentang penemuan unsur mengutip nama masurium untuk unsur 43.[12] Beberapa upaya yang lebih baru telah dilakukan untuk merehabilitasi klaim Noddacks, tetapi mereka dibantah oleh studi Paul Kuroda tentang jumlah teknesium yang bisa saja ada dalam bijih yang mereka pelajari: tidak mungkin melebihi 3 × 10−11 μg/kg bijih, dan karenanya tidak terdeteksi oleh metode Noddacks.[7][13]
Penemuan unsur 43 akhirnya dikonfirmasi dalam sebuah eksperimen tahun 1937 di Universitas Palermo di Sisilia oleh Carlo Perrier dan Emilio Segrè.[14] Pada pertengahan 1936, Segrè mengunjungi Amerika Serikat, pertama ke Universitas Columbia di New York dan kemudian ke Laboratorium Nasional Lawrence Berkeley di California. Dia membujuk penemu siklotron Ernest Lawrence untuk membiarkan dia mengambil kembali beberapa bagian siklotron bekas yang telah menjadi radioaktif. Lawrence mengirimkannya foil molibdenum yang telah menjadi bagian dari deflektor pada siklotron.[15]
Segrè meminta rekannya Perrier untuk mencoba membuktikan, melalui kimia komparatif, bahwa aktivitas molibdenum memang berasal dari unsur dengan nomor atom 43. Pada tahun 1937, mereka berhasil mengisolasi isotop teknesium-95m dan teknesium-97.[16][17] Pejabat Universitas Palermo ingin mereka menamai penemuan mereka dengan "panormium", dari nama Latin Palermo, Panormus. Pada tahun 1947[16] unsur 43 dinamai dari kata Yunani τεχνητός, yang berarti "buatan", karena ia merupakan unsur pertama yang diproduksi secara artifisial.[5][8] Segrè kembali ke Berkeley dan bertemu Glenn T. Seaborg. Mereka mengisolasi isotop metastabil teknesium-99m, yang sekarang digunakan dalam sekitar sepuluh juta prosedur diagnostik medis setiap tahun.[18]
Pada tahun 1952, astronom Paul W. Merrill di California mendeteksi tanda spektrum teknesium (khususnya panjang gelombang 403,1 nm, 423,8 nm, 426,2 nm, dan 429,7 nm) dalam cahaya dari raksasa merah tipe S.[19] Bintang-bintang itu mendekati akhir hayat mereka tetapi kaya akan unsur berumur pendek, yang menunjukkan bahwa unsur ini diproduksi dalam bintang melalui reaksi nuklir. Bukti tersebut memperkuat hipotesis bahwa unsur yang lebih berat merupakan produk nukleosintesis dalam bintang.[17] Baru-baru ini, pengamatan semacam itu memberikan bukti bahwa unsur-unsur dibentuk oleh penangkapan neutron dalam proses s.[20]
Sejak penemuan itu, ada banyak pencarian bahan terestrial untuk sumber alami teknesium. Pada tahun 1962, teknesium-99 diisolasi dan diidentifikasi dalam bijih-bijih uranium dari Kongo Belgia dalam jumlah yang sangat kecil (sekitar 0,2 ng/kg),[20] yang berasal dari produk fisi spontan uranium-238. Reaktor fisi nuklir alami Oklo berisi bukti bahwa sejumlah besar teknesium-99 telah diproduksi dan sejak saat itu telah meluruh menjadi rutenium-99.[20]
Teknesium adalah logam radioaktif berwarna abu-abu keperakan dengan penampilan yang mirip dengan platina, biasanya diperoleh sebagai bubuk abu-abu.[21] Struktur kristal logam teknesium murni curah berbentuk susunan padat heksagon, dan struktur kristal logam teknesium murni nanodispersi berbentuk kubik. Teknesium nanodispersi tidak memiliki spektrum NMR terpisah, sedangkan teknesium curah heksagon memiliki spektrum Tc-99-NMR yang terbagi dalam 9 satelit.[21][22] Atom teknesium memiliki karakteristik garis emisi pada panjang gelombang 363,3 nm, 403,1 nm, 426,2 nm, 429,7 nm, dan 485,3 nm.[23]
Bentuk logam teknesium sedikit paramagnetik, yang berarti dipol magnetnya sejajar dengan medan magnet luar, tetapi akan mengambil orientasi acak setelah medan dihilangkan.[24] Teknesium murni, metalik, berkristal tunggal akan menjadi superkonduktor tipe II pada suhu di bawah 7,46 K.[25][lower-alpha 1] Di bawah suhu ini, teknesium memiliki kedalaman penetrasi magnet yang sangat tinggi, lebih besar daripada unsur lain kecuali niobium.[26]
Teknesium terletak di golongan ketujuh tabel periodik, antara mangan dan renium. Seperti yang diprediksi oleh hukum periodik, sifat kimianya berada di antara kedua unsur tersebut. Dari keduanya, teknesium lebih mirip renium, terutama dalam kelengaian kimianya dan kecenderungan untuk membentuk ikatan kovalen.[27] Hal ini konsisten dengan kecenderungan unsur periode 5 untuk lebih menyerupai pasangannya pada periode 6 daripada periode 4 karena kontraksi lantanida. Tidak seperti mangan, teknesium tidak mudah membentuk kation (ion dengan muatan positif bersih). Teknesium menunjukkan sembilan keadaan oksidasi dari −1 hingga +7, dengan +4, +5, dan +7 menjadi yang paling umum.[28] Teknesium larut dalam air raja, asam nitrat, dan asam sulfat pekat, tetapi tidak larut dalam asam klorida dengan konsentrasi apa pun.[29]
Teknesium metalik perlahan ternoda di udara lembab[28] dan, dalam bentuk bubuk, terbakar dalam oksigen.
Teknesium dapat mengatalisasi penghancuran hidrazina oleh asam nitrat, dan sifat ini disebabkan oleh banyaknya valensi.[30] Hal ini menyebabkan masalah dalam pemisahan plutonium dari uranium dalam pemrosesan bahan bakar nuklir, di mana hidrazina digunakan sebagai reduktor pelindung untuk menjaga plutonium dalam keadaan trivalen daripada tetravalen yang lebih stabil. Masalah ini diperburuk oleh ekstraksi pelarut teknesium dan zirkonium yang saling ditingkatkan pada tahap sebelumnya,[31] dan memerlukan modifikasi proses.
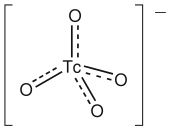
Bentuk paling lazim dari teknesium yang mudah diakses adalah natrium perteknetat, Na[TcO4]. Sebagian besar material ini diproduksi oleh peluruhan radioaktif dari [99MoO4]2−:[32][33]
Perteknetat (tetroksidoteknetat) TcO−4 berperilaku analog dengan perklorat, dimana keduanya tetrahedron. Tidak seperti permanganat (MnO−4), ia hanyalah sebuah oksidator lemah.
Senyawa lain yang terkait dengan perteknetat adalah teknesium heptoksida. Padatan berwarna kuning pucat dan volatil ini dihasilkan oleh oksidasi logam Tc dan prekursor terkait:
Ia adalah oksida logam molekuler, analog dengan mangan heptoksida. Ia mengadopsi struktur sentrosimetri dengan dua jenis ikatan Tc−O dengan panjang ikatan 167 dan 184 pm.[34]
Teknesium heptoksida terhidrolisis menjadi perteknetat dan asam perteknetat, bergantung pada pH:[35][36]
HTcO4 adalah asam kuat. Dalam asam sulfat pekat, [TcO4]− berubah menjadi bentuk oktahedron TcO3(OH)(H2O)2, basa konjugat dari kompleks triakuo [TcO3(H2O)3]+ hipotetis.[37]
Teknesium dapat membentuk dioksida,[38] disulfida, diselenida, dan ditelurida. Bentuk Tc2S7 yang tak jelas terbentuk saat mengolah perteknetat dengan hidrogen sulfida. Ia secara termal terurai menjadi disulfida dan belerang elemental.[39] Demikian pula dioksidanya dapat diproduksi dengan reduksi Tc2O7.
Berbeda dengan renium, trioksida belum diisolasi untuk teknesium. Namun, TcO3 telah diidentifikasi dalam fase gas menggunakan spektrometri massa.[40]
Teknesium membentuk kompleks sederhana TcH2−9. Garam kaliumnya bersifat isostruktural dengan ReH2−9.[41]

Biner (hanya mengandung dua unsur) teknesium halida berikut telah diketahui: TcF6, TcF5, TcCl4, TcBr4, TcBr3, α-TcCl3, β-TcCl3, TcI3, α-TcCl2, dan β-TcCl2. Keadaan oksidasinya berkisar dari Tc(VI) hingga Tc(II). Teknesium halida menunjukkan jenis struktur yang berbeda, seperti kompleks oktahedral molekuler, rantai panjang, lembaran berlapis, dan gugus logam yang tersusun dalam jaringan tiga dimensi.[42][43] Senyawa ini diproduksi dengan menggabungkan teknesium dan halogen atau dengan reaksi yang kurang langsung.
TcCl4 diperoleh dengan klorinasi logam Tc atau Tc2O7. Setelah dipanaskan, TcCl4 menghasilkan Tc(III) dan Tc(II) klorida yang sesuai.[43]
Struktur TcCl4 terdiri dari rantai zigzag tak terbatas dari oktahedra TcCl6 yang berbagi tepi. Ia bersifat isomorf dengan tetraklorida logam transisi dari zirkonium, hafnium, dan platina.[43]

Ada dua polimorf teknesium triklorida, α- dan β-TcCl3. Polimorf α juga dilambangkan sebagai Tc3Cl9. Ia mengadopsi struktur bioktahedron konfasial.[44] Ia dibuat dengan mereaksikan kloro-asetat Tc2(O2CCH3)4Cl2 dengan HCl. Seperti Re3Cl9, struktur polimorf α terdiri dari segitiga dengan jarak M-M yang pendek. β-TcCl3 menampilkan pusat Tc oktahedron, yang disusun berpasangan, seperti yang terlihat juga untuk molibdenum triklorida. TcBr3 tidak mengadopsi struktur dari salah satu fase triklorida. Sebaliknya, ia memiliki struktur molibdenum tribromida, terdiri dari rantai oktahedra konfasial dengan kontak Tc—Tc pendek dan panjang yang bergantian. TcI3 memiliki struktur yang sama dengan fase suhu tinggi dari TiI3, menampilkan rantai oktahedra konfasial dengan kontak Tc—Tc yang sama.[43]
Beberapa teknesium halida anionik telah diketahui. Tetrahalida biner dapat dikonversi menjadi heksahalida [TcX6]2− (X = F, Cl, Br, I), yang mengadopsi geometri molekul oktahedron.[20] Lebih banyak halida tereduksi membentuk kluster anionik dengan ikatan Tc–Tc. Situasi ini serupa untuk unsur terkait seperti Mo, W, Re. Gugus ini memiliki nukliritas Tc4, Tc6, Tc8, dan Tc13. Gugus Tc6 dan Tc8 yang lebih stabil memiliki bentuk prisma di mana pasangan vertikal atom Tc dihubungkan dengan ikatan rangkap tiga dan atom planar dengan ikatan tunggal. Setiap atom teknesium membuat enam ikatan, dan elektron valensi yang tersisa dapat dijenuhkan oleh satu aksial dan atom halogen penghubung ligan seperti klorin atau bromin.[45]

Teknesium membentuk berbagai kompleks koordinasi dengan ligan organik. Banyak dari mereka yang telah diteliti dengan baik karena relevansinya dengan kedokteran nuklir.[46]
Teknesium membentuk berbagai senyawa dengan ikatan Tc–C, yaitu kompleks organoteknesium. Anggota yang menonjol dari kelas ini adalah kompleks dengan ligan CO, arena, dan siklopentadienil.[47] Karbonil biner Tc2(CO)10 is adalah padatan putih yang volatil.[48] Dalam molekul ini, dua atom teknesium terikat satu sama lain; setiap atom dikelilingi oleh oktahedra dari lima ligan karbonil. Panjang ikatan antara atom-atom teknesium, 303 pm,[49][50] jauh lebih besar daripada jarak antara dua atom dalam logam teknesium (272 pm). Karbonil serupa dibentuk oleh kongener teknesium, mangan, dan renium.[51] Ketertarikan pada senyawa organoteknesium juga dimotivasi oleh aplikasi dalam kedokteran nuklir.[47] Teknesium juga membentuk kompleks akuo-karbonil, salah satu kompleks yang menonjol adalahg [Tc(CO)3(H2O)3]+, yang tidak biasa bila dibandingkan dengan karbonil logam lainnya.[47]
Teknesium, dengan nomor atom Z = 43, adalah unsur dengan nomor terendah dalam tabel periodik yang semua isotopnya bersifat radioaktif. Unsur radioaktif eksklusif teringan kedua, prometium, memiliki nomor atom 61.[28] Inti atom dengan jumlah proton ganjil lebih tidak stabil dibandingkan inti atom dengan jumlah genap, meskipun jumlah total nukleonnya (proton + neutron) genap,[52] dan unsur bernomor ganjil memiliki lebih sedikit isotop stabil.
Isotop radioaktif teknesium yang paling stabil adalah teknesium-97 dengan waktu paruh 4,21 juta tahun, teknesium-98 dengan 4,2 juta tahun, dan teknesium-99 dengan 211.100 tahun.[53] Tiga puluh radioisotop lainnya telah dikarakterisasi dengan nomor massa berkisar antara 85 hingga 118.[54] Sebagian besar memiliki waktu paruh kurang dari satu jam, kecuali teknesium-93 (2,73 jam), teknesium-94 (4,88 jam), teknesium-95 (20 jam), dan teknesium-96 (4,3 hari).[55]
Mode peluruhan utama untuk isotop yang lebih ringan dari teknesium-98 (98Tc) adalah penangkapan elektron, menghasilkan molibdenum (Z = 42).[54] Untuk teknesium-98 dan isotop yang lebih berat, mode utamanya adalah emisi beta (emisi elektron atau positron), menghasilkan rutenium (Z = 44), dengan pengecualian bahwa teknesium-100 dapat meluruh baik melalui emisi beta maupun penangkapan elektron.[54][56]
Teknesium juga memiliki banyak isomer nuklir, yang merupakan isotop dengan satu atau lebih nukleon tereksitasi. Teknesium-97m (97mTc; "m" adalah singkatan dari metastabilitas) adalah yang paling stabil, dengan waktu paruh 91 hari dan energi eksitasi 0,0965 MeV.[55] Ini diikuti oleh teknesium-95m (61 hari, 0,03 MeV), dan teknesium-99m (6,01 jam, 0,142 MeV).[55] Teknesium-99m hanya memancarkan sinar gama dan meluruh menjadi teknesium-99.[55]
Teknesium-99 (99Tc) adalah produk utama dari fisi uranium-235 (235U), menjadikannya isotop teknesium yang paling umum dan paling tersedia. Satu gram teknesium-99 menghasilkan 6,2×108 disintegrasi per detik (dengan kata lain, aktivitas spesifik 99Tc adalah 0,62 GBq/g).[24]
Teknesium terjadi secara alami di kerak Bumi dalam konsentrasi kecil, sekitar 0,003 bagian per triliun. Teknesium sangatlah langka karena waktu paruh 97Tc dan 98Tc hanya 4,2 juta tahun. Lebih dari seribu periode seperti itu telah berlalu sejak pembentukan Bumi, sehingga kemungkinan bertahan hidup bahkan untuk satu atom teknesium primordial secara efektif nol. Namun, sejumlah kecil teknesium eksis sebagai produk fisi spontan dalam bijih uranium. Satu kilogram uranium mengandung kira-kira 1 nanogram (10−9 g) teknesium yang setara dengan sepuluh triliun atom teknesium.[17][57][58] Beberapa bintang raksasa merah dengan tipe spektral S-, M-, dan N memiliki garis absorpsi spektral yang menunjukkan adanya teknesium.[29][59] Raksasa merah ini secara informal dikenal sebagai bintang teknesium.
Berbeda dengan keterjadian alam yang langka, sejumlah besar teknesium-99 diproduksi setiap tahun dari batang bahan bakar nuklir bekas, yang mengandung berbagai produk fisi. Fisi satu gram uranium-235 dalam reaktor nuklir menghasilkan 27 mg teknesium-99, memberikan teknesium hasil produk fisi sebesar 6,1%.[24] Isotop fisil lainnya menghasilkan teknesium yang serupa, seperti 4,9% dari uranium-233 dan 6,21% dari plutonium-239.[60] Diperkirakan 49.000 TBq (78 ton metrik) teknesium diproduksi di dalam reaktor nuklir antara tahun 1983 hingga 1994, dan sejauh ini merupakan sumber teknesium terestrial yang dominan.[61][62] Hanya sebagian kecil dari produksi ini yang digunakan secara komersial.[lower-alpha 2]
Teknesium-99 diproduksi oleh fisi nuklir uranium-235 dan plutonium-239. Oleh karena itu, ia hadir dalam limbah radioaktif dan dalam luruhan nuklir dari ledakan bom fisi. Peluruhannya, diukur dalam becquerel per jumlah bahan bakar bekas, merupakan kontributor dominan radioaktivitas limbah nuklir setelah sekitar 104 hingga 106 tahun setelah penciptaan limbah nuklir.[61] Dari tahun 1945 hingga 1994, sekitar 160 TBq (sekitar 250 kg) teknesium-99 dilepaskan ke lingkungan selama uji coba nuklir di atmosfer.[61][63] Jumlah teknesium-99 dari reaktor nuklir yang dilepaskan ke lingkungan hingga tahun 1986 adalah sekitar 1000 TBq (sekitar 1600 kg), terutama melalui pemrosesan ulang bahan bakar nuklir; sebagian besar dibuang ke laut. Metode pemrosesan ulang telah mengurangi emisi sejak saat itu, tetapi pada tahun 2005 pelepasan utama teknesium-99 ke lingkungan dilakukan oleh pembangkit Sellafield, yang melepaskan sekitar 550 TBq (sekitar 900 kg) dari tahun 1995 hingga 1999 ke Laut Irlandia.[62] Sejak tahun 2000 dan seterusnya, jumlahnya dibatasi oleh peraturan menjadi 90 TBq (sekitar 140 kg) per tahun.[64] Pembuangan teknesium ke laut mengakibatkan kontaminasi beberapa makanan laut dengan jumlah yang sangat kecil dari unsur ini. Misalnya, ikan dan lobster Eropa dari Cumbria barat mengandung sekitar 1 Bq/kg teknesium.[65][66][lower-alpha 3]
Isotop metastabil teknesium-99m terus diproduksi sebagai produk fisi dari fisi uranium atau plutonium dalam reaktor nuklir:
Karena bahan bakar bekas didiamkan selama beberapa tahun sebelum diproses ulang, semua molibdenum-99 dan teknesium-99m akan terurai pada saat produk fisi dipisahkan dari aktinida utama dalam pemrosesan ulang nuklir konvensional. Cairan yang tersisa setelah ekstraksi plutonium–uranium (PUREX) mengandung teknesium konsentrasi tinggi sebagai TcO−4 tetapi hampir semuanya adalah teknesium-99, bukan teknesium-99m.[68]
Sebagian besar teknesium-99m yang digunakan dalam pekerjaan medis diproduksi dengan menyinari target uranium yang sangat diperkaya khusus dalam sebuah reaktor, mengekstraksi molibdenum-99 dari target di dalam fasilitas pemrosesan ulang,[33] dan memulihkan di pusat diagnostik teknesium-99m yang dihasilkan setelah peluruhan molibdenum-99.[69][70] Molibdenum-99 dalam bentuk molibdat MoO2−4 diadsorpsi ke dalam alumina asam (Al2O3) dalam kromatografi kolom berpelindung di dalam generator teknesium-99m ("sapi teknesium", kadang juga disebut "sapi molibdenum"). Molibdenum-99 memiliki waktu paruh 67 jam, jadi teknesium-99m yang berumur pendek (waktu paruh: 6 jam), yang dihasilkan dari peluruhannya, terus diproduksi.[17] Perteknetat (TcO−4) yang larut kemudian dapat diekstraksi secara kimia dengan elusi menggunakan larutan garam. Kelemahan dari proses ini adalah membutuhkan target yang mengandung uranium-235, yang tunduk pada tindakan pengamanan bahan fisil.[71][72]

Hampir dua pertiga pasokan teknesium dunia berasal dari dua reaktor; Reaktor Penelitian Universal Nasional di Laboratorium Chalk River di Ontario, Kanada, dan Reaktor Fluks Tinggi di Kelompok Penelitian dan Konsultasi Nuklir di Petten, Belanda. Semua reaktor utama yang menghasilkan teknesium-99m dibangun pada 1960-an dan mendekati akhir masa pakainya. Dua reaktor Eksperimen Kisi Fisika Terapan Serbaguna Kanada yang baru direncanakan dan dibangun untuk menghasilkan 200% dari permintaan teknesium-99m, membebaskan semua produsen lain dari membangun reaktor mereka sendiri. Dengan pembatalan reaktor yang sudah diuji pada tahun 2008, pasokan teknesium-99m di masa mendatang menjadi bermasalah.[73]
Waktu paruh teknesium-99 yang panjang dan potensinya untuk membentuk spesies anionik menciptakan perhatian besar untuk pembuangan limbah radioaktif dalam jangka panjang. Banyak dari proses yang dirancang untuk menghilangkan produk fisi di pabrik pemrosesan ulang bertujuan untuk spesies kationik seperti sesium (misalnya sesium-137) dan stronsium (misalnya stronsium-90). Oleh karena itu, perteknetat lolos melalui proses tersebut. Opsi pembuangan saat ini mendukung penguburan di batuan kontinental yang stabil secara geologis. Bahaya utama dari praktik semacam itu adalah kemungkinan limbah akan bersentuhan dengan air, yang dapat melepaskan kontaminasi radioaktif ke lingkungan. Perteknetat dan iodida anionik cenderung tidak teradsorpsi ke permukaan mineral, dan cenderung hanyut. Sebagai perbandingan, plutonium, uranium, dan sesium cenderung mengikat partikel tanah. Teknesium dapat dilumpuhkan oleh beberapa lingkungan, seperti aktivitas mikroba pada sedimen dasar danau,[74] dan kimia lingkungan teknesium merupakan bidang penelitian aktif.[75]
Metode pembuangan alternatif, transmutasi, telah didemonstrasikan di CERN untuk teknesium-99. Dalam proses ini, teknesium (teknesium-99 sebagai target logam) dibombardir dengan neutron untuk membentuk teknesium-100 berumur pendek (waktu paruh 16 detik) yang meluruh melalui peluruhan beta menjadi rutenium-100 yang stabil. Jika pemulihan rutenium yang dapat digunakan adalah tujuannya, diperlukan target teknesium yang sangat murni; jika jejak kecil aktinida minor seperti amerisium dan kurium ada di target, mereka cenderung mengalami fisi dan membentuk lebih banyak produk fisi yang meningkatkan radioaktivitas target yang disinari. Pembentukan rutenium-106 (waktu paruh 374 hari) dari 'fisi segar' kemungkinan akan meningkatkan aktivitas logam rutenium akhir, yang kemudian akan membutuhkan waktu pendinginan yang lebih lama setelah penyinaran sebelum ruthenium dapat digunakan.[76]
Pemisahan teknesium-99 sebenarnya dari bahan bakar nuklir bekas adalah proses yang panjang. Selama pemrosesan ulang bahan bakar, ia keluar sebagai komponen cairan limbah yang sangat radioaktif. Setelah beberapa tahun, radioaktivitas berkurang ke tingkat di mana ekstraksi isotop berumur panjang, termasuk teknesium-99, menjadi layak. Serangkaian proses kimia menghasilkan logam teknesium-99 dengan kemurnian tinggi.[77]
Molibdenum-99, yang meluruh menjadi teknesium-99m, dapat dibentuk melalui aktivasi neutron molibdenum-98.[78] Jika diperlukan, isotop teknesium lainnya tidak diproduksi dalam jumlah yang signifikan melalui fisi, tetapi diproduksi oleh penyinaran neutron dari isotop induk (misalnya, teknesium-97 dapat dibuat dengan penyinaran neutron dari rutenium-96).[79]
Kelayakan produksi teknesium-99m dengan pemborbardiran proton 22 MeV terhadap target molibdenum-100 dalam siklotron medis setelah reaksi 100Mo(p,2n)99mTc didemonstrasikan pada tahun 1971.[80] Kekurangan teknesium-99m medis baru-baru ini menghidupkan kembali minat dalam produksinya dengan pemborbardiran proton dari target molibdenum-100 yang diperkaya secara isotop (>99,5%).[81][82] Teknik lainnya sedang diselidiki untuk memperoleh molibdenum-99 dari molibdenum-100 melalui reaksi (n,2n) atau (γ,n) dalam akselerator partikel.[83][84][85]

Teknesium-99m ("m" menunjukkan bahwa ini adalah isomer nuklir metastabil) digunakan dalam tes medis isotop radioaktif. Misalnya, teknesium-99m adalah pelacak radioaktif yang dilacak oleh peralatan pencitraan medis di tubuh manusia.[17][81] Ia sangat cocok untuk peran tersebut karena memancarkan sinar gama 140 keV yang mudah dideteksi, dan waktu paruhnya adalah 6,01 jam (berarti bahwa sekitar 94% darinya meluruh menjadi teknesium-99 dalam 24 jam).[24] Kimia teknesium memungkinkannya terikat pada berbagai senyawa biokimia, yang masing-masing menentukan bagaimana teknesium dimetabolisme dan disimpan di dalam tubuh, dan isotop tunggal ini dapat digunakan untuk banyak tes diagnostik. Lebih dari 50 radiofarmasi umum didasarkan pada teknesium-99m untuk pencitraan dan studi fungsional otak, otot jantung, tiroid, paru-paru, hati, kantong empedu, ginjal, rangka, darah, dan tumor.[86]
Isotop yang berumur lebih panjang, teknesium-95m dengan waktu paruh 61 hari, digunakan sebagai pelacak radioaktif untuk mempelajari pergerakan teknesium di lingkungan serta dalam sistem tumbuhan dan hewan.[87]
Teknesium-99 meluruh hampir seluruhnya melalui peluruhan beta, memancarkan partikel beta dengan energi rendah yang konsisten dan tidak disertai sinar gama. Selain itu, waktu paruhnya yang panjang berarti emisi ini berkurang sangat lambat seiring waktu. Ia juga dapat diekstraksi ke kemurnian kimia dan isotop yang tinggi dari limbah radioaktif. Untuk alasan ini, ia adalah pemancar beta standar Institut Standar dan Teknologi Nasional (NIST), dan digunakan untuk kalibrasi peralatan.[88] Teknesium-99 juga telah diusulkan untuk perangkat optoelektronik dan baterai nuklir berskala nano.[89]
Seperti renium dan paladium, teknesium dapat berfungsi sebagai katalis. Dalam proses seperti dehidrogenasi isopropil alkohol, ia adalah katalis yang jauh lebih efektif daripada renium atau paladium. Namun, radioaktivitasnya merupakan masalah utama dalam aplikasi katalitik yang aman.[90]
Ketika baja direndam dalam air, menambahkan sedikit konsentrasi (55 ppm) kalium perteknetat(VII) ke dalam air akan melindungi baja dari korosi, bahkan jika suhu dinaikkan menjadi 250 °C (523 K).[91] Untuk alasan ini, perteknetat telah digunakan sebagai penghambat korosi anodik untuk baja, meskipun radioaktivitas teknesium menimbulkan masalah yang membatasi aplikasi ini pada sistem mandiri.[92] Walaupun (misalnya) CrO2−4 juga dapat menghambat korosi, ia membutuhkan konsentrasi sepuluh kali lebih tinggi. Dalam satu percobaan, spesimen baja karbon disimpan dalam larutan berair perteknetat selama 20 tahun dan masih belum berkarat.[91] Mekanisme perteknetat mencegah korosi tidak dipahami dengan baik, tetapi tampaknya melibatkan pembentukan reversibel dari lapisan permukaan tipis (pasivasi). Satu teori berpendapat bahwa perteknetat bereaksi dengan permukaan baja untuk membentuk lapisan teknesium dioksida yang mencegah korosi lebih lanjut; efek yang sama menjelaskan bagaimana bubuk besi dapat digunakan untuk menghilangkan perteknetat dari air. Efeknya menghilang dengan cepat jika konsentrasi perteknetat turun di bawah konsentrasi minimum atau jika konsentrasi ion lain yang terlalu tinggi ditambahkan.[93]
Sebagaimana dicatat, sifat radioaktif teknesium (3 MBq/L pada konsentrasi yang dibutuhkan) membuat perlindungan korosi ini tidak praktis di hampir semua situasi. Namun demikian, perlindungan korosi oleh ion perteknetat diusulkan (tapi tidak pernah diadopsi) untuk digunakan dalam reaktor air mendidih.[93]
Teknesium tidak memainkan peran biologis alami dan biasanya tidak ditemukan dalam tubuh manusia.[29] Teknesium diproduksi dalam jumlah banyak melalui fisi nuklir, dan menyebar lebih mudah daripada banyak radionuklida lain. Ia tampaknya memiliki toksisitas kimia yang rendah. Misalnya, tidak ada perubahan signifikan dalam formula darah, berat badan dan organ, dan konsumsi makanan yang dapat dideteksi untuk tikus yang menelan hingga 15 µg teknesium-99 per gram makanan selama beberapa minggu.[94] Di dalam tubuh, teknesium dengan cepat diubah menjadi ion TcO−4 yang stabil, yang sangat larut dalam air dan diekskresikan dengan cepat. Toksisitas radiologis teknesium (per satuan massa) adalah fungsi senyawa, jenis radiasi untuk isotop dan waktu paruh isotop yang bersangkutan.[95]
Semua isotop teknesium harus ditangani dengan hati-hati. Isotop yang paling umum, teknesium-99, adalah pemancar beta yang lemah; radiasi tersebut dihentikan oleh dinding peralatan kaca laboratorium. Bahaya utama saat bekerja dengan teknesium adalah menghirup debu; kontaminasi radioaktif semacam itu pada paru-paru dapat menimbulkan risiko kanker yang signifikan. Untuk sebagian besar pekerjaan, penanganan yang hati-hati dalam sungkup asap sudah cukup, dan kotak sarung tangan tidak diperlukan.[96]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.