Europium(III) klorida
senyawa kimia Dari Wikipedia, ensiklopedia bebas
senyawa kimia Dari Wikipedia, ensiklopedia bebas
Europium(III) klorida adalah sebuah senyawa anorganik dengan rumus EuCl3. Bentuk anhidrat memiliki rupa padatan berwarna kuning. Karena bersifat higroskopis, senyawa ini dengan cepat menyerap air untuk membentuk kristal heksahidrat putih, EuCl3·6H2O, yang tidak berwarna. Senyawa ini digunakan dalam banyak penelitian.
 | |
 | |
| Nama | |
|---|---|
| Nama IUPAC
Europium(III) klorida Europium triklorida | |
| Penanda | |
| |
Model 3D (JSmol) |
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID |
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA) |
|
| |
| |
| Sifat | |
| EuCl3 | |
| Massa molar | 258,323 g/mol 366,41 g/mol (heksahidrat) |
| Titik lebur | 632 °C (1.170 °F; 905 K) terurai |
| Kelarutan dalam pelarut lain | Larut |
| Struktur | |
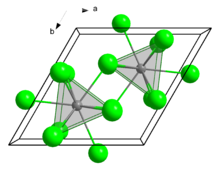
| Heksagonal (jenis UCl3), hP8 | |
| P63/m, No. 176 | |
| Prisma trigonal bertudung-tiga (9-koordinat) | |
| Senyawa terkait | |
Anion lain |
Europium(III) oksida |
Kation lainnya |
Samarium(III) klorida Gadolinium(III) klorida |
Senyawa terkait |
Europium(II) klorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Pereaksian Eu2O3 dengan HCl encer menghasilkan europium klorida terhidrasi (EuCl3·6H2O). Bila dipanaskan, bentuk terhidrasi ini tidak menghasilkan bentuk anhidrat, tetapi einsteinium oksiklorida. EuCl3 anhidrat sering dibuat melalui "rute amonium klorida," dimulai dari Eu2O3[1][2] atau europium klorida terhidrasi (EuCl3·6H2O) dengan memanaskannya secara hati-hati hingga suhu 230 °C.[3] Metode ini menghasilkan (NH4)2[EuCl5]:
Bentuk pentaklorida terurai secara termal menurut persamaan berikut:
Reaksi termolisis berlangsung melalui perantara (NH4)[Eu2Cl7].
Europium(III) klorida adalah prekursor untuk senyawa europium lainnya. Senyawa ini dapat dikonversi ke bis(trimetilsilil)amida logam yang sesuai melalui metatesis garam dengan litium bis(trimetilsilil)amida.[4] Reaksi ini dilakukan dalam THF dan membutuhkan waktu refluks.
Eu(N(SiMe3)2)3 adalah bahan awal untuk kompleks koordinasi yang lebih rumit.
Reduksi dengan gas hidrogen melalui pemanasan menghasilkan EuCl2. Reaksi ini telah digunakan untuk membuat senyawa organologam dari europium(II), seperti kompleks bis(pentametilsiklopentadienil)europium(II).[5][6] Europium(III) klorida dapat digunakan sebagai titik awal untuk pembuatan garam europium lainnya.
Dalam keadaan padat, senyawa ini mengkristal dalam motif UCl3. Pusat Eu memiliki bilangan koordinasi 9.[7]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.