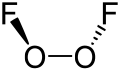Top Qs
Timeline
Obrolan
Perspektif
Dioksigen difluorida
senyawa kimia Dari Wikipedia, ensiklopedia bebas
Remove ads
Dioksigen difluorida adalah senyawa kimia dengan rumus O2F2. Senyawa ini merupakan senyawa padat berwarna jingga yang melebur menjadi cairan merah pada suhu −163 °C (110 K). Senyawa ini merupakan oksidator yang sangat kuat dan dapat berdekomposisi menjadi oksigen dan fluor bahkan pada suhu −160 °C (113 K) dengan laju 4% setiap harinya; maka dari itu, senyawa ini tidak dapat bertahan lama dalam suhu ruangan.[1] Dioksigen difluorida bereaksi dengan hampir semua unsur yang ditemui.
Remove ads
Remove ads
Preparasi
Dioksigen difluorida dapat diperoleh dengan menempatkan campuran gas fluor dan oksigen dengan proporsi 1:1 pada tekanan rendah (7–17 mmHg (0.9–2.3 kPa) merupakan tekanan yang optimal) dengan transmisi listrik 25–30 mA pada tegangan 2.1–2.4 kV.[2] Metode serupa digunakan oleh Otto Ruff untuk mensintesiskan senyawa ini untuk pertama kalinya pada tahun 1933.[3] Metode sintesis lainnya adalah dengan mencampur O2 dan F2 ke dalam bejana baja nirkarat yang didinginkan hingga suhu −196 °C (77,1 K), dan kemudian unsur-unsur ini dipaparkan dengan 3 MeV bremsstrahlung selama beberapa jam. Metode ketiga adalah dengan pemanasan fluor dan oksigen hingga mencapai suhu 700 °C (1.292 °F), dan kemudian mendinginkannya dengan cepat dengan menggunakan oksigen cair.[4] Ketiga metode ini menggunakan reaksi berikut:
- O2 + F2 → O2F2
Dioksigen difluorida juga dapat diperoleh dari dekomposisi ozon difluorida:[5]
- O3F2 → O2F2 + ½ O2 or
- 2 O3F2 → 2 O2F2 + O2
Remove ads
Struktur dan properti
Di dalam senyawa O2F2, oksigen memiliki bilangan oksidasi +1, sementara dalam senyawa-senyawa lainnya oksigen biasanya memiliki bilangan oksidasi −2.
Struktur dioksigen difluorida mirip dengan hidrogen peroksida, H2O2. Geometrinya sesuai dengan prediksi teori VSEPR:

Reaktivitas
Senyawa ini dapat dengan mudah berdekomposisi menjadi oksigen dan fluor. Bahkan pada suhu −160 °C (113 K) 4% senyawa ini mengalami dekomposisi setiap harinya[1] lewat proses ini:
- O2F2 → O2 + F2
Senyawa ini juga merupakan oksidator yang kuat, walaupun sebagian besar reaksi dilakukan pada suhu yang mendekati −100 °C (173 K).[6] Sejumlah percobaan yang menggunakan senyawa ini telah mengakibatkan kebakaran dan ledakan. Beberapa senyawa yang dapat memicu ledakan dengan O2F2 adalah etil alkohol, metana, amonia dan bahkan es air.[6]
Jika bereaksi dengan BF3 dan PF5, akan dihasilkan garam dioksigenil:[1][7]
- 2 O2F2 + 2 PF5 → 2 [O2]+[PF6]− + F2
Referensi
Pranala luar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads