From Wikipedia, the free encyclopedia
Քիմիա կամ տարրաբանություն, գիտության ոլորտ, որն ուսումնասիրում է տարրերը և ատոմներից, մոլեկուլներից ու իոններից բաղկացած միացությունները, նրանց բաղադրությունը, կառուցվածքը, հատկությունները, այլ նյութերի հետ ռեակցիայի ժամանակ նրանց վարքը և փոփոխությունները[1][2]։ Իր բնույթով քիմիա առարկան միջանկյալ դիրք է գրավում ֆիզիկայի և կենսաբանության միջև[3]։ Քիմիան երբեմն անվանում են կենտրոնական գիտություն, քանի որ այն հիմք է ապահովում ինչպես բազային, այնպես էլ կիրառական գիտությունների համար[4]։ Օրինակ՝ քիմիան բացատրում է բույսերի քիմիան (բուսաբանություն), հրաբխային լեռնային ապարների ձևավորումը (երկրաբանություն), ինչպես է կազմավորվում մթնոլորտային օզոնը և ինչպես են քայքայվում շրջակա միջավայրն աղտոտող նյութերը (բնապահպանություն), Լուսնի վրա հողի հատկությունները (աստրոֆիզիկա), ինչպես են աշխատում դեղամիջոցները (դեղագործություն) և ինչպես վերցնել ԴՆԹ-ի փորձանմուշներ հանցանքի վայրից (քրեագիտություն)։

Քիմիան շոշափում է այնպիսի թեմաներ, ինչպիսիք են ատոմների և մոլեկուլների փոխազդեցությունը քիմիական կապերի մեջ՝ նոր քիմիական միացություններ առաջացնելիս։ Գոյություն ունեն քիմիական կապերի չորս տեսակներ.
Քիմիա բառը ծագում է ալքիմիա բառից, որը վերաբերում է առավել վաղ ժամանակաշրջանի գիտական այս ոլորտի գործունեությանը։ Հնագույն ժամանակներում ալքիմիան ընդգրկում էր տարրերի ուսումնասիրությունը, մետալուրգիան, փիլիսոփայությունը, աստղաբաշխությունը, աստղագիտությունը, միստիկան և բժշկությունը։ Հաճախ այն համարում են գիտություն, որը փնտրում էր կապարը, կամ այլ մետաղներ, ոսկու վերափոխելու եղանակները[5], չնայած ալքիմիայի հետազոտություններն ընդգրկում էին ներկայիս քիմիայի շատ հարցեր, օրինակ՝ ջրի բաղադրության ուսումնասիրությունը, շարժման, աճի, վերափոխման, քայքայման երևույթների ուսումնասիրությունները։ Բացի դրանից 4-րդ դարի սկզբին հույն եգիպտական ալքիմիկոս Զոսիմոսն ուսումնասիրում էր մարդու հոգին մարմնից զատելու, կամ կապելու երևույթները[6]։ Ալքիմիկներին ընդունված էր անվանել քիմիկներ (chemist), իսկ քիմիկոսի գործունեության ոլորտն անվանելու համար "-ry" վերջածանցն ավելալացվել է ավելի ուշ (chemistry)՝ քիմիա։
Ալքիմիա բառն առաջացել է արաբական al-kīmīā (الكیمیاء) բառից։ Ըստ ծագման այդ բառը փոխառնվել է հունարեն χημία կամ χημεία բառերից[7][8]։ Այն կարող է ունենալ եգիպտական ծագում, քանի որ հունարեն χημία բառն իր հերթին ծագում է Kemet բառից, որը Եգիպտոսի նախկին անվանումն է եգիպտերեն լեզվով[7]։ Մյուս կողմից al-kīmīā բառը հնարավոր է ծագել է χημεία-ից, որը նշանակում է «միասին վերցրած»[9]։

Ատոմի կառուցվածքի ժամանակակից մոդելը հանդիսանում է քվանտային մեխանիկայի մոդելը[10]։ Ավանդական քիմիան սկսվում է տարրական մասնիկների, ատոմների, մոլեկուլների[11], նյութերի, մետաղների, բյուրեղների և մատերիայի մեջ առկա այլ ագրեգատների ուսումնասիրությամբ։ Նյութը կարող է ուսումնասիրվել պինդ, հեղուկ, կամ գազային, մեկուսացված կամ կոմբինացված վիճակներում։ Փոխազդեցությունները, ռեակցիաները և փոխակերպումները, որոնք ուսումնասիրվում են քիմիայում, որպես կանոն, արդյունք են ատոմների միջև եղած փոխազդեցությունների, որը հանգեցնում է ատոմները միասին պահող քիմիական կապերի վերախմբավորման։ Այդ վարքագծերն ուսումնասիրվում են քիմիական լաբորատորիաներում, որտեղ օգտագործվում են տարբեր ձևերի լաբորատոր անոթներ։ Բայց ապակե անոթներն առանցքային չեն քիմիայի համար, փորձարարական, կիրառական և արդյունաբերական քիմիայի մեծ մասը կառավարվում է առանց դրանց։
Քիմիական ռեակցիան որոշ նյութերի վերափոխումն է մեկ կամ մի քանի տարբեր նյութերի[12]։ Այդպիսի փոխարկման հիմքում ընկած է ատոմների միջև քիմիական կապերի էլեկտրոնների վերախմբավորումը։ Դա կարող է սիմվոլիկ կերպով պատկերվել քիմիական հավասարման միջոցով, որտեղ որպես սուբյեկտներ հանդես են գալիս ատոմները։ Քիմիական հավասարման ձախ և աջ մասերում ատոմների քանակներն իրար հավասար են։ Երբ երկու կողմերում ատոմների քանակն իրար հավասար չի, ապա փոխարկումն անվանում են միջուկային ռեակցիա, կամ ռադիոակտիվ տրոհում։ Ռեակցիաների տեսակները, նրանց ուղեկցող էներգիայի փոփոխությունները սահմանափակված են որոշակի հիմնական կանոններով, որոնք հայտնի են որպես քիմիական օրենքներ։

Էներգետիկ և էնթրոպիական նկատառումները շատ կարևոր են գործնականորեն բոլոր քիմիական հետազոտություններում։ Քիմիական նյութերը դասակարգվում են ըստ իրենց կառուցվածքի, ֆազի, ինչպես նաև ըստ քիմիական բաղադրության։ Նյութերը ենթարկվում են քիմիական անալիզի տարբեր եղանակներով, օրինակ՝ սպեկտրոսկոպիա և քրոմատոգրաֆիա։ Քիմիական հետազոտություններով զբաղված գիտնականներին անվանում են քիմիկոսներ[13]։ Քիմիկոսների մեծ մասը մասնագիտանում են մեկ կամ մի քանի ոլորտներում։
Քիմիան ուսումնասիրելու համար անհրաժեշտ է գաղափար ունենալ մի քանի հասկացությունների մասին, դրանցից են[14].
Քիմիայում մատերիան դա այն ամենն է, ինչն ունի հանգստի զանգված ու ծավալ, գրավում է տարածություն և բաղկացած է մասնիկներից։ Մատերիայի բաղկացուցիչ մասնիկները ևս ունեն հանգստի զանգված, բայց ոչ բոլորը, օրինակ՝ ֆոտոնը չունի հանգստի զանգված։ Մատերիան կարող է լինել մաքուր քիմիական նյութ կամ նյութերի խառնուրդ[15]։

Ատոմն հանդիսանում է քիմիայի հիմնական միավորը։ Այն բաղկացած է խիտ միջուկից (ատոմի միջուկ), որը շրջապատված է էլեկտրոնային ամպով զբաղեցրած տարածքով։ Միջուկը բաղկացած է դրականապես լիցքավորված պրոտոններով և չեզոք նեյտրոններով (միասին անվանում են նուկլոններ)։ Իսկ էլեկտրոնային ամպը բաղկացած է բացասականապես լիցքավորված էլեկտրոններով, որոնք պտտվում են միջուկի շուրջը։ Չեզոք ատոմում բացասականապես լիցքավորված էլեկտրոնները հավասարակշռում են պրոտոնների դրական լիցքը։ Միջուկը շատ խիտ է, նուկլոնի զանգվածը մոտավորապես 1836 անգամ մեծ է էլեկտրոնի զանգվածից, բայց ատոմի շառավիղը մոտ 10 000 անգամ ավելի մեծ է միջուկի շառավղից[16][17]։
Ատոմը նաև ամենափոքր մասնիկն է, որը կարելի է դիտարկել որպես տարրի քիմիական հատկությունների կրողը, ինչպիսիք են էլեկտրաբացասականությունը, իոնացման պոտենցիալը, օքսիդացման գերադասելի աստիճանը, կոորդինացիոն թիվը և առաջացրած կապերի գերադասելի տեսակները, օրինակ՝ մետաղական, իոնական, կովալենտային կապեր։
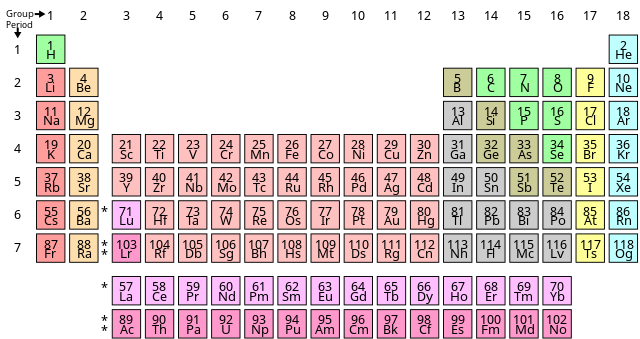
Քիմիական տարրն իրենից ներկայացնում է մաքուր նյութ՝ բաղկացած նույն տիպի ատոմներից, որոնք բնութագրվում են իրենց միջուկում պրոտոնների որոշոկի քանակով, այն անվանում են ատոմային համար և նշանակվում է Z տառով։ Ատոմի զանգվածային թիվն իրենից ներկայացնում է միջուկում եղած պրոտոնների և նեյտրոնների հանրագումարը։ Չնայած միևնույն տարրին պատկանող բոլոր ատոմների բոլոր միջուկները կունենան միևնույն ատոմային համարը, բայց պարտադիր չէ, որ նրանք ունենան նույն զանգվածային համարը։ Զանգվածային համարներով տարբերվող միևնույն տարրի ատոմներին անվանում են իզոտոպներ։ Օրինակ՝ միջուկում 6 պրոտոն պարունակող բոլոր ատոմները ներկայացնում են ածխածին քիմիական տարրը, բայց ածխածնի ատոմները կարող են ունենալ նաև 12 կամ 13 զանգվածային թիվ[17]։
Քիմիական տարրերի ստանդարտ ներկայացումը պարբերական աղյուսակն է, որտեղ տարրերը դասավորված են ատոմային համարի աճման կարգով։ Այն կազմված է խմբերից (կամ սյունակներ) և պարբերություններից (կամ շարքեր)[18]։
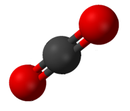
Միացությունը մեկից ավելի տարրերից բաղկացած մաքուր քիմիական նյութ է։ Միացության հատկությունները քիչ են նման նրա բաղադրության մեջ մտնող տարրերի հատկություններին[19]։ Միացությունների ստանդարտ անվանակարգումը սահմանվում է Տեսական և կիրառական քիմիայի միջազգային միության կողմից (IUPAC): Օրգանական միացություններն անվանակարգվում են օրգանական[20], իսկ անօրգանականները՝ անօրգանական անվանակարգման համակարգերին համապատասխան։ Երբ միացությունն ունի մեկից ավելի բաղադրիչ, ապա դրանք բաժանվում են երկու դասի՝ էլեկտրադրական և էլեկտրաբացասական>: Բացի դրանից Chemical Abstracts Service (CAS) ծառայությունը մշակել է քիմիական նյութերի ինդեքսավորման մեթոդ։ Այդ սխեմայում յուրաքանչյուր քիմիական նյութի նույնացվում է որոշակի համարանիշ, որը հայտնի է որպես CAS գրանցման համարանիշ։

Մոլեկուլն հանդիսանում է մաքուր քիմիական նյութի ամենափոքր անբաժանելիմասնիկը, որն ունի միայն իրեն յուրահատուկ որոշակի քիմիական հատկություններ, այսինքն՝ պոտենցիալ, որը հնարավորություն է տալիս որոշ ռեակցիաների մեջ մտնել այլ նյութերի հետ։ Բայց այս բնորոշումն աշխատում է միայն այն նյութերի դեպքում, որոնք բաղկացած են մոլեկուլներից (նայել ներքևում)։ Որպես կանոն, մոլեկուլներն իրենցից ներկայացնում են ատոմների համակցություն, որոնք իրար հետ կապված են կովալենտային կապերով։ Այնպես, որ այդ կառուցվածքը էլեկտրականապես չեզոք է, և բոլոր վալենտային էլեկտրոնները զույգված են այլ էլեկտրոնների հետ կամ կապերի մեջ, կամ առանձին էլեկտրոնային զույգերով։
Այսպիսով, մոլեկուլները էլեկտրականապես չեզոք միավորներ են, ի տարբերություն իոնների։ Երբ այդ կանոնը խախտվում է և մոլեկուլն ստանում է լիցք, ապա այդ մասնիկին անվանում են մոլեկուլային իոն կամ բազմատոմ իոն։ Բայց մոլեկուլ հասկացությունը սովորաբար պահանջում է, որ մոլեկուլային իոնները լինեն լավ առանձնացված, այնպիսին, ինչպիսին է վակուումում ուղղորդված փունջը մասս-սպեկտրաչափում։ Լիցքավորված բազմատոմ մասնիկները, որոնք գտնվում են պինդ մարմիններում (օրինակ՝ սուլֆատ կամ նիտրատ իոնները), քիմիայում չեն համարվում մոլեկուլներ։ Որոշ մոլեկուլներ պարունակում են մեկ կամ մի քանի չզույգված էլեկտրոններ, որոնք առաջացնում են ռադիկալներ։ Ռադիկալների մեծ մասը համեմատաբար ավելի ռեակցիոնունակ են, բայց որոշները, ինչպիսին է ազոտի օքսիդը (NO), կարող են լինել նաև ստաբիլ։
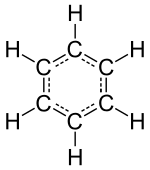
Իներտ տարրերի, կամ ազնիվ գազերի մոտ (հելիում, նեոն, արգոն, կրիպտոն, քսենոն և ռադոն) ամենափոքր առանձին մասնիկները ատոմներն են, բայց մյուս քիմիական տարրերը բաղկացած են մոլեկուլներից, կամ ատոմների ցանցից, որոնք միմյանց հետ կապված են որևէ ձևով։ Միանման մոլեկուլները կազմում են ծանոթ նյութեր, ինչպիսիք են ջուրը, օդը և շատ ուրիշ օրգանական միացություններ՝ սպիրտ, շաքար, բենզին և տարբեր դեղանյութեր։
Բայց ոչ բոլոր նյութերն ու քիմիական միացություններն են բաղկացած առանձին մոլեկուլներից, պինդ նյութերի մեծ մասը, որոնք կազմում են Երկրի կեղևը, վերին մանթիան և միջուկը, իրենցից ներկայացնում են քիմիական միացություններ առանց մոլեկուլների։ Այս նյութերը իոնական միացություններ և պինդ նյութերի ցանցեր են, որոնցում, ըստ էության, առանձին մոլեկուլներ հնարավոր չէ առանձնացնել։ Դրա փոխարեն այդ նյութերը դիտարկվում են կառուցվածքային միավորներով, կամ տարրական բջիջներով՝ որպես ամենափոքր կրկնվող կառուցվածքային միավոր։ Այդպիսի նյութերի օրինակներ են հանքային աղերը (օրինակ՝ կերակրի աղը), պինդ նյութերը (ածխածին, ալմաստ), մետաղները, հանրաճանաչ սիլիցիումի երկօքսիդը և սիլիկատային միներալները (քվարց, գրանիտ)։
Մոլեկուլի հիմնական բնութագրերից մեկը նրա երկրաչափությունն է, որն հաճախ անվանում են նրա կառուցվածք։ Երկատոմ, եռատոմ, կամ քառատոմ մոլեկուլների կառուցվածքը կարող է լինել պարզ (գծային, անկյունային, բրգաձև և այլն)։ Վեցից ավելի ատոմներից բաղկացած բազմատոմ մոլեկուլների կառուցվածքը կարող է վճռական նշանակություն ունենալ քիմիական հատկությունների համար։
  | |
  | |
  | |
| Մաքուր քիմիական նյութերի օրինակներ։ Ձախից աջ՝ անագ (Sn) և ծծումբ (S), ադամանդ (ածխածնի ալոտրոպ ձևափոխություններից մեկը), սախարոզ (մաքուր շաքար), նատրիումի քլորիդ (աղ) և նատրիումի հիդրոկարբոնատ (խմելու սոդա), վերջին երկուսն իոնական միացություններ են։ |
Քիմիական նյութը դա որոշակի բաղադրությամբ և որոշակի հատկություններով մատերիայի տեսակ է[21]։ Մի քանի նյութերի համակցությունն անվանում են խառնուրդներ, օրինակ՝ օդը, համաձուլվածքները և այլն[22]։
Մոլը չափման միավոր է, որը ցույց է տալիս նյութի քանակությունը, անվանում են նաև քիմիական քանակ։ Այս չափման միավորը բնորոշվում է որպես 0,012 կգ ածխածնի (C12) մեջ գտնվող ատոմների քանակով, որտեղ ածխածնի ատոմները կապված չեն, գտնվում են հանգստի և իրենց հիմնական վիճակում[23]։ Մեկ մոլում պարունակվող մասնիկների քանակը հայտնի է որպես Ավոգադրոյի հաստատուն և որոշվում է փորձնական ճանապարհով։ Այն մոտավորապես հավասար է 6,022 × 10 23 մոլ −1[24]:
Մոլյար կոնցենտրացիան իրենից ներկայացնում է որևէ նյութի քանակությունը լուծույթի միավոր ծավալում, այն սովորաբար չափվում է մոլ/դմ3 (մոլ/լ) միավորով[25]։

Քիմիական նյութերը կարող են գոյություն ունենալ մի քանի ֆազերում։ Քիմիական դասակարգումները մեծ մասամբ կախված չեն ֆազերից, բայց մի քանի էկզոտիկ ֆազեր համատեղելի չեն որոշակի քիմիական հատկությունների հետ։ Ֆազն իրենից ներկայացնում է քիմիական համակարգի վիճակ, որն ունի համապատասխան ծավալային կառուցվածք տվյալ ճնշման և ջերմաստիճանի պայմաններում։
Տվյալ ֆազի ֆիզիկական հատկությունները, ինչպիսիք են խտությունը և բեկման ցուցիչը, փոփոխության չեն ենթարկվում։ Նյութի ֆազային վիճակը որոշվում է ֆազային անցումով, երբ համակարգին տված, կամ վերցված էներգիան ծախսվում է համակարգի ստրուկտուրայի վերակառուցման և ոչ ծավալի փոփոխության համար։
Երբեմն ֆազերի միջև տարբերությունը կարող է լինել անընդհատ, չունենալ անջատ սահման։ Այս դեպքում համարվում է, որ նյութը գտնվում է գերկրիտիկական վիճակում։ Նյութի վիճակի դիագրամի վրա այն կետը, որտեղ երեք ֆազերը համատեղ են, կոչվում է եռակի կետ, և չնայած դա գործնականում անհնարին է, միևնույն է հարմար եղանակ է նյութի վիճակի պայմանները քննարկելու համար։
Ֆազերի ամենահայտնի օրինակները համարվում են պինդ, հեղուկ և գազային ֆազերը։ Շատ նյութեր ունեն պինդ նյութերի բազմակիության հատկություն։ Օրինակ՝ գոյություն ունի պինդ երկաթի երեք ֆազ (ալֆա, գամմա և դելտա), որոնք կախված են ջերմաստիճանից և ճնշումից։ Այդ պինդ ֆազերի սկզբունքային տարբերությունը կայանում է բյուրեղային կառուցվածքի կամ ատոմների դասավորության մեջ։ Մյուս ֆազը, որը գտնվում է քիմիայի ուսումնասիրությունների կիզակետում, դա հեղուկ, կամ ջրային ֆազն է, որն իրենից ներկայացնում է ջրում լուծված այլ նյութերի ֆազային վիճակ։
Ավելի քիչ հայտնի ֆազերն են պլազման, Բոզե-Այնշտայնի կոնդենսատը և ֆերմիոնային կոնդենսատները, ինչպես նաև մագնիսական նյութերի պարամագնիսական և ֆեռոմագնիսական ֆազերը։
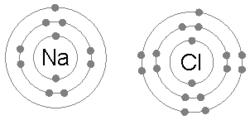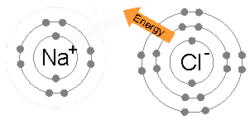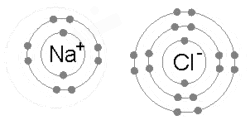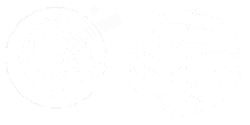
Համարվում է, որ մոլեկուլներում, կամ բյուրեղներում իրար կպած ատոմները կապված են միմյանց հետ։ Քիմիական կապը կարող է դիտարկվել որպես բազմաբևեռ հավասարակշռություն ատոմների միջուկների դրական և նրանց շուրջը տատանվող բացասական իոնների միջև[26]։ Ձգողական և վանողական ուժերով բացատրությունը պարզունակ է, և էլեկտրոնի հասանելիությունը այլ ատոմների հետ կապեր առաջացնելու համար բնութագրվում է էներգիաներով և նրանց բաշխմամբ։
Քիմիական կապը կարող է լինել կովալենտային, իոնային, ջրածնային և Վան դեր Վաալսյան ուժերով պայմանավորված։ Այս կապերից յուրաքանչյուրին վերագրվում է որոշ պոտենցիալ։ Այդ պոտենցիալներն առաջացնում են փոխազդեցություն, որոնք մոլեկուլներում և բյուրեղներում ատոմները պահում են կապված վիճակում։ Պարզ միացություններից շատերում կովալենտային կապի բացատրությունները (էլեկտրոնային զույգի վանումը էլեկտրոնների վալենտային շերտի կողմից և օքսիդացման աստիճան հասկացությունը) կարող են օգտագործվել մոլեկուլային կառուցվածքի և բաղադրության պարզաբանման համար։
Իոնական կապն առաջանում է, երբ մետաղի ատոմը կորցնում է իր էլեկտրոններից մեկը, կամ մի քանիսը՝ դառնալով դրական լիցքավորված կատիոն։ Այդ էլեկտրոնները ձեռք է բերում ոչ մետաղի ատոմը և վեր է ածվում բացասական լիցքավորված անիոնի։ Երկու տարաբևեռ իոններ ձգում են միմյանց, այսինքն՝ իոնական կապն իրենից ներկայացնում է այդ իոնների միջև գոյություն ունեցող էլեկտրաստատիկ ձգողության ուժը։ Օրինակ՝ նատրիում մետաղի ատոմը կորցնելով մեկ էլեկտրոն վեր է ածվում Na+ կատիոնի, իսկ քլոր ոչ մետաղի ատոմը ձեռք է բերում այդ էլեկտրոնը և դառնում Cl− : Այս իոնները միասին են մնում էլեկտրաստատիկ ձգողության շնորհիվ և առաջացնում են NaCl միացությունը, որը հենց կերակրի աղն է։

Կովալենտային կապի դեպքում մեկ կամ մի քանի էլեկտրոնային զույգեր համատեղ օգտագործվում են երկու ատոմների կողմից։ Էլեկտրականապես չեզոք ստացված ատոմների խումբն անվանում են մոլեկուլ։ Ատոմներն ընդհանուր օգտագործման են տրամադրում վալենտային էլեկտրոններն այնպես, որ յուրաքանչյուր ատոմ ունենա ազնիվ գազերի էլեկտրոնային կոնֆիգուրացիան՝ արտաքին ութ էլեկտրոնային կառուցվածքը։ Ընդունված է ասել, որ ատոմները, որոնք միացություններ են առաջացնում այս եղանակով, երբ նրանցից յուրաքանչյուրն իր արտաքին (վալենտային) էլեկտրոնային շերտում ունի ձևավորված ութ էլեկտրոն, հետևում են օկտետի կանոնին: Բայց որոշ տարրեր, ինչպիսիք են ջրածինը և լիթիումը, իրենց արտաքին էլեկտրոնային շերտում միայն մեկ էլեկտրոնի կարիք ունեն, որպեսզի ստանան ստաբիլ կոնֆիգուրացիա։ Ընդունված է ասել, որ այս ատոմները հետևում են դուետի կանոնին, այդպիսով հասնելով ազնիվ գազ հելիումի էլեկտրոնային կոնֆիգուրացիային, որն իր արտաքին էլեկտրոնային շերտում ունի երկու էլեկտրոն։
Ճիշտ նույն ձևով դասական ֆիզիկայի տեսությունները կարելի է օգտագործել բազմաթիվ իոնական միացությունների գոյությունը կանխատեսելու համար։ Ավելի բարդ միացությունների համար, ինչպիսիք են մետաղների կոմպլեքս միացությունները, վալենտային կապերի տեսությունը քիչ կիրառելի է, և սովարաբար օգտագործվում են այլընտրանքային մոտեցումներ, ինչպիսին է մոլեկուլային օրբիտալների տեսությունը (նայել էլեկտրոնային օրբիտալների դիագրամը)։
Քիմիայի կոնտեքստում էներգիան նյութի անկապտելի հատկանիշ է, որը հետևանք է ատոմային, մոլեկուլային, կամ ագրեգատային կառուցվածքի։ Քանի որ քիմիական վերափոխումներն ուղեկցվում են այդ ստրուկտուրաների փոփոխությամբ, դրանք անխուսափելիորեն բերում են մասնակից նյութերի էներգիաների փոփոխության։ Էներգիայի որոշ մասը հաղորդվում է շրջապատին ջերմության կամ լույսի ձևով, արդյունքում ռեակցիայի ելանյութերը կարող են ունենալ ավելի մեծ էներգիա, քան վերջանյութերը։
Ռեակցիան կոչվում է ջերմանջատիչ (էկզոթերմիկ), եթե դրա արդյունքում անջատվում է ջերմություն, ջերմակլանիչ (էնդոթերմիկ) ռեակցիաների դեպքում՝ ընդհակառակը, շրջապատից կլանվում է ջերմության որոշակի քանակ։ Առաջին դեպքում վերջանյութերի էներգետիկ արժեքը ցածր է ելանյութերի էներգիայից, իսկ երկրորդ դեպքում՝ բարձր։
Քիմիական ռեակցիան չի ընթանա, եթե ռեակցող նյութերը չեն հաղթահարում էներգետիկ արգելքը, որը հայտնի է որպես ակտիվացման էներգիա։ Ըստ Բոլցմանի հայտնի ֆակտորի քիմիական ռեակցիայի արագությունը տվյալ ջերմաստիճանում (Т) կախված է ակտիվացման էներգիայից (Е)՝ , դա այն բանի հավանականությունն է, որ մոլեկուլը տվյալ ջերմաստիճանում կարող է ունենալ ակտիվացման E էներգիայից մեծ, կամ հավասար էներգիա։ Ռեակցիայի արագության կախվածությունը ջերմաստիճանից արտահայտվում է Արենիուսի հավասարմամբ։ Քիմիական ռեակցիայի համար անհրաժեշտ ակտիվացման էներգիան կարող է լինել ջերմության, լույսի, էլեկտրականության, կամ գերձայնային ծագում ունեցող մեխանիկական ուժի ձևով[27]։
Սրա հետ կապված ազատ էներգիայի հասկացությունը, որն իր մեջ ներառում է նաև էնթրոպիան, հանդիսանում է շատ օգտակար միջոց ռեակցիայի իրագործելիությունը կանխագուշակելու և քիմիական թերմոդինամիկայում քիմիական ռեակցիայի հավասարակշռության վիճակը որոշելու համար։ Ռեակցիան հնարավոր է, եթե Գիբսի ազատ էներգիայի ընդհանուր փոփոխությունը բացասական է (), իսկ եթե այն հավասար է զրոյի, ապա քիմիական ռեակցիան գտնվում է հավասարակշռային վիճակում։
Էլեկտրոնների, ատոմների և մոլեկուլների վիճակի հնարավոր էներգիաները սահմանափակ են։ Դրանք որոշվում են քվանտային մեխանիկայի կանոններով, ըստ որի տեղի է ունենում կապված համակարգերի էներգիաների քվանտացում։ Ասում են, որ բարձր էներգիա ունեցող ատոմներն ու մոլեկուլները գրգռված են։ Նյութն ավելի ռեակտիվ է, այսինքն հեշտությամբ է մտնում քիմիական ռեակցիայի մեջ, եթե նրա ատոմները կամ մոլեկուլները գտնվում են գրգռված վիճակում։
Նյութի ագրեգատային վիճակը անշեղորեն որոշվում է նրա էներգիայով և նրան շրջապատող միջավայրի էներգիայով։ Եթե նյութի միջմոլեկուլային ուժերն այնպիսին են, որ շրջապատող միջավայրի էներգիան բավարար չէ դրանք հաղթահարելու համար, ապա նյութը կգտնվի պինդ, կամ հեղուկ վիճակներում, ինչպես ջրի (H2O) դեպքում է։ Ջուրը սենյակային ջերմաստիճանում հեղուկ է, որովհետև մրա մոլեկուլները կապված են ջրածնային կապերով[28]։ Իսկ ծծմբաջրածինը (H2S) սենյակային ջերմաստիճանում և նորմալ ճնշման տակ իրենից ներկայացնում է գազային նյութ, քանի որ նրա մոլեկուլները միմյանց հետ կապված են ավելի թույլ՝ դիպոլ-դիպոլ փոխազդեցության ուժերով։
Մեկ քիմիական նյութից մյուսին էներգիայի փոխանցումը կախված է քվանտային էներգիայի այն չափից, որն արձակում է մի նյութը։ Ջերմային էներգիան հաճախ ավելի հեշտությամբ է փոխանցվում գործնականում ցանկացած նյութից այլ նյութի, քանի որ ֆոնոնները, որոնք պատասխանատու են էներգիայի տատանողական և պտտական մակարդակներում, ունեն շատ ավելի փոքր էներգիա, քան ֆոտոնները, որոնք հարուցում են էլեկտրոնների անցումը։ Այսպիսով, քանի որ տատանման և պտտական մակարդակներն իրար ավելի մոտ են դասավորված քան էլեկտրոնների էներգետիկ մակարդակները, ջերմությունն ավելի հեշտությամբ է փոխանցվում նյութերի միջև, քան լուսային, կամ էլեկտրոնային էներգիայի այլ տեսակները։ Օրինակ՝ ուլտրամանուշակագույն էլեկտրամագնիսական ճառագայթումը այդքան էֆեկտիվ չի փոխանցվում մեկ նյութից մյուսը, ինչքան ջերմային, կամ էլեկտրական էներգիան։
Տարբեր նյութերի բնութագրական էներգետիկ մակարդակների գոյությունը օգտակար է այդ նյութերը նույնականացնելու համար սպեկտրալ գծերի անալիզի եղանակով։ Սպեկտրների տարբեր տեսակներ հաճախ օգտագործվում են քիմիական սպեկտրոսկոպիայում, օրինակ՝ ինֆրակարմիր, գերձայնային, միջուկային մագնիսական ռեզոնանս և այլն։ Սպեկտրոսկոպիան օգտագործվում է նաև հեռահար օբյեկտների բաղադրությունը, ինչպիսիք են աստղերը և այլ գալակտիկաները։

Քիմիական էներգիա տերմինը հաճախ օգտագործվում է նշելու համար, թե տվյալ քիմիական նյութը ի վիճակի է փոխակերպվել քիմիական ռեակցիայի արդյունքում, կամ փոխակերպել այլ քիմիական նյութեր։

Երբ քիմիական նյութը այլ նյութերի հետ փոխազդեցության արդյունքում փոխակերպվում է, ուրեմն տեղի է ունեցել քիմիական ռեակցիա։ Հետևապես քիմիական ռեակցիան իրենից ներկայացնում է կոնցեպցիա, որը կապված է նյութի վարքագծի հետ, երբ այն նեղ կոնտակտի մեջ է գտնվում այլ նյութի հետ՝ խառնուրդի կամ լոծույթի ձևով, կամ երբ կա որևէ տիպի էներգիայի ազդեցություն։ Ռեակցիային մասնակցող նյութերի միջև տեղի է ունենում որոշ էներգիայի փոխանակություն, ինչպես նաև միջավայրի հետ, որը հաճախ հանդիսանում է լաբորատոր փորձանոթը։
Քիմիական ռեակցիաները կարող են հանգեցնել մոլեկուլի գոյացման, կամ դիսոցման, այսինքն՝ մոլեկուլների, որոնք քայքայվում են առաջացնելով երկու և ավել մոլեկուլներ, կամ ատոմների վերախմբավորմամբ մոլեկուլի ներսում կամ նրանց միջև։ Քիմիական ռեակցիայի ժամանակ սովորաբար խզվում են կամ առաջանում նոր քիմիական կապեր։ Օքսիդացումը, վերականգնումը, դիսոցումը, թթվահիմնային չեզոքացումը և մոլեկուլների վերախմբավորումն հանդիսանում են քիմիական ռեակցիաների ավելի հաճախ հանդիպող տեսակները։
Քիմիական ռեակցիան կարող է խորհրդանշական կերպով պատկերվել քիմիական հավասարման միջոցով։ Եթե ոչ միջուկային քիմիական ռեակցիայի մեջ հավասարման երկու կողմերում էլ ատոմների քանակը և տեսակը հավասար են, ապա միջուկային ռեակցիայի համար դա ճիշտ է միայն միջուկային մասնիկների համար՝ պրոտոններ և նեյտրոններ[29]։
Քիմիական ռեակցիաների ընթացքում քիմիական կապերի վերակազմավորումը կարող է տեղի ունենալ որոշակի քայլերի հաջորդականությամբ, որը կոչվում է ռեակցիայի մեխանիզմ։ Կարելի է ենթադրել, որ քիմիական ռեակցիան տեղի է ունենալու մի շարք քայլերով, որոնցից յուրաքանչյուրը կարող է ունենալ այլ արագություն։ Այսպիսով, ռեակցիայի ընթացքում կարող են նախատեսվել փոփոխական արագություն ունեցող բազմաթիվ ռեակցիաներ։ Ռեակցիայի մեխանիզմներն առաջարկվում են բացատրելու համար կինետիկան և ռեակցիայի արդյունքում ստացված նյութերի հարաբերակցությունը։ Բազմաթիվ ֆիզքիմիկոսներ մասնագիտանում են տարբեր քիմիական ռեակցիաների մեխանիզմների ուսումնասիրման մեջ։ Քիմիական ռեակցիայի մեխանիզմներ առաջարկող մի քանի էմպիրիկ կանոններ, ինչպիսիք են Վուդվորդ-Հոֆմանի կանոնները, օգտակար են և հաճախակի են գործվում։
IUPAC-ի ոսկե գրքի համաձայն ՝ քիմիական ռեակցիան «գործընթաց է, որը հանգեցնում է քիմիական տեսակների փոխադարձմանը»[30]։ Ըստ այդմ, քիմիական ռեակցիան կարող է լինել պարզ կամ փուլերով ընթացող։ Կատարվում է լրացուցիչ զգուշություն, քանի որ այս սահմանումը ներառում է դեպքեր, երբ նյութերի փոխարկումը փորձարարականորեն դիտարկվում է։ Նման հայտնաբերելի քիմիական ռեակցիաները սովորաբար ներառում են մոլեկուլային սուբյեկտների հավաքածուներ, ինչպես նշված է այս բնորոշմամբ, բայց հաճախ այդ տերմինը նպատակահարմար է օգտագործել նաև մեկ մոլեկուլային սուբյեկտի համար (այսինքն ՝ «մանրադիտակային քիմիական երևույթներ»)։

Իոնը ատոմի կամ մոլեկուլի լիցքավորված տեսակ է, որը կորցրել կամ ստացել է մեկ կամ մի քանի էլեկտրոն։ Երբ ատոմը կորցնում է էլեկտրոն և այդպիսով ավելի շատ պրոտոններ է ունենում, քան էլեկտրոններ, ապա այն դառնում է դրական լիցքավորված իոն կամ կատիոն է։ Երբ ատոմը էլեկտրոն է ստանում և այդպիսով ավելի շատ էլեկտրոն ունի, քան պրոտոն, ապա այն բացասական լիցքավորված իոն կամ անիոն է։ Կատիոնները և անիոնները կարող են ձևավորել չեզոք աղերի բյուրեղավանդակներ, օրինակ ՝ Na + և Cl− իոնները ձևավորում են նատրիումի քլորիդ կամ NaCl: Բազմատոմ իոնների օրինակներ, որոնք չեն բաժանվում թթվահիմնային ռեակցիաների ընթացքում, հիդրօքսիդ (OH−) և ֆոսֆատ (PO43−) իոններն են։
Պլազման բաղկացած է գազային նյութից, որը ամբողջովին իոնացվել է, սովորաբար բարձր ջերմաստիճանի միջոցով։

Հաճախ մեկ նյութը կարող է դասակարգվել որպես և թթու և հիմք։ Կան մի շարք տարբեր տեսություններ, որոնք բացատրում են նյութի թթվահիմնային վարքագիծը։ Ամենապարզը Արենիուսի տեսությունն է, ըստ որի թթուն այն նյութն է, որը ջրի մեջ լուծարվում է ջրածնի (H+)իոններ, իսկ հիմքը ջրի մեջ լուծարվելիս առաջացնում է հիդրօքսիլ (OH−) իոններ։ Բրենսթեդ Լոուրիի թթվահիմնային տեսության համաձայն թթուները նյութեր են, որոնք քիմիական ռեակցիայի մեջ մեկ այլ նյութին դրական ջրածնի իոն են նվիրում։ Ըստ էության՝ հիմքը այն նյութն է, որն ընդունում է ջրածնի այդ իոնը։
Երրորդ տեսությունը Լյուիսի թթվահիմնային տեսությունն է, որը հիմնված է նոր քիմիական կապերի ձևավորման վրա։ Ըստ Լյուիսի տեսության թթուն մի նյութ է, որն ունակ է կապերի ձևավորման գործընթացում այլ նյութից ընդունել մի զույգ էլեկտրոն, մինչդեռ հիմքը նյութ է, որը կարող է տրամադրել զույգ էլեկտրոն՝ նոր կապ ստեղծելու համար։ Ըստ այդ տեսության, փոխանակման կարևորագույն բաները լիցքերն են։ Կան մի քանի այլ եղանակներ, որոնց միջոցով նյութը կարող է դասակարգվել որպես թթու կամ հիմք[31]։
Թթվային ուժը սովորաբար չափվում է երկու մեթոդով։ Մեկ չափում, որը հիմնված է Արենիուսի թթվայնության սահմանման վրա՝ pH, որը լուծույթում ջրածնի իոնների կոնցենտրացիայի չափումն է, այն արտահայտվում է կոնցենտրացիայի լոգարիթմով, բացասական նշանով։ Այսպիսով, ցածր pH ունեցող լուծույթները ունեն ջրածնի իոնների բարձր կոնցենտրացիա և, կարելի է ասել, ավելի թթվային են։ Մյուս չափումը, որը հիմնված է Բրենսթեդ Լոուրիի սահմանման վրա, թթվի տարանջատման կայունությունն է (Ka), որը չափվում է որպես թթու գործելու նյութի հարաբերական ունակությունը։ Այսինքն՝ ավելի բարձր Ka ունեցող նյութերը ավելի հավանական է, որ քիմիական ռեակցիաներում ջրածնի իոններ նվիրեն, քան Ka- ի ցածր արժեքները։
Վերօքս(վերականգնում-օքսիդացում) ռեակցիաները ներառում են բոլոր քիմիական ռեակցիաները, որոնցում ատոմներն իրենց օքսիդացման աստիճանը փոխել են`էլեկտրոններ ձեռք բերելով (վերականգնում) կամ էլեկտրոններ կորցնելով (օքսիդացում)։ Այն նյութերը, որոնք օքսիդացնում են այլ նյութերի հայտնի են որպես օքսիդացնող նյութեր, օքսիդիչներ կամ օքսիդացնող նյութեր։ Օքսիդիչը էլեկտրոնները հեռացնում է մեկ այլ նյութից։ Նմանապես, այն նյութերը, որոնք ունեն վերականգնիչ հատկություն հայտնի են որպես վերականգնող նյութեր, վերականգնիչներ։
Վերականգնիչը էլեկտրոնները փոխանցում է մեկ այլ նյութի և դրանով իսկ օքսիդանում է։ Եվ քանի որ այն «նվիրում է» էլեկտրոններ, կոչվում է նաև էլեկտրոնային դոնոր։ Օքսիդացումը և վերականգնումը հանգեցնում են օքսիդացման աստիճանի փոփոխության։ Բայց իրականում էլեկտրոնների առերևույթ փոխանցում չի կարող տեղի ունենալ։ Այսպիսով, օքսիդացումը ավելի ճիշտ է սահմանել որպես օքսիդացման աստիճանի աճ, իսկ վերականգնումը՝ օքսիդացման աստիճանի նվազում։
Չնայած հավասարակշռության հայեցակարգը լայնորեն կիրառվում է գիտությունների մեջ, քիմիայի համատեքստում, այն ծագում է այն ժամանակ, երբ հնարավոր է քիմիական միացության մի քանի վիճակների գոյությունը, ինչպես, օրինակ, մի քանի քիմիական միացությունների խառնուրդում, որոնք կարող են փոխազդել միմյանց հետ, կամ երբ նյութը կարող է գտնվել մի քանի տեսակի ֆազերում միաժամանակ։
Հավասարակշռության մեջ գտնվող քիմիական նյութերի համակարգը, նույնիսկ անփոփոխ կազմ ունենալու դեպքում, անփոփոխ չէ։ Նյութերի մոլեկուլները շարունակում են փոխազդել միմյանց հետ`դրանով իսկ ստեղծելով դինամիկ հավասարակշռություն։ Այսպիսով, հայեցակարգը նկարագրում է այն վիճակը, որի պարամետրերը, ինչպիսիք են քիմիական կազմը, ժամանակի ընթացքում մնում են անփոփոխ։
Քիմիական ռեակցիաները կարգավորվում են որոշ օրենքներով, որոնք քիմիայի մեջ դարձել են հիմնարար հասկացություններ։ Դրանցից մի քանիսն են.
Քիմիայի պատմությունը սկսվում է շատ հին ժամանակներից մինչև այսօր։ Ք.Ա. մի քանի հազարամյակից ի վեր քաղաքակրթությունները օգտագործում էին տեխնոլոգիաներ, որոնք, ի վերջո, հիմք դարձան քիմիայի տարբեր ճյուղերի համար։ Օրինակ՝ հանքաքարերից մետաղներ կորզելը, խեցեգործությունը, գարեջրի և գինու խմորումը, բույսերից քիմիական նյութերի կորզումը դեղորայքի և օծանելիքի համար, ճարպը օճառի վերածելը, ապակու և բրոնզե համաձուլվածքների ստացումը։ Քիմիային նախորդել է ալքիմիան, որը ինտուիտիվ, բայց ոչ գիտական մոտեցում է ցուցաբերել նյութի բաղադրությունը և դրանց փոխազդեցությունները հասկանալու համար։ Անհաջող էր բացատրվում նյութի բնույթը և դրա վերափոխումները, բայց փորձեր իրականացնելով և արդյունքներ գրանցելով ալքիմիկոսները հիմք դրեցին ժամանակակից քիմիայի համար։ Քիմիան՝ որպես ալքիմիկայից տարբերվող գիտելիքների մարմին, սկսեց ի հայտ գալ այն ժամանակ, երբ նրանց միջև հստակ տարբերակում արվեց Ռոբերտ Բոյլի կողմից իր «Թերահավատ քիմիկոս» աշխատության մեջ (1661)։
Թեև թե ալքիմիան և թե քիմիան առնչվում են նյութին և դրա վերափոխումներին, կարևորագույն տարբերությունը տրվեց գիտականորեն։ Քիմիան համարվում է հաստատված գիտություն Անտուան Լավուազիեյի աշխատանքով։ Նա մշակեց զանգվածի պահպանման օրենքը, որը պահանջում էր մանրակրկիտ չափումներ և քիմիական երևույթների քանակական դիտարկումներ։ Քիմիայի պատմությունը միահյուսված է թերմոդինամիկայի պատմության հետ, հատկապես Ուիլարդ Գիբսի աշխատանքի միջոցով[32]։
Ժամանակի ընթացքում փոխվել է քիմիայի բնորոշումը, քանի որ նոր հայտնագործություններն ու տեսությունները ավելացնում են գիտության ֆունկցիոնալությունը։ «Քիմիա» տերմինը, Ռոբերտ Բոյլի կարծիքով (1661) նշանակում էր խառնված մարմինների նյութական սկզբունքների առարկա[33]։ 1663 թվականին քիմիկոս Քրիստոֆեր Գլասերը «քիմիան» նկարագրեց որպես գիտական արվեստ, որի միջոցով մարդը սովորում է մարմինները լուծել և կորզել դրանց կազմի մեջ մտնող տարբեր նյութերը, նորից միավորել և կատարելագործել դրանք[34]։
«Քիմիա» բառի 1730 թվականի սահմանումը, որն օգտագործվում էր Գեորգ Էռնստ Շտալ կողմից, նշանակում էր խառը, բարդ կամ համախմբված մարմինների լուծման արվեստը և այդ մարմիններից համախումբ կազմելը[35]։ 1837 թվականին Ժան-Բապտիստ Դուման «քիմիա» բառը վերագրեց այն գիտությանը, որը ուսումնասիրում էր մոլեկուլային ուժերի օրենքները[36]։ Այս սահմանումը հետագայում զարգացավ, 1947 թվականին այն նշանակում էր «նյութերի գիտություն», որն ուսումնասիրում է նյութերի կառուցվածքը, հատկությունները և ռեակցիաները, որտեղ դրանք վեր են ածվում այլ նյութերի։ Վերջերս ՝ 1998-ին, պրոֆեսոր Ռայմոնդ Չանգը ընդարձակեց «քիմիա» հասկացությունը՝ հաշվի առնելով նյութի ուսումնասիրությունը և դրա՝ փոփոխությունների ենթարկվելու հանգամանքը[37]։

Վաղ քաղաքակրթությունները, ինչպես, օրինակ, եգիպտացիները[38], բաբելոնացիները, հնդիկները[39] հավաքեցին գործնական գիտելիքներ մետաղագործության, խեցեգործության և ներկերի արվեստի վերաբերյալ, բայց չէին մշակել համակարգված տեսություն։
Առաջին քիմիական վարկածը ձևավորվեց դասական Հունաստանում։ Այն իրենից ներկայացնում էր չորս տարրերի տեսություն։ Արիստոտելը, մեկնաբանելով այդ տեսությունը, նշում էր, որ կրակը, օդը, երկիրը և ջուրը այն հիմնական տարրերն են, որոնցից ձևավորվում է ամեն ինչ՝ համադրության կարգով։ Հունական ատոմիզմը սկսվում է Ք.Ա. 440 թվականից, որոնց հեղինակ են այնպիսի փիլիսոփաներ, ինչպիսիք են Դեմոկրիտեսը և Էպիկուրոսը։ Ք.Ա. 50-ին հռոմեացի փիլիսոփա Լուկրեցիուսը ընդլայնեց այդ տեսությունը «De rerum natura» գրքում (Իրերի բնույթի մասին)[40][41]։ Ի տարբերություն գիտության ժամանակակից հասկացությունների, հունական ատոմիզմը զուտ փիլիսոփայական բնույթ էր կրում, փոքրիկ անհարմարություն առաջացավ էմպիրիկ դիտարկումների համար և ոչ մի անհարմարություն չէր առաջացնում քիմիական փորձերի համար[42]։
Հելլենիստական աշխարհում ալքիմիայի արվեստն առաջին հերթին տարածվեց ՝ միախառնվելով մոգությանն ու օկուլտիզմին։ Նրա հիմնական նպատակն է տարրերը վերածել ոսկու և հավերժական կյանքի էլիքսիր հայտնաբերել[43]։ Աշխատանքները, մասնավորապես՝ թորման զարգացումը, եղել է դեռևս բյուզանդական ժամանակաշրջանում, երբ առավել հայտնի էր 4-րդ դարի հույն-եգիպտական ալքիմիկոս Զոսիմոս Պանոպոլիսեցին[44]։ Իսլամի տարածման հետ[45] ալքիմիան շարունակում էր զարգանալ և կիրառվել ամբողջ արաբական աշխարհում, այնտեղից լատիներեն թարգմանությունների միջոցով[46] տարածվում էր միջնադարյան և Վերածննդի Եվրոպա։ Որոշ ազդեցիկ մուսուլման ալքիմիկոսներ՝ Աբ-ալ-Ռեյհան ալ-Բիրինին[47], Ավիցեննան[48] և Ալ-Կինին հերքում են ալքիմիայի տեսությունները, մասնավորապես ՝ մետաղների փոխակերպման տեսությունը, և Ալ-Թուսին նկարագրեցին զանգվածի պահպանման օրենքի տարբերակ՝ նշելով, որ նյութը ի վիճակի է փոխվել, բայց ի վիճակի չէ անհետանալ[49]։
Ժամանակակից գիտական մեթոդի զարգացումը դանդաղ և ծանր էր, բայց քիմիայի համար գիտական մեթոդը սկսեց ի հայտ գալ վաղ մուսուլման քիմիկոսների շրջանում՝ 9-րդ դարի պարսկա-արաբ քիմիկոս Ջաբիր իբն Հայյանից սկսած (Եվրոպայում հայտնի է որպես «Գեբեր»), ով երբեմն անվանում են «քիմիայի հայր»[50][51][52]։ Նա ներմուծեց լաբորատորիաներում գիտական հետազոտությունների համակարգված և փորձարարական մոտեցում՝ ի տարբերություն հին հունական և եգիպտական ալքիմիկոսների, որոնց գործերը հիմնականում այլաբանական էին և հաճախ անհասկանալի[53]։ Նրա գրքերը մեծապես ազդեցին եվրոպական միջնադարյան ալքիմիկոսների վրա և արդարացրին փիլիսոփայական քարի որոնումները[54][55]։ Միջնադարում Ջաբիրի՝ ալքիմիայի վերաբերյալ[56] տրակտատները թարգմանվեցին լատիներեն և ստանդարտ տեքստեր դարձան եվրոպական ալքիմիկոսների համար։ Դրանք էին Քիթաբ ալ-Կիմիան ( Եվրոպայում վերնագրված է «Ալքիմիայի բաղադրության գիրք»), որը թարգմանվել է Ռոբերտ Չեստերի կողմից (1144) և Քիթաբ-ալ-Սաբենացին («Գիրք յոթանասունի») Գերարդ Կրեմոնացու կողմից (1187 թվականից առաջ)։ Սըր Ֆրենսիս Բեկոնի և այլոց կողմից առաջարկված նոր էմպիրիկ մեթոդների ազդեցության ներքո, Օքսֆորդի մի խումբ քիմիկոսներ Ռոբերտ Բոյլը, Ռոբերտ Հուքը և Ջոն Մայոն սկսեցին վերափոխել հին ալքիմիական ավանդույթները գիտական կարգապահության։ Մասնավորապես՝ Բոյլը համարվում է քիմիայի հիմնադիր հայրը իր կարևորագույն աշխատանքի շնորհիվ «Սկեպտիկ քիմիկոս», որտեղ տարբերակում է կատարվում ալքիմիայի պահանջների և նոր քիմիայի էմպիրիկ գիտական հայտնագործությունների միջև[57]։ Նա ձևակերպեց Բոյլի օրենքը, մերժեց դասական «չորս տարրերը» և առաջարկեց ատոմների և քիմիական ռեակցիաների մեխանիկական այլընտրանքներ, որը կարող էր ենթարկվել խիստ փորձությունների[58]։


Ֆլոգիստոնի տեսությունը (բոլոր այրման պրոցեսների հիմքում ընկած նյութը) առաջադրվել է գերմանացի Գեորգ Էռնստ Շտալի կողմից 18-րդ դարի սկզբին և միայն հարյուրամյակի ընթացքում տապալվել է ֆրանսիացի քիմիկոս Անտուան Լավուազիեյի կողմից։ Նյուտոնը պարզաբանեց զանգվածի պահպանման սկզբունքը և մշակեց քիմիական անվանացանկի նոր համակարգ, որն օգտագործվում է մինչ օրս[60]։ Սակայն մինչ նրա աշխատանքը, կատարվել էին շատ կարևոր հայտնագործություններ, որոնք մասնավորապես վերաբերում էին «օդի» բնույթին, հայտնաբերվել էր, որ այն բաղկացած է շատ տարբեր գազերից։ 1754-ին շոտլանդացի քիմիկոս Ջոզեֆ Բլեքը (առաջին փորձարարական քիմիկոս) և հոլանդացի Վան Հելմոնտը հայտնաբերեցին ածխաթթու գազը, կամ այն, ինչ Բլեքն անվանում էր «հաստատուն օդ»։ Հենրի Կավենդիշը հայտնաբերեց ջրածինը և պարզեցրեց դրա հատկությունները, իսկ Ջոզեֆ Պրիստլին և Կարլ Վիլհելմ Շեելեն իրարից անկախ անջատեցին մաքուր թթվածինը:

Անգլիացի գիտնական Ջոն Դալթոնը առաջարկեց ատոմների ժամանակակից տեսությունը. բոլոր նյութերը կազմված են նյութի անբաժանելի «ատոմներից», և որ տարբեր ատոմներ ունեն տարբեր ատոմային կշիռներ։
Քիմիական կոմբինացիաների էլեկտրաքիմիական տեսության զարգացումը տեղի է ունեցել 19-րդ դարի սկզբին, մասնավորապես, երկու գիտնականների աշխատանքի արդյունքում՝ Յակոբ Բերցելիուսի և Հեմֆրի Դևի։ Դա հնարավոր դարձավ Ալեսանդրո Վոլտայի կողմից հրաբխային կույտի վերաբերյալ նախնական գյուտի արդյունքում։ Դևին հայտնաբերեց ինը նոր տարրեր, ներառյալ ալկալիական մետաղները՝ դրանք կորզելով իրենց օքսիդներից էլեկտրական հոսանքի միջոցով[63]։
Բրիտանացի Ուիլյամ Պրաուտը նախ առաջարկեց բոլոր տարրերը համակարգել ըստ իրենց ատոմային քաշի, քանի որ բոլոր ատոմներն ունեին քաշ, որը ջրածնի ատոմային քաշի ճշգրիտ բազմապատկն է։ Ջոն Նյուլենդսը մշակեց տարրերի աղյուսակ, որն այնուհետև վերածվել է տարրերի ժամանակակից պարբերական աղյուսակի[64] 1860-ական թվականներին Դմիտրի Մենդելեևի և նրանից անկախ մի շարք այլ գիտնականների կողմից, դրանց մեջ էր Յուլիուս Լոթար Մեյերը[65][66]։ Այն իներտ գազերը, որոնք հետագայում կոչվել են ազնիվ գազեր, հայտնաբերվել են դարի վերջում Ուիլյամ Ռամզիի և Լորդ Ռեյլիի համագործակցության արդյունքում՝ դրանով իսկ լրացնելով աղյուսակի հիմնական կառուցվածքը։

Քսաներորդ դարի վերջում քիմիայի տեսական հիմքերը վերջապես հասկացվեցին մի շարք ուշագրավ հայտնագործությունների շնորհիվ, որոնց հաջողվեց հետաքննել և պարզել ատոմների ներքին կառուցվածքի բուն էությունը։ 1897-ին Թոմսոնը Քեմբրիջի համալսարանում հայտնաբերեց էլեկտրոնը և շատ չանցած ֆրանսիացի գիտնական Բեքերելը Պիեռ և Մարի Կյուրիների հետ ուսումնասիրեցին ռադիոակտիվության երևույթը։ Մի շարք ցրման փորձերի արդյունքում Մանչեսթերի համալսարանում Էռնեստ Ռադերֆորդը հայտնաբերեց ատոմի ներքին կառուցվածքը և պրոտոնը, որը դասակարգեց և բացատրություն տվեց ռադիոակտիվության տարբեր տեսակները։ Նա հաջողությամբ փոխակերպեց առաջին տարրը`ալֆա մասնիկներով ռմբակոծելով ազոտը։ Ատոմի կառուցվածքի վրա կատարած աշխատանքները կատարելագործվել են նրա ուսանողների՝ դանիացի ֆիզիկոս Նիլս Բորի և Հենրի Մոզլիի կողմից։ Քիմիական կապերի և մոլեկուլային ուղեծրերի էլեկտրոնային տեսությունը մշակվել է ամերիկացի գիտնականներ Լայնուս Պոլինգի և Գիլբերտ Լյուիսի կողմից
2011 թվականը ՄԱԿ-ը հայտարարեց Քիմիայի միջազգային տարի[67]։ Այն Մաքուր և Կիրառական Քիմիայի Միջազգային Միության և ՄԱԿ-ի կրթական, գիտական և մշակութային կազմակերպության նախաձեռնությունն էր և ընդգրկում էր քիմիական հասարակություններ, գիտնականներ և հաստատություններ ամբողջ աշխարհում, ապավինում էր անհատական նախաձեռնություններին`տեղական և տարածաշրջանային գործողություններ կազմակերպելու համար։
Օրգանական քիմիան մշակվել է Յուստուս Լիբիխի և այլոց կողմից։ Ֆրիդրիխ Վյոլերը սինթեզեց միզանյութը, որն ապացուցեց, որ կենդանի օրգանիզմները տեսականորեն կարող են դիտարկվել քիմիայում[68]։ 19-րդ դարի մյուս կարևորագույն առաջընթացներն էին՝ կովալենտային կապի ընկալում (Էդվարդ Ֆրենկլանդ, 1852) և թերմոդինամիկայի կիրառությունը քիմիայում (Ջ. Գիբս և Սվանտե Արենիուս, 1870-ականներ)։

Քիմիական երևույթների գիտակցված օգտագործման մասին առաջին տեղեկությունները վերաբերում են Հայաստանի, Միջագետքի, Եգիպտոսի և Չինաստանի տարածքներին։ Հայաստանի տարածքում մետաղներ ու համաձուլվածքներ ստացվել և Միջագետք, Ասորեստան ու այլուր արտահանվել են դեռևս մ.թ.ա. 4-րդ հազարամյակում։ Ենթադրվում է, որ հանքային երկաթն առաջինն օգտագործվել է Հայաստանում մ.թ.ա. 15-րդ դարում։ Խաղողահյութի սպիրտային ու կաթնաթթվային խմորումները, քացախի, գինու և գարեջրի ստացումը հայերին հայտնի են եղել դեռևս մ.թ.ա. 8-րդ դարից։ Միջնադարյան Հայաստանում քիմիական գիտելիքների բարձր մակարդակի մասին է վկայում ոչ միայն ոսկի, արծաթ, պղինձ, այլև մալաքիտ, անուշադր, պաղլեղներ, որդան կարմիր, աղաղանյութեր, օծանելիք արտահանելու փաստը։ Նյութերի հետ միաժամանակ Արևելքի և Արևմուտքի երկրներ են փոխանցվել նաև ալքիմիական գիտելիքներ։ Ալքիմիական այլալեզու ձեռագրերում հաճախ հանդիպում են հայկական կավ, հայկական աղ, հայկական ձու և այլ արտահայտություններ։ Ըստ ռուս ակադեմիկոս Ն. Ֆիգուրովսկու՝ քիմիական գիտելիքները Ռուսաստան են անցել մասամբ Հայաստանից։ Հայ ալքիմիկոսները զբաղվել են ներկերի, թանաքների, ջնարակների, սոսինձների, դեղանյութերի պատրաստմամբ։

Ալքիմիան նախագիտական քիմիան էր, որը ձևավորվել էր 3–4-րդ դարերում Եգիպտոսում։ Այն միջնադարյան մշակույթի յուրահատուկ շերտ է։ Երբ քիմիան դրվեց գիտական հիմքերի վրա, ալքիմիան սկսեցին անվանել հասարակ մետաղներից ազնիվ մետաղներ (ոսկի, արծաթ) ստանալու կեղծ արհեստ, որովհետև ալքիմիկոսները բոլոր մետաղները դիտում էին որպես ծծմբի ու սնդիկի միացություն։ Ալքիմիկոսներն ունեին հատուկ ծածկագրեր, որոնցից շատերը մինչև այսօր էլ վերծանված չեն։ Ոսկին ծածկագրված էր արևի, արծաթը՝ լուսնի, իսկ մյուս հայտնի հինգ մետաղները՝ այն ժամանակ հայտնի մոլորակների նշաններով։
Ալքիմիկոսների ուսումնասիրությունները նպաստեցին քիմիայի՝ որպես գիտության ձևավորմանն ու զարգացմանը. ստացվեցին բազմաթիվ նոր նյութեր, զարգացան մետաղաձուլությունը, ապակեգործությունը, խեցեգործությունը, ներկերի, թղթի, օճառի, ոգելից խմիչքների արտադրությունները։ Քաղաքների աճը և վարակիչ հիվանդությունների տարածումը հանգեցրին բժշկական քիմիայի՝ յատրոքիմիայի ստեղծմանը։ Գիտական քիմիայի ձևավորման սկիզբը համարվում է 17-րդ դարի 2-րդ կեսը, երբ անգլիացի գիտնական Ռ. Բոյլը տվեց քիմիական տարր հասկացության առաջին գիտական սահմանումը։ 18-րդ դարի կեսերին ռուս գիտնական Մ. Լոմոնոսովը մշակեց նյութի կառույցի ատոմամոլեկուլային ուսմունքը, իսկ 18-րդ դարի 2-րդ կեսին ֆրանսիացի քիմիկոս Ա. Լավուազիեի կողմից քիմիական ռեակցիաներում նյութի զանգվածի պահպանման օրենքի ձևակերպումով ավարտվեց քիմիան իսկական գիտության վերափոխվելու շրջանը։ 19-րդ դարի սկզբին անգլիացի գիտնական Ջ. Դալթոնը ստեղծեց քիմիական ատոմիստիկայի հիմունքները, իսկ իտալացի գիտնական Ա. Ավոգադրոն ներմուծեց մոլեկուլ հասկացությունը։ Նյութի կառույցի ատոմամոլեկուլային պատկերացումները հաստատվեցին 1860-ական թվականներին, երբ ռուս քիմիկոս Ա. Բուտլերովը մշակեց օրգանական միացությունների կառուցվածքի տեսությունը, իսկ Դ. Մենդելեևը բացահայտեց պարբերական օրենքն ու կազմեց տարրերի պարբերական համակարգը։
Քիմիայի հետ սերտ շփման պայմաններում են զարգանում կենսաքիմիան, ագրոքիմիան, երկրաքիմիան և այլ քիմիական գիտություններ։ Քիմիական տեխնոլոգիան զբաղվում է արտադրական մասշտաբներով քիմիական նյութերի ստացման գիտական ու տեխնոլոգիական հարցերի մշակումով և իրականացմամբ։ Քիմիան, ինչպես բժշկագիտությունն ու կենսաբանությունը, ունի առանձնահատուկ լեզու, որով նշանակվում և անվանվում են քիմիական միացությունները։ Այդ լեզվի կանոնները համակարգող ուղղությունը կոչվում է քիմիական անվանակարգություն (նոմենկլատուրա)։ Ազգային (հայերեն) քիմիական անվանակարգություն մշակել ու 19-րդ դարում օգտագործել են Մխիթարյան միաբանության բնագետները, ինչը ներկայումս գործածվում է մասամբ։ Քիմիական ռեակցիաները պատկերում են քիմիական հավասարումներով։ Մեր շուրջն ամենուր ընթանում են բազմաթիվ ու բազմատեսակ ռեակցիաներ, որոնցով բնությունը նորանում ու վերականգնվում է, թափոնները նեխում ու վերանում են, քիմիական գործարաններում սինթեզվում են բազմազան նյութեր։ Այսպիսով, մարդն ամենուր և ամեն պահի առնչվում է քիմիական ռեակցիաների հետ, որոնց խելամիտ ու նպատակային օգտագործման համար անհրաժեշտ է սովորել այս զարմանահրաշ ու շատ պիտանի գիտությունը։
Հայաստանում քիմիական առաջին գիտական օջախն ստեղծվել է 1921 թվականին Երևանի պետական համալսարանում, որտեղ Ս. Ղամբարյանի, Ա. Հակոբյանի, Լ. Ռոտինյանի, Պ. Քալանթարյանի, Հ. Ակունյանի և այլոց ջանքերով ձևավորվել է հայկական քիմիական դպրոցը։ Նրանք ուսումնասիրել են այդ շրջանում տնտեսության համար կարևոր հարցեր, հետազոտել Արարատյան դաշտի կրաքարերը, կավահողերը, մերձարաքսյան ճահիճները, բազալտներն ու դրանց հալման արգասիքները։ Ներկայումս քիմիական գիտությունը Հայաստանում գիտության զարգացած ճյուղերից է. գործում են մի շարք քիմիական ինստիտուտներ ու լաբորատորիաներ։
Հայ հայտնի քիմիկոսներից են Ա. Մնջոյանը, Ա. Նալբանդյանը, Մ. Մանվելյանը և ուրիշներ։
Մատենադարանի ձեռագրերում առանձնանում են նաև քիմիա գիտությանը վերաբերող աշխատությունները, որոնք ներկայանում են Հովհաննես Երզնկացու (1283) «Վասն նյութի ու տեսակի», ինչպես նաև անանուն հեղինակների «Խրատք ոսկվո հալելու» (16-րդ դար) և «Դեղաբուսակ» խորագրերը կրող երկերով, հետաքրքրական է, որ վերջին աշխատանքում տրված են նաև դեղաբույսերի նկարները և դրանց պարսկերեն անունները, որպեսզի օգտվողները դեղեր պատրաստելիս չշփոթեն բույսերը։
Հովհաննես Երզնկացին զանազան տեղեկություններ է հայտնում աղերի, հանքերի, թթուների, գազերի միացման կամ տարազատման ժամանակ առաջացող նոր նյութերի վերաբերյալ։ Նա կարծում է, որ բնության հիմքում ընկած նյութը հավիտենական է, այն կարող է փոխել իր որակը, վերածվել այլ նյութի, բայց երբեք չի ոչնչանում։
Մատենադարանում պահվող մատյաններն իրենց թերթերի վրա փայլփլող ընդմիշտ թարմ ներկերով ու թանաքներով, կազմերի կաշվով, արծաթով և բազմաստիճան մշակում ստացած մագաղաթով և զանազան այլ մանրամասներով անառարկելիորեն վկայում են միջնադարյան Հայաստանում գոյություն ունեցած համապատասխան քիմիական գիտելիքների, սարքավորումների ու միջոցների մասին, որոնց առկայությամբ միայն հնարավոր է արտադրել նշված նյութերը։ Գրիչներն ու նկարիչները երբեմն հայտնում են ներկերի ու թանաքների ստացման եղանակներն ու դեղատոմսերը, որոնց ուսումնասիրությունը կարող է նպաստել բարձրորակ ներկեր ստանալու գործին։
Քիմիան բաժանվում է մի քանի հիմնական ենթաբաժինների։ Կան նաև քիմիայի մի քանի ավելի մասնագիտացված ոլորտներ[69]։
Քիմիայի մեջ մտնող մյուս առարկաները ավանդաբար խմբավորված են ըստ ուսումնասիրվող նյութի տեսակի կամ ուսումնասիրության տեսակի։ Դրանք ներառում են անօրգանական քիմիա- անօրգանական նյութերի ուսումնասիրություն, օրգանական քիմիա- օրգանական (ածխածնի վրա հիմնված) նյութի ուսումնասիրություն, կենսաքիմիա- կենսաբանական օրգանիզմներում հայտնաբերված նյութերի ուսումնասիրություն, ֆիզիկական քիմիա- քիմիական պրոցեսների ուսումնասիրություն, օգտագործելով ֆիզիկական հասկացություններ, ինչպիսիք են թերմոդինամիկան և քվանտային մեխանիկա և վերլուծական քիմիա- նյութերի նմուշների վերլուծություն`դրանց քիմիական կազմի և կառուցվածքի վերաբերյալ պատկերացում կազմելու համար։ Վերջին տարիներին շատ ավելի մասնագիտացված առարկաներ են ի հայտ եկել, օրինակ՝ նյարդաքիմիա նյարդային համակարգի քիմիական ուսումնասիրություն։
Այլ ոլորտներն են ՝ ագրոքիմիա, աստղաքիմիա (տիեզերաքիմիա), մթնոլորտային քիմիա, քիմիական ճարտարագիտություն, քիմիական կենսաբանություն, քիմիատեխնիկա, էլեկտրաքիմիա, շրջակա միջավայրի քիմիա, ֆեմտոքիմիա, բույրերի քիմիա, հոսքի քիմիա, երկրաքիմիա, կանաչ քիմիա, հյուսվածքների քիմիա, քիմիայի պատմություն, ջրածնացման քիմիա, իմունաքիմիա, ծովային քիմիա, նյութերի գիտություն, մաթեմատիկական քիմիա, մեխանոքիմիա, դեղորայքային քիմիա, մոլեկուլային կենսաբանություն, մոլեկուլային մեխանիկա, նանոտեխնոլոգիա, բնական արտադրանքի քիմիա, էնոլոգիա, օրգանոմետալ քիմիա, նավթաբանություն, դեղագործություն, ֆոտոքիմիա, ֆիզիկական օրգանական քիմիա, ֆիտոքիմիա, պոլիմերային քիմիա, ռադիոքիմիա, պինդ վիճակի քիմիա, սոնոքիմիա, գերմոլեկուլային քիմիա, մակերևույթային քիմիա, սինթետիկ քիմիա, ջերմաքիմիա և այլն։
Քիմիական արդյունաբերությունը կարևոր տնտեսական գործունեություն է ամբողջ աշխարհում։ Քիմիական արտադրության համաշխարհային առաջատարներից 50-ը 2013-ին ունեցել է 980,5 միլիարդ ԱՄՆ դոլարի վաճառք՝ 10.3 տոկոս շահույթով[71]։
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.