Inmunofluorescencia
From Wikipedia, the free encyclopedia
A inmunofluorescencia é unha técnica usada en microscopía óptica con microscopio de fluorescencia, que se aplica principalmente a mostras microbiolóxicas. Esta técnica usa a especificidade dos anticorpos co seu antíxeno para dirixir tinguiduras fluorescentes a biomoléculas diana específicas que se encontran dentro da célula, o que permite a visualización da distribución da molécula diana pola mostra. A rexión específica que recoñece un anticorpo sobre un antíxeno denomínase epítopo.[1] Houbo que facer grandes esforzos para poñer a punto o mapado de epítopos, xa que moitos anticorpos poden unirse ao mesmo epítopo e o grao de unión entre anticorpos que recoñecen o mesmo epítopo pode variar.[2] Adicionalmente, a unión dun fluoróforo ao anticorpo non pode interferir coa especificidade inmunolóxica do anticorpo ou a capacidade de unión ao seu antíxeno.[3] A inmunofluorescencia é un exemplo moi utilizado de inmunotinguidura (uso de anticorpos para marcar proteínas) e é un exemplo específico de inmunohistoquímica (uso da relación anticorpo-antíxeno nos tecidos). Esta técnica fai uso principalmente de fluoróforos para visualizar a localización dos anticorpos.[4]
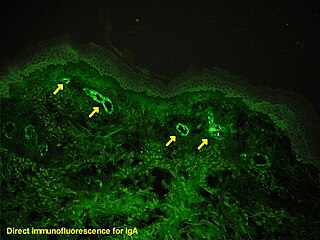

A inmunofluorescencia pode utilizarse en cortes de tecidos, liñas celulares cultivadas ou células individuais, e pode servir para analizar a distribución de proteínas, glicanos e pequenas moléculas biolóxicas e non bioloxicas. Esta técnica pode incluso utilizarse para visualizar estruturas como os filamentos intermedios do citoesqueleto.[5] Se aínda non se determinou a topoloxía dunha membrana plasmática, pode utilizarse a inserción de epítopos nas proteínas en conxunción coa inmunofluorescencia para determinar estruturas.[6] A inmunofluorescencia pode usarse tamén como método "semicuantitativo" para estudar os niveis e padróns de localización da metilación do ADN, pero é un método que require máis tempo que os métodos verdadeiramente cuantitativos e hai certa subxectividade na análise dos niveis de metilación.[7] A inmunofluorescencia pode aplicarse en combinación con outros métodos de marcaxe fluorescente que non usan anticorpos, por exemplo, o DAPI para etiquetar o ADN. Para a análise de mostras de inmunofluorescencia poden utilizarse varios deseños de microscopios; o máis simple son o microscopio de epifluorescencia e o microscopio confocal. Disponse tamén de varios deseños de microscopio de super-resolución igualmente útiles nos estudos de inmunofluorescencia.[8]
Tipos
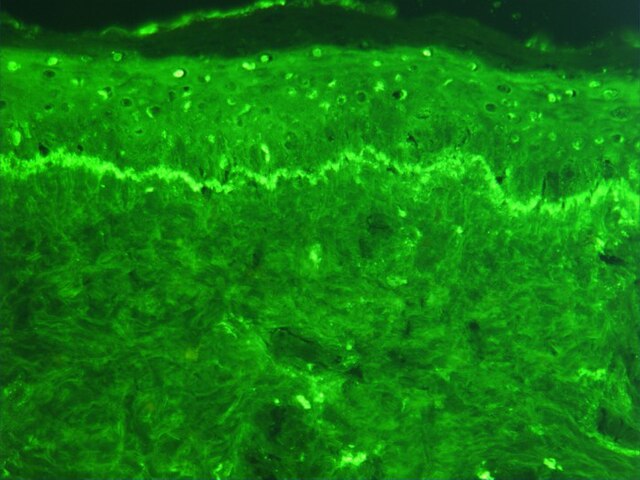
Preparación da fluorescencia
Para producir anticorpos etiquetados con fluorocromo, debe conxugarse ("etiquetaxe ou marcaxe") un fluorocromo co anticorpo. Igualmente, un antíxeno pode conxugarse tamén co anticorpo cunha sonda fluorescente nunha técnica chamada técnica do antíxeno fluorescente. Os procedementos de marcaxe fluorescente poden aplicarse tanto a antíxenos fixados no citoplasma coma a antíxenos da superficie celular de células vivas, o que se chama "inmunofluorescencia de membrana". Tamén é posible etiquetar o complemento do complexo antíxeno-anticorpo cunha sonda de fluorescencia. Ademais dos elementos aos cales están unidos as sondas de fluorescencia, hai dúas clases xerais de técnicas de inmunofluorescencia: primaria (ou directa) e secundaria (ou indirecta). As seguintes descricións céntranse principalmente nesas clases en termos de anticorpos conxugados.[3]
Distinguiremos, pois, dúas clases de técnicas de inmunofluorescencia: directa (ou primaria) e indirecta (ou secundaria).
Directa ou primaria
A inmunofluorescencia directa ou primaria usa un só anticorpo, primario, quimicamente ligado a un fluoróforo. O anticorpo primario recoñece a molécula diana (antíxeno) e únese a unha rexión específica chamada epítopo. O fluoróforo unido pode ser detectado por microscopía fluorescente, a cal, dependendo do mensaxeiro usado, emitirá ao ser excitado unha luz de lonxitude de onda específica.[9] A inmunofluorescencia directa, aínda que algo menos común, ten notables vantaxes sobre o procedemento indirecto ou secundario. A unión directa do mensaxeiro ao anticorpo reduce o número de pasos no procedemento, aforrando tempo e reducindo o sinal de fondo non específico.[10] Isto tamén limita a posibilidade de reactividade cruzada do anticorpo e posibles erros durante o proceso.
Porén, hai algunhas desvantaxes neste método. Como o número de moléculas fluorescentes que pode estar unido a un anticorpo primario é limitado, a inmunofluorescencia directa é substancialmente menos sensible que a indirecta e pode orixinar falsos negativos. A inmunoflorescencia directa tamén require o uso de moita máis cantidade de anticorpo primario, o cal é extremadamente caro.
Indirecta ou secundaria
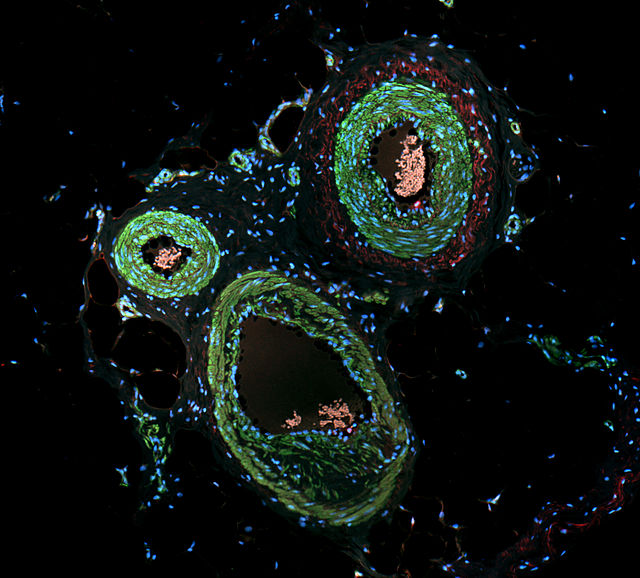
A inmunofluorescencia indirecta ou secundaria utiliza dous anticorpos; o primeiro anticorpo non etiquetado (primario) únese especificamente á molécula diana, e o anticorpo secundario, que leva o fluoróforo, recoñece o anticorpo primario e únese a el. Poden unirse múltiples anticorpos secundarios a un só anticorpo primario. Isto proporciona unha amplificación do sinal ao incrementar o número de moléculas de fluoróforos por antíxeno.[10] Este protocolo é máis complexo e leva moito máis tempo que o protocolo directo ou primario explicado antes, pero permite máis flexibilidade porque pode utilizarse unha variedade de distintos anticorpos secundarios e as técnicas de detección para un determinado anticorpo primario.[10]
Este protocolo é posible porque un anticorpo consta de dúas partes, unha rexión variable (que recoñece o antíxeno) e unha rexión constante (que determina a estrutura da molécula do anticorpo). En realidade a molécula de anticorpo ten catro cadeas polipeptídicas: dúas cadeas pesadas e dúas lixeiras. Un investigador pode xerar varios anticorpos primarios que recoñecen varios antíxenos (teñen diferentes rexións variables), pero que todos comparten a mesma rexión constante. Todos estes anticorpos poden, por tanto, ser recoñecidos por un só anticorpo secundario. Isto aforra o custo de modificar os anticorpos primarios para que porten directamente o fluoróforo.
Xéranse diferentes anticorpos primarios con diferentes rexións constantes tipicamente estimulando a produción do anticorpo en diferentes especies. Por exemplo, poderíase crear anticorpos primarios nunha cabra que recoñecen varios antíxenos, e despois empregar anticorpos secundarios de coello acoplados á tinguidura, que recoñecen a rexión constante do anticorpo de cabra (anticorpos de "coello anti-cabra"). Pódese despois crear un segundo conxunto de anticorpos primarios nun rato que poderían ser recoñecidos por un anticorpo secundario separado de "burro anti-rato". Isto permite a reutilización en múltiples experimentos dos difíciles de producir anticorpos acoplados a tinguidura.
Limitacións
Como ocorre coa maioría das técnicas florescentes, un problema significativo na inmunofluorescencia é o fotoblanqueo (photobleaching). A perda de actividade causada polo fotoblanqueo pode ser controlada reducindo ou limitando a intensidade ou a duración temporal da exposición á luz, incrementando a concentración dos fluoróforos ou empregando fluoróforos máis robustos que teñen menor tendencia a blanquearse (por exemplo, Alexa Fluors, Seta Fluors ou DyLight Fluors). Algúns problemas que poden xurdir nesta técnica son a autofluorescencia, a fluorescencia específica non desexada superflua e a fluorescencia non específica. A autofluorescencia inclúe a fluorescencia emitida desde o propio tecido ou célula mostra. A fluorescencia específica non desexada superflua aparece cando un antíxeno diana é impuro e contén contaminantes antixénicos (superfluos ou estraños). A fluorescencia non específica implica a perda da especificidade dunha sonda debido ao fluoróforo, a partir da fixación impropia ou a partir dun espécime desecado.[3]
A inmunofluorescencia só está limitada a células fixadas (é dicir, mortas) cando estruturas do interior da célula teñen que ser visualizadas porque os anticorpos non penetran a través da membrana plasmática cando reaccionan coas etiquetas florescentes. O material antixénico debe ser fixado firmemente no sitio da súa localización natural dentro da célula.[3] Os anticorpos intactos poden tamén ser demasiado grandes para tinguir células cancerosas in vivo.[11] O seu tamaño ten como resultado unha lenta penetración no tumor e vida media circulante longa. Investigouse no uso dos chamados diacorpos (diabodies) para sortear esta limitación.[11] Como as proteínas do sobrenadante ou do exterior da membrana plasmática poden unirse aos anticorpos, isto permite tinguir células vivas. Dependendo do fixador que se use, as proteínas de interese poderían establecer enlaces cruzados entre elas e isto podería ter como resultado sinais de falso positivo ou falso negativo debido a unións non específicas.
Unha estratexia alternativa é utilizar proteínas recombinantes que conteñen dominios de proteína fluorescente, por exemplo, a proteína fluorescente verde (GFP). O uso de ditas proteínas "etiquetadas" serve para a determinación das súas localizacións dentro da célula viva. Aínda que isto parece ser unha alternativa elegante á inmunofluorescencia, as células teñen que se transfectadas ou transducidas coa etiqueta GFP, e como consecuencia convértense en organismos con risco de seguridade biolóxica 1 ou S1 (ou incluso un nivel superior), que requiren aplicar máis estritos estándares de seguridade no laboratorio. Esta técnica implica a alteración da información xenética das células.[12]
Avances
Moitas dos avances neste método dependen das melloras nos microscopios de fluorescencia e os fluoróforos. Os métodos de super-resolución dependen da capacidade dun microscopio de producir unha resolución por debaixo do límite de Abbe (un límite que ten a luz debido á súa lonxitude de onda). Este límite de difracción é duns 200-300 nm na dirección lateral e de 500-700 nm na dirección axial. Este límite é comparable ou maior que algunhas estruturas da célula, e en consecuencia, este límite impide determinar detalles da súa estrutura.[13] A super-resolución en fluorescencia, máis especificamente, refírese á capacidade dun microscopio de impedir a fluorescencia simultánea de fluoróforos adxacentes espectralmente idénticos.[13][14] Exemplos de métodos de microscopía de fluorescencia de super-resolución desenvolvidos recentemente son a microscopía de depleción de emisión estimulada (STED), a microscopía de iluminación estruturada saturada (SSIM), a microscopía de localización de fotoactivación de fluorescencia (FPALM), e a microscopía de reconstrución óptica estocástica (STORM).[15]
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
