Top Qs
Chronologie
Chat
Contexte
Bacillus thuringiensis
bactérie De Wikipédia, l'encyclopédie libre
Remove ads
Bacillus thuringiensis[2] (souvent abrégé en Bt) est une espèce de bactérie utilisée pour ses propriétés insecticides. C'est un bacille Gram positif, aérobie facultatif, ubiquiste et sporulé. On le retrouve en faible quantité dans pratiquement tous les sols, l'eau, l'air et le feuillage des végétaux. Il fait partie d'un ensemble de six bacilles dénommé « groupe Bacillus cereus » : B. anthracis (responsable de la maladie du charbon), B. cereus, B. mycoides, B. pseudomycoides, B. weihenstephanensis et B. thuringiensis.


Bacillus thuringiensis a été isolé en 1901 par le bactériologiste japonais S. Ishiwata à partir de vers à soie qu'il peut infecter et tuer mais sa première description scientifique est due à l'allemand Ernst Berliner (de) en 1911.
L'acronyme Bt désigne aussi fréquemment la molécule pesticide (insecticide, acaricide...), parfois dénommée thuringiensine, obtenue à partir de cette bactérie (ou des bactéries proches telles que Bacillus sphaericus), ou encore produite par génie génétique par des plantes (OGM) dans lesquelles on a introduit certains fragments du génome de cette bactérie.
En 2006, le Bt était le biopesticide le plus utilisé (comme bio-insecticide) avec plus de 90 % du marché des bioinsecticides, mais seulement 2 % à peine du marché global des insecticides (Fargues et Bourguet 2005). Il est aussi produit par les plantes transgéniques, sans effet sur certaines espèces d’insectes qui y sont devenues résistantes ou plus ou moins bien dans certains cas.
Remove ads
La bactérie
Description
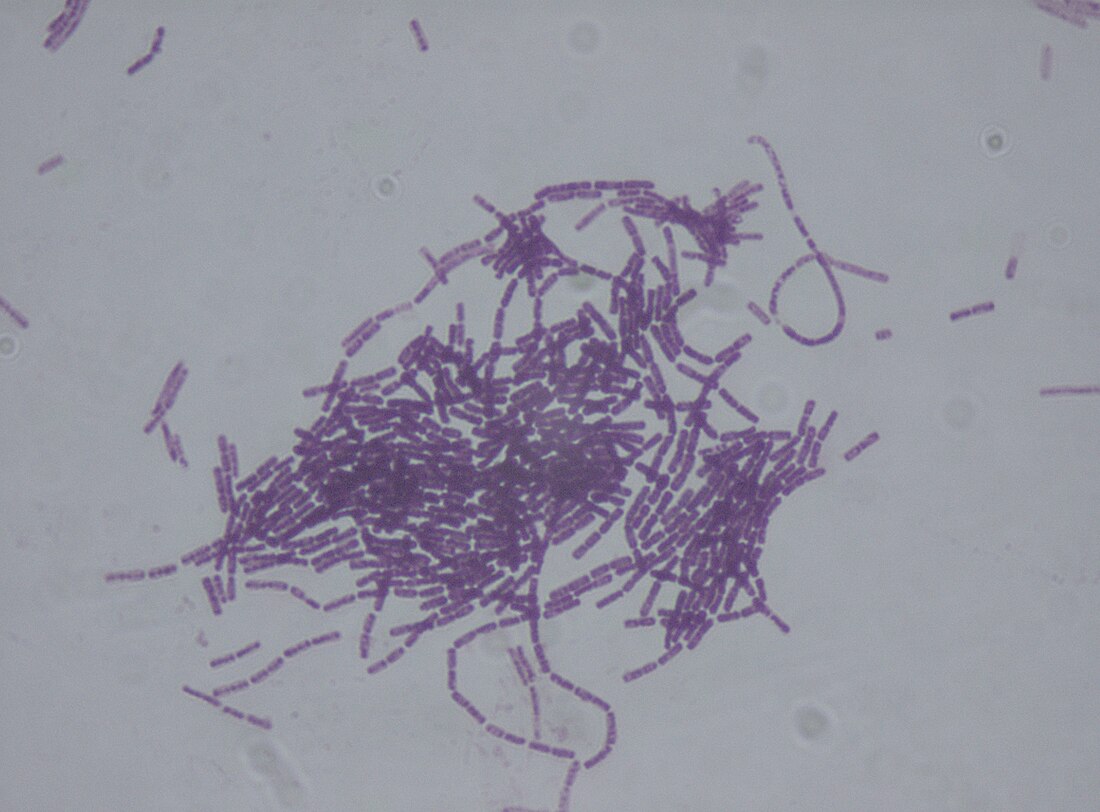
À l'état végétatif, le bacille Bacillus thuringiensis a la forme d'un bâtonnet de 5 µm de long sur 1 µm de large, pourvu de flagelles.
Il se distingue des autres bacilles du groupe cereus par sa capacité à synthétiser et excréter des δ
-endotoxines qui sont des cristaux (Cri) mortellement toxiques pour certains insectes et certains invertébrés. Ces cristaux ne sont pas minéraux, mais protéiques (formés de l'association de plusieurs protéines qui, ensemble, ont une propriété insecticide sur les larves de lépidoptères, les coléoptères et/ou les diptères). Elles agissent en détruisant les cellules de l'intestin moyen de la larve d'insecte atteint par ces toxines, ce qui aboutit à la mort de l'insecte, qui peut alors être consommé par le bacille.
On connaît actuellement plus de 14 gènes codant ces protéines dénommées "Cri" (pour protéine cristal) par les biochimistes.
Les endotoxines produites par Bacillus thuringiensis
La bactérie synthétise des δ-endotoxines au moment de sa sporulation.
Ce sont des inclusions de cristaux qui peuvent alors composer 20 à 30 % du poids sec des cellules sporulées[3],[4]. Elles sont essentiellement composées de :
- une ou plusieurs protéines dites (Crystal ou Cry) ; ce sont des protoxines d'environ 70 kDa ou 130 kDa dont la forme toxique est de 66-67 kDa (moitié N-terminal e du précurseur) classées parmi les PFT (Pore-Forming Toxin) dans la catégorie des toxines en hélices-α (hélices formant un pore transmembranaire[5]. On parle de « prototoxines » car ces molécules ne deviennent toxiques qu'après avoir été excrétées ou libérées par la bactérie productrice, quand elles sont en quelque sorte « activées » par certaines protéases de l’hôte ; elles se lient alors à certains récepteurs membranaires de la cellule cible en formant un oligomère[6] pouvant s’insérer dans la membrane cellulaire et bloquant certains processus vitaux.
Plus de 150 protéines Cry ont été découvertes rien que chez B. thuringiensis et cereus[7] ; selon leur forme, elles peuvent être utilisées pour cibler des groupes d'insectes différents (Lépidoptères, Diptères, Coléoptères, Hyménoptères, Homoptères, Orthoptères, Mallophages, mais aussi des acariens, nématodes et même des protozoaires[8],[9] ; - des protéines cytolytiques (Cyt).
Remove ads
Utilisations
Résumé
Contexte
Les vertus entomotoxiques de Bacillus thuringiensis ont suscité un intérêt agricole, sylvicole et commercial dès les années 1920 (avec des essais de lutte biologique conduits en Hongrie) et dans les années 1930 (en Yougoslavie) afin de contrôler des insectes (Lépidoptères notamment)[8]. Cet intérêt s'est renouvelé — de manière bien plus marquée — à la fin du XXe siècle avec le développement du génie génétique et de l'agriculture biologique.
Les premières applications de Bacillus thuringiensis dans l'environnement dateraient de 1930. Elle a ensuite été utilisée dès les années 1950 dans les forêts, les champs et les vignobles.
Jusqu'au milieu des années 1970, sa principale application était la lutte contre les lépidoptères défoliateurs dans les forêts et certains papillons parasites des grandes cultures, du maïs notamment.
En 1976, la découverte de deux sérotypes dits israelensis (« Bti ») et tenebrionis (Btt) a permis l'ouverture de nouveaux marchés, grâce à une action larvicide sur les moustiques, les simulies et les coléoptères.
Aujourd'hui la bactérie Bacillus thuringiensis est l'insecticide le plus utilisé au monde en agriculture biologique[10],[11].
Ce produit, lorsqu'il est d'origine naturelle, est autorisé en agriculture bio, sous forme de poudre.
La toxine Bacillus thuringiensis (Bt) est également utilisé dans des OGM (maïs Bt, Coton Bt, etc.) ce qui a permis de remplacer les insecticides chimiques dans une large gamme de cultures[12] bien que des souches de ravageurs des cultures devenues résistantes au Bt commencent à poser des problèmes.
En France, il sert notamment à désinsectiser la Camargue [13] et la Charente-Maritime [14].
Remove ads
Avantages et inconvénients
Résumé
Contexte
Toxicité
La toxicité du Bt pur pour des animaux à sang chaud n'est pas nulle[15].
Ainsi la thuringiensine purifiée inhalée présente une toxicité pulmonaire significative chez le rat de laboratoire (souche Sprague-Dawley, traité via l'instillation intratrachéale) avec 0 ; 0,4; 0,8; 1,6; 3,2 ; 6,4 et 9,6l mg de thuringiensine par kg de poids corporel. La DL50 aiguë pulmonaire est de 4,4 mg/kg. Et le nombre de cellules inflammatoires et la quantité de lactate déshydrogénase (LDH) dans le lavage broncho-alvéolaire (LBA) augmentent de manière « dose-dépendante »[15].
Avec une dose efficace de 1,6 mg/kg retenue pour l'étude de l'évolution temporelle de la toxicité pulmonaire, le poids des poumons a augmenté chez les rats traités, ainsi que le taux d'hydroxyproline pulmonaire et le nombre total de cellules trouvées dans le LBA 2, 4, 7, 14, 28 et 56 jours après le traitement. Par rapport aux témoins, les taux de protéines totales du LBA ont augmenté de 361, 615, 116, 41, 34 et 41 %, après respectivement 2, 4, 7, 14, 28 et 56 jours[15]. L'activité de l'enzyme LDH dans le LBA a montré une augmentation significative après 1, 2, 4, 7, 14, 28 et 56 jours, et le taux de fibronectine s'est élevé de 164, 552, 490, 769, 335, 257 et 61 %, mais ni le facteur de nécrose tumorale, ni l'interleukine-1 ont augmenté[15]. L'histologie des rats traités était anormale (avec une inflammation bronchiolitique et des alvéoles puis nécroses cellulaires dans les bronches aux jours 1 et 2, avec des zones d'épaississement septal, infiltration cellulaire et dépôt de collagène dans les espaces alvéolaires et intestinaux durant les jours 4 à 5 6. La thuringiensine purifiée présente donc une toxicité pulmonaire chez le rat[15] et le stress oxydatif semble en cause[16]. La thuringiensine peut aussi négativement agir sur l'adenylate cyclase dans le cerveau du rat[17].
Degré de persistance dans l'air, l'eau, les sols
On a montré à la fin des années 1970 que la thuringiensine (ou toxines dites Bt) est une protéine cristalline très sensible aux rayons ultraviolets solaires qui la dégradent rapidement[18].
Elle est également très instable en phase aqueuse[19] et sa demi-vie diminue quand la température monte[19]. Le Bt utilisé en pulvérisation a donc l'avantage d'être peu rémanent sur les feuilles (un peu plus dans le sol), avec l'inconvénient d'être actif moins longtemps.
Cependant l'industrie des biotechnologies a produit des plantes transgéniques dite "Bt", c'est-à-dire modifiées par ajout d'un ou plusieurs des gènes codant la toxine insecticide (Cry1Ab) de Bacillus thuringiensis.
Ces plantes en produisent dans leurs tissus aériens (feuilles et tige), dans leur pollen, mais également dans les exudats de la sphère racinaire (rhizosphère), d'où le Bt pourrait peut-être s'accumuler plus longtemps dans le sol (une étude de 2002 n'en a pas trouvé dans le sol de cultures de coton transgénique[20] mais la molécule peut être fortement adsorbée sur l'argile.
Selon N Helassa (2008) l'adsorption de la toxine sur les argiles du sol est une interaction de faible affinité, fortement dépendante du pH mais difficilement réversible (d'après des tests faits sur de la montmorillonite)[21]. Dans un sol argileux, la mobilité de la protéine dépendra alors de l'érosion, de transports de colloïdes et du degré de bioturbation du sol concerné. Par ailleurs, des travaux ayant porté sur la persistance de la toxine Bt dans le sol ont conclu que (dans les conditions de cette étude) plus de 50 % de l’immuno-réactivité de la toxine était perdue en moins de 7 jours[21] ; la dégradation semble ne pas être due à des microbes : « la toxine ne soit pas dégradée mais plutôt inactivée par des changements de conformations à la suite de son interaction avec les composants du sol »[21]. Des études (au champ et en laboratoire) visent à améliorer la compréhension des phénomènes d’adsorption/désorption de la protéine Bt dans le sol[21].
- Dans les années 2010 on a montré en France (Camargue) lors de tests d'utilisation du bacille dans des zones riches en moustiques, que les spores de la bactérie Bti persistent dans certains environnements. On l'a retrouvé en 2012 dans les sédiments de marais à inondations prolongées[22] puis (persistante et continuant à se multiplier durant jusqu'à plusieurs années après la fin du dernier épandage) dans les sédiments (en particulier dans les sédiments de roselières, jonchaies et scirpaies). En Camargue une "baisse inexpliquée dans la densité des spores de Bti" a cependant été observée après quelques années sur certains sites.
Risques liés à la persistance ou à la circulation du transgène dans l'environnement
Le niveau de risque est discuté et il n'existe pas encore de consensus scientifique à ce propos.
- Les gènes cry1Ab codant la production de protéines (« delta endotoxine ») dans le maïs nord-américain proviennent de B. thurigiensis kurstaki (Btk), bactérie très pathogène pour les papillons. Une étude a évalué la fréquence et la persistance du gène cry1Ab du maïs bt ou du bacille dans les milieux aquatiques, ou à proximité de champs où du maïs Bt a été cultivé.
L’étude a été précédée d’une validation méthodologique de préparation des échantillons et d’extraction de l’ADN (par PCR) dans différentes matrices (eau, sol, sédiment...). Des eaux de surface et des sédiments artificiellement enrichis avec une quantité connue d’ADN génomique provenant de bacilles ou de maïs Bt ont ensuite été étudiés in vitro, pour évaluer la persistance du gène cry1Ab. Enfin, du sol, des sédiments, de l'eau et d'autres échantillons ont été collectés avant les semis, puis 15 jours après la libération du pollen de maïs, après la récolte mécanique et lors du labour (enfouissement des racines) pour y mesurer la présence de gènes cry1Ab.
Le gène cry1Ab s’est montré persistant durant en moyenne 21 jours dans les eaux de surface et presque deux fois plus longtemps (41 jours) dans les sédiments. Dans les sédiments argilo-sableux, le gène était encore présent après 40 jours. L’étude a aussi montré que les gènes cry1Ab provenant du maïs transgénique ou de source naturelle sont plus abondant dans les sédiments que dans les eaux de surface. Le transgène cry1Ab est transporté par le courant. Le transgène a été détecté dans la rivière Richelieu et le fleuve Saint-Laurent jusqu’à (82 km en aval de la zone de culture) suggérant de multiples apports de ce gène, ou qu’il est transporté sur de longues distances avant d’être dégradé.
Le transgène cry1Ab issu du maïs Bt tend à diminuer au fur et à mesure que l’on s'éloigne des cultures de maïs Bt, et il est d’autant plus présent dans les sédiments qu’il l’est dans les eaux de surface (Corrélation significative : R = 0,83; P = 0,04). L’étude[23] a donc conclu que l'ADN de maïs Bt et de Bt persiste dans les milieux aquatiques, et qu’il est présent dans les rivières drainant les zones agricoles et en aval. Or les bactéries sont dans certaines conditions (stress) susceptibles d'intégrer les gènes d'autres bactéries.
Persistance et impacts sur les écosystèmes
- A l'abri du soleil, les spores de Bti persistent dans les sols et les vases de marais à inondations prolongées[24],[25],[26],[27] ; la toxine Bt persiste un certain temps dans le sol et plus encore sédiments.
Dans les sols les toxines synthétisées par la bactérie modifient la communauté des invertébrés[28] et dans le sédiment ils affectent les organismes benthiques, maillon essentiel des réseaux trophiques des zones humides[22]. Ils peuvent affecter des espèces non-cibles[29] - Certains chercheurs, dont en France l'écotoxicologue Jean-François Narbonne, ont au début des années 2000 alerté sur le fait le Bt issu de plantes transgéniques, en s'accumulant puisse finir par poser des problèmes : toxicité du sol contaminé, accumulation dans les sédiments toxique dans les fleuves et estuaires. On en a d'abord trouvé dans le fleuve Saint-Laurent au Canada, en aval des zones de grande culture, puis Todd Royer, coauteur d’une étude américaine récente (2007)[30] renforce et relaye cette inquiétude aux États-Unis. Les analyses faites sur 12 sites de l’Indiana (États-Unis) ont en effet montré que les taux de Bt deviennent effectivement préoccupants dans les cours d'eau, au point d’affecter certains invertébrés aquatiques jugés bioindicateurs de la qualité des écosystèmes aquatiques (ex : grande phrygane), dont la croissance est affectée par cette toxine, qui tue la phrygane à forte dose. Cette étude, qui a porté sur 12 sites choisis dans l’État de l’Indiana, attribue l’origine de ce Bt aux maïs transgéniques cultivés dans les bassins versants de ces rivières. Ils y libèrent des toxines Bt dans l’environnement du bassin versant, d’où elles sont apportées jusqu’aux fossés et rivières par le ruissellement. L'étude évoque notamment pour la première fois le rôle des pollens et des déchets ou résidus de maïs comme source non négligeable de toxines. Ces derniers peuvent s'accumuler, se dégrader et être transportés par l'eau vers le bas des bassins versants. Le pollen du maïs est assez lourd pour ne pas être transporté loin par le vent (sauf tempête printanière)[31], mais ce pollen de forme très arrondie et dépourvu de spicules est facilement emporté par le ruissellement et peut alors se concentrer en certains points (flaques, ornières, fossés, sédiments des cours d'eau). Le poids de pollen émis annuellement par hectare est faible, le nombre de grains de pollen est très élevé et les émissions se font massivement en quelques jours ou semaines, à la fin du printemps et au début de l'été à un moment important pour de nombreuses espèces (reproduction/ponte ou croissance des alevins). Beaucoup d'études ont concerné la dispersion des pollens viables, mais on a peu d'informations sur leur devenir dans l'environnement et notamment dans le sol où le Bt peut s'accumuler car y étant à l'abri des UV solaire[21].
Les auteurs notent que le maïs nord-américain est de plus en plus OGM (presque exclusivement), et sa surface s'est encore accrue dans les plaines du Midwest pour produire des agrocarburants. Ce maïs est justement souvent planté à proximité de fleuves et rivières ou de zone irrigables, car c'est une plante particulièrement consommatrice en eau.
Des tests de nourrissage d'insectes aquatiques avec du Bt, réalisés lors de cette étude ont montré qu'à faible dose le Bt inhibait leur croissance, et qu'à dose plus élevée il augmentait les taux de mortalité.
Ainsi contrairement aux affirmations de l’EPA en 1996 lors de l’autorisation du premier maïs OGM américain, le Bt pourrait avoir des impacts collatéraux sur des espèces non-ciblées. Les premiers tests avaient été faits avec des daphnies qui sont des crustacés d’eau douce et qui ne semblent pas affectées par le Bt. - L'usage du Bti (notamment utilisé pour la démoustication) a un effet indirect fort sur la faune non-cible en zone humide, réduisant la richesse et l'abondance des microcrustacés (daphnies...), des odonates, des araignées et indirectement des hirondelles des fenêtres (en affectant leurs proies: moustiques et chironomes)[22].
- Il semble que les formulations de pesticides à base de Bt puissent être létales pour les larves d'amphibiens[32].
Risque de résistance
- Enfin, l'apparition de souches d'insectes résistantes chez des insectes ou autres invertébrés visés par le Bt (ou qui y seraient involontairement très exposés) doit être prise en compte dans les stratégies de lutte[33], notamment dans le cas des grandes cultures, transgéniques tout particulièrement où le produit est abondamment diffusé dans l'environnement[34],[35],[36],[37].
Des cas de résistance (voire de forte résistance[38]) sont déjà documentés[39], dont chez les moustiques piqueurs et des insectes posant des problèmes pour les cultures[40],[41],[42],[43],[44],[45],[46],[47],[48],[49],[50],[51], [52],[53].
Remove ads
Taxonomie
Étymologie
L'étymologie de cette espèce B. thuringiensis est la suivante : thu.rin.gi.en’sis. L. masc./fem. adj. thuringiensis, appartenant à la Thuringe[54]. Le nouveau nom a été validé également en 1980 par l'ICSP[55].
Sous-espèces
Selon la LPSN, il existe 23 sous-espèces de Bacillus thuringiensis mais aucune dont le nom a été publié de manière valide[54].
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads