Cloruro de vinilo
compuesto químico De Wikipedia, la enciclopedia libre
El cloruro de vinilo (también conocido como cloroetileno, cloroeteno, monocloruro de etileno) es un compuesto orgánico y gas incoloro de olor ligeramente dulce, de fórmula C2H3Cl, que es el derivado clorado más simple del etileno. Es una sustancia extremadamente inflamable y explosiva, que emite gases tóxicos cuando se quema: monóxido de carbono, cloruro de hidrógeno y fosgeno. El cloruro de vinilo es un veneno muy potente con efectos carcinógenos, mutagénicos y teratogénicos en los seres humanos.
| Cloruro de Vinilo | ||
|---|---|---|
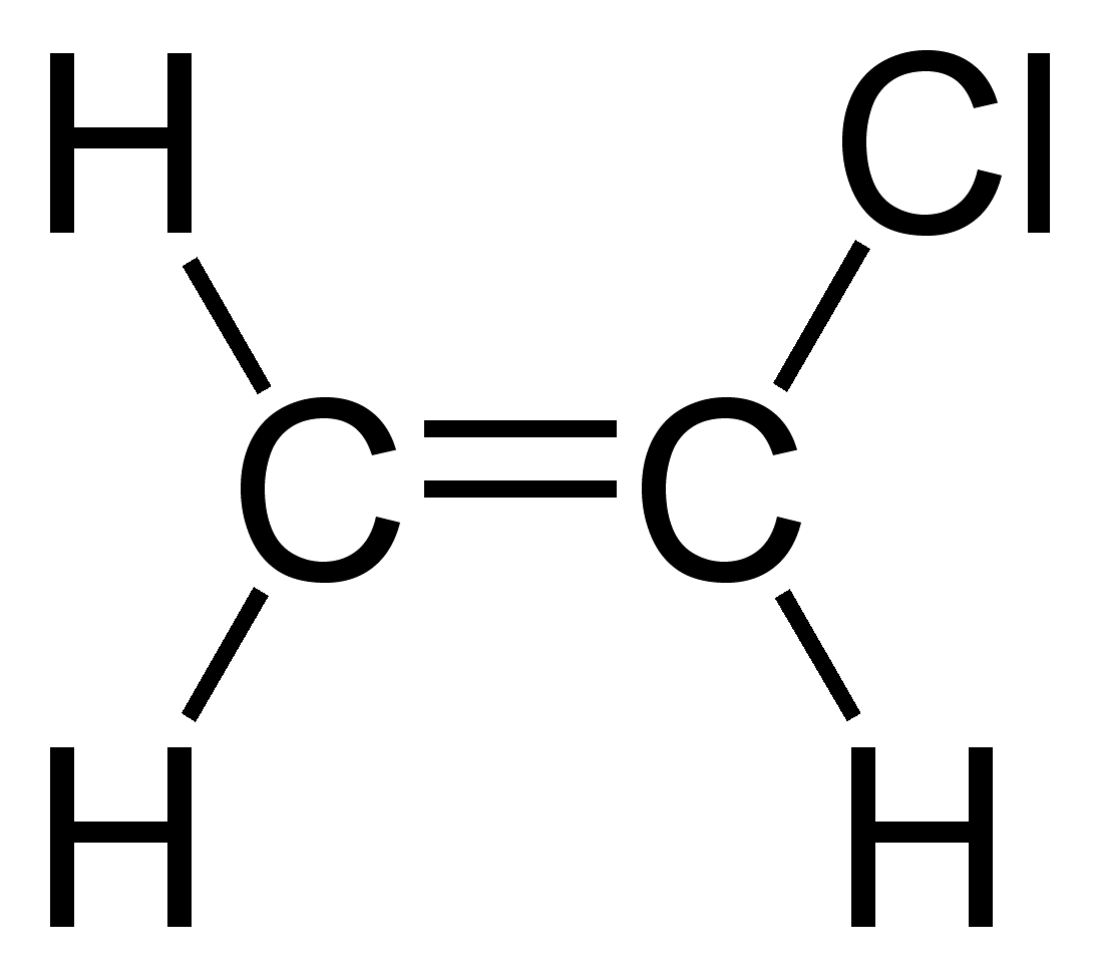
 Estructura química. | ||
 Estructura tridimensional. | ||
| Nombre IUPAC | ||
| Cloroeteno | ||
| General | ||
| Otros nombres |
Cloroetileno Cloroeteno Monocloruro de etileno | |
| Fórmula semidesarrollada | H2C=CHCl | |
| Fórmula estructural | C2H3Cl | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 75-01-4[1] | |
| Número RTECS | KU9625000 | |
| ChEBI | 28509 | |
| ChEMBL | CHEMBL2311071 | |
| ChemSpider | 6098 | |
| PubChem | 6338 | |
| UNII | WD06X94M2D | |
| KEGG | C06793 | |
| Propiedades físicas | ||
| Masa molar | 61,992 g/mol | |
| Índice de refracción (nD) | 1,3700 | |
La producción industrial de cloruro de vinilo se encuentra entre los diez productos de síntesis orgánica de mayor volumen, ya que casi toda la producción se utiliza para la posterior síntesis de cloruro de polivinilo (PVC), del que es monómero el cloruro de vinilo.
Según The 100 Most Important Chemical Compounds (Greenwood Press, 2007), el cloruro de vinilo es uno de los 100 compuestos químicos más importantes.
Descubrimiento
Resumir
Contexto
El cloruro de vinilo fue producido por primera vez por Justus von Liebig, profesor catedrático de química de la Universidad de Giessen, en la década de 1830 mediante el tratamiento de una solución con etanol de hidróxido de potasio sobre el 1,2-dicloroetano:
El alumno de Liebig, el químico francés Henri Victor Regnault, lo confirmó en 1835 al publicar un artículo sobre el descubrimiento en los Annales de chimie et de physique. También fue el primero en descubrir que una sustancia se convierte en polvo blanco cuando se expone a la luz. Sin embargo, el químico alemán Eugen Baumann, que en 1872 descubrió y describió el proceso de fotopolimerización del policloruro de vinilo, fue a quien se le reconoció la invención del PVC.
El término "cloruro de vinilo" fue utilizado por primera vez por el químico alemán Kolbe en 1854.
En 1912, el químico alemán Fritz Klatte consiguió cloruro de vinilo haciendo reaccionar acetileno con cloruro de hidrógeno:
La empresa Greisheim Electron, donde trabajaba el científico, patentó en Alemania el procedimiento utilizado y el material resultante de la polimerización, pero no consiguió encontrarle ningún uso práctico. Sólo en 1933, tras las investigaciones del científico estadounidense Waldo Semon (1926), B.F. Goodrich recibió la patente y desarrolló la primera producción comercial de cloruro de vinilo. En 1939 comenzó la producción comercial de cloruro de vinilo con el objetivo de producir PVC para uso militar.
Hasta mediados del siglo XIX, los científicos creían erróneamente que la estructura del cloruro de vinilo se explicaba mediante la fórmula C4H3Cl (al etileno se le atribuía la fórmula C4H4). Los científicos no llegaron a conocer la estructura actual del cloruro de vinilo hasta los estudios de Emil Erlenmeyer en1862, quien consideró que existía un enlace doble en el etileno.
Entre los científicos rusos, el estudio de la polimerización del cloruro de vinilo y de las posibilidades de su uso comercial fue llevado a cabo por Ivan Ostromislensky (principios del siglo XX).
Estructura molecular

El enlace C-Cl en la molécula de cloruro de vinilo es más corto y más fuerte que el enlace correspondiente en la molécula de cloroetano, lo que se debe a la combinación p,π de los orbitales π del enlace múltiple con el par de electrones sin dividir en el átomo de cloro.
En la tabla se muestran los valores comparados de las longitudes y energías de unión (C-Hal), además de los momentos dipolares en la molécula de cloruro de vinilo y en algunos haloalcanos:
El cambio en la densidad de electrones en la molécula de cloruro de vinilo desde el átomo de cloro hasta el enlace doble por el efecto mesomérico (efecto +M) se produce al mismo tiempo que el efecto inductivo de retirada de electrones en el átomo de cloro (efecto -I), pero la fuerza de este último es mayor (-I > +M), por lo que el halógeno tiene una leve carga negativa (véase la figura).
Propiedades físicas
Resumir
Contexto
En condiciones normales, el cloruro de vinilo es un gas incoloro con un leve olor dulce parecido al del cloroformo. Su olor en el aire alcanza un umbral de 3000 ppm. Es poco soluble en agua (aproximadamente un 0,95 % del contenido a 15-85 °C), fácilmente soluble en etanol, cloroformo, 1,2-dicloroetano y en éter etílico.
Algunos valores de las propiedades físicas del cloruro de vinilo:
- Punto de ebullición: -13,8 °C
- Punto de fusión: -153,8 °C
- Densidad relativa a -20 °C: 0,983
- Densidad relativa a 20 °C: 0,911 (líquido)
- Densidad del aire: 2,17
- Índice de refracción a 10 °C: 1,4046
- Temperatura crítica: 158,4 °C
- Presión crítica: 5,34 MPa; Presión crítica: 5,34 MPa
- Densidad crítica: 0,370 g/cm³
- Viscosidad del líquido a -40 °C: 0,334 mPa-s
- Viscosidad del gas a 20 °C: 10,71 mPa-s
- Tensión superficial a -20 °C: 22,3 mN/m.
- Capacidad calorífica del líquido a -20 °C: 1,146 kJ/(kg-K).
- Capacidad calorífica del gas a 25 °C: 0,858 kJ/(kg-K)
- Conductividad térmica del líquido a 20 °C: 0,138 W/(m-K)
- Entalpía estándar de formación, ΔH°298: -37,26 kJ/mol
- Entropía estándar de formación, S°298: 263,98 J/(mol-K)
- Entalpía de vaporización en el punto de ebullición, ΔHvap: 332,7 kJ/kg
- Calor de combustión, ΔH°comb.: -1198,1 kJ/mol.
Según las investigaciones de científicos estadounidenses, la densidad del cloruro de vinilo en el rango de temperaturas que va desde el punto de ebullición hasta los 60 °C, con una precisión del 0,1 %, queda expresada por la siguiente ecuación:
donde d es la densidad, g/cm³ y t es la temperatura, °C.
También consiguieron establecer una relación entre la elasticidad del vapor de cloruro de vinilo y su temperatura:
donde p es la presión, atm y T es la temperatura, K.
Propiedades químicas
Resumir
Contexto
El cloruro de vinilo es un compuesto químico activo cuyas propiedades químicas están determinadas por la presencia de un enlace doble y un átomo de cloro.
Al igual que los alquenos, el cloruro de vinilo participa en varias reacciones de adición de enlaces, en las que el átomo de cloro actúa como un sustituto que acepta electrones, por lo que se reduce la reactividad del compuesto para las reacciones de adición electrofílica y aumenta la reactividad del compuesto para las reacciones de adición nucleófila.
El átomo de cloro del cloruro de vinilo es bastante inerte, debido a la presencia del doble enlace, por lo que las reacciones de sustitución asociadas a él no son características del cloruro de vinilo. Al mismo tiempo, es precisamente esta propiedad la que hace que sea relativamente fácil separar de él la molécula de cloruro de hidrógeno.
Para la industria química, la técnica de polimerización del cloruro de vinilo es de suma importancia, ya que es el principal método a gran escala para la síntesis del policloruro de vinilo y sus copolímeros.
Reacciones de enlace doble
El cloruro de vinilo reacciona fácilmente con el cloro tanto en estado líquido como gaseoso para formar el 1,1,2-tricloroetano:
En este caso, la reacción puede ser tanto de naturaleza iónica (catalizador FeCl3) como radical (si están presentes iniciadores radicales libres, como peróxidos orgánicos). La adición de cloro también puede conseguirse por iniciación fotoquímica o calentando la mezcla de reacción por encima de los 250 °C con la presencia de pequeñas cantidades de oxígeno.
El cloruro de vinilo se une a los haluros de hidrógeno a través de un enlace doble según la regla de Markovnikov únicamente en presencia de catalizadores (cloruro de hierro (III), cloruro de cinc, etc.) a temperatura elevada, formando el 1,1-dihalogenalcanos:
El fluoruro de hidrógeno reacciona con el cloruro de vinilo en estado gaseoso solamente a presiones elevadas (1-1,5 MPa):
El fluoruro de hidrógeno reacciona con el cloruro de vinilo en estado líquido utilizando un catalizador de cloruro de estaño (IV) y cambiando el átomo de cloro por el de flúor para dar lugar al 1,1-difluoroetano (Freón R152a), un refrigerante respetuoso con la capa de ozono:
Con la presencia de peróxidos, la adición es diferente (sólo para el HCl y el HBr):
El yoduro de hidrógeno se une al cloruro de vinilo mediante catalizadores de yodo para formar el 1-cloro-1-yodoetano:
El cloruro de vinilo puede reaccionar con una solución acuosa de cloro para formar el cloroacetaldehído:
Si la reacción se lleva a cabo en una disolución de metanol, se forma el cloroacetal:
Sometido a la radiación ultravioleta, el cloruro de vinilo reacciona con el sulfuro de hidrógeno (catalizador - dialquilditioéteres) para formar la sustancia tóxica gas mostaza:
Con algunos haluros metálicos (FeCl3, AlCl3, etc.), el cloruro de vinilo se condensa con el cloroetano para formar el 1,1,3-triclorobutano y con el 2-cloropropano se forma el 1,1-dicloro-3-metilbutano:
Con el tetracloruro de carbono y en presencia del catalizador CuCl/C4H9NH2 o RuCl2(PPh3)3 se forma el 1,1,1,3,3-pentacloropropano en grandes cantidades:
La reacción de Prins con cloruro de vinilo produce 3,3-dicloropropanol-1 y 2,3-dicloropropanol:
Al reaccionar mediante Friedel-Crafts con el benceno y en presencia del cloruro de aluminio, se forma el 1,1-difeniletano:

El cloruro de vinilo participa en una reacción fotoquímica de cicloadición [2+2] con la 1-isoquinolona:
Reacciones de sustitución del átomo de cloro
Las reacciones de sustitución típicas de muchos hidrocarburos halogenados no se dan en el cloruro de vinilo. Normalmente se producen reacciones de polimerización o eliminación en lugar de sustitución por la fuerza de las bases, especialmente cuando se calientan.
No obstante, es posible llevar a cabo la sustitución nucleófila en el átomo de cloro en presencia de sales de paladio: de este modo se pueden obtener alcoholes vinílicos, así como ésteres y éteres:
La reacción de sustitución con alcoholato sódico también puede llevarse a cabo sin catalizador en unas condiciones bastante duras: un calentamiento muy prolongado en un autoclave cerrado a unos 100 °C:
La reacción de aminación también puede llevarse a cabo en presencia de un catalizador de paladio:
Una reacción con amoníaco en estado gaseoso a 50 °C utilizando amalgama de sodio da lugar a la aziridina:
En condiciones normales, el cloruro de vinilo no forma reactivos de Grignard, pero se han obtenido haluros de vinilmagnesio (reactivos de Norman) a partir de tetrahidrofurano:
El cloruro de vinilmagnesio puede usarse para sintetizar una amplia gama de derivados del vinilo, por ejemplo:
Al igual que sucede con el magnesio, también encontramos otros compuestos organometálicos de vinilo, como el vinilcalio:
La reacción del cloruro de vinilo con litio metálico en presencia de sodio (2%) con tetrahidrofurano da lugar al litio de vinilo:
Al hacer reaccionar cloruro de vinilo con bromuro de 2-tienilmagnesio en presencia de cloruro de cobalto, se puede obtener 2-viniltiofeno:
El cloruro de vinilo reacciona con dimetilamina y CO con un catalizador de paladio para formar la N,N-dimetilacrilamida:
Reacción de polimerización
En condiciones normales, en ausencia de oxígeno y de luz, el cloruro de vinilo puro puede subsistir el tiempo suficiente sin sufrir ningún cambio; sin embargo, la aparición de radicales libres, provocada tanto fotoquímica como termoquímicamente, provoca su rápida polimerización.
El mecanismo de polimerización es de naturaleza radical y puede representarse esquemáticamente de la siguiente manera:
Primer paso: la acción de un iniciador, la formación de radicales libres y la nucleación de la cadena.
Segunda etapa: desarrollo de la polimerización y formación de cadenas poliméricas.
Durante la formación del polímero, es posible la división de la cadena y la formación de fragmentos insaturados:
Tercera etapa: Fin de la polimerización.
Otras reacciones
El butadieno puede producirse en cantidades similares a partir de cloruro de vinilo en dimetilformamida-agua y en presencia de un catalizador mixto complejo:
El cloruro de vinilo reacciona con los cloruros de acilos en presencia de cloruro de aluminio para formar dicloro cetonas y cloro vinil cetonas:
En presencia de cloruros de paladio (PdCl2), rodio (RhCl3•3H2O) o rutenio (RuCl3•3H2O), el cloruro de vinilo reacciona con alcoholes para formar acetales:
La oxidación del cloruro de vinilo con oxidantes inorgánicos da lugar a la formación de cloroacetaldehído o formaldehído, una oxidación más avanzada para dar monóxido o dióxido de carbono, cloruro de hidrógeno y agua, dependiendo de las condiciones de reacción y de la elección del oxidante:
La ozonólisis del cloruro de vinilo en un entorno a base de metanol a -78 °C da lugar a una gran cantidad de metoximetilhidroperóxido (1), que puede transformarse después en un éster metílico del ácido fórmico (2) y en dimetoximetano (metilal) (3):
La reducción del cloruro de vinilo es posible de tres maneras diferentes, dependiendo de la elección del agente y de las condiciones de reacción:
- en etileno:
- en cloruro de etilo:
- en etano:
El cloruro de vinilo, en presencia de bases fuertes, es capaz de desprenderse del cloruro de hidrógeno para formar el acetileno:
El cloruro de vinilo es un compuesto relativamente estable térmicamente, que se descompone de forma evidente cuando se calienta por encima de 550 °C. La pirólisis del cloruro de vinilo a 680 °C en un 35% da lugar a una mezcla de productos que contienen acetileno, cloruro de hidrógeno, cloropreno y acetileno de vinilo.
Métodos para su obtención en laboratorios
Resumir
Contexto
En el laboratorio, el cloruro de vinilo se prepara deshidroclorando 1,2-dicloroetano o 1,1-dicloroetano mediante el calentamiento de una solución alcohólica de hidróxido de sodio o de potasio:
Otro método, consiste en hacer pasar acetileno a través de una solución concentrada de ácido clorhídrico utilizando cloruro mercúrico, raramente se utiliza en los laboratorios:
También es posible obtener la deshidratación catalítica del 2-Cloroetanol:
Por último, el cloruro de vinilo puede obtenerse haciendo reaccionar acetaldehído con pentacloruro de fósforo:
Producción industrial: aspectos tecnológicos
Resumir
Contexto
Desde 2010, existen tres formas principales de producir cloruro de vinilo a escala industrial:
- hidrocloración catalítica en estado gaseoso de acetileno
- método combinado a base de etileno y acetileno
- método equilibrado con cloro a base de etileno
Este último método es la forma de producción más moderna, extendida y rentable, pero los dos primeros métodos, a pesar de estar anticuados, siguen existiendo en muchas fábricas que están orientadas (por distintas razones) al empleo de acetileno caro.
Además, existe un proceso relativamente nuevo, que aún no se ha generalizado y que se implantó como proyecto piloto en 1998 en una fábrica de Alemania: la cloración oxidativa del etano.
Hidrocloración catalítica en estado gaseoso de acetileno
El método de hidrocloración catalítica del acetileno, en el que el acetileno se obtiene haciendo reaccionar carburo de calcio con agua, fue el primer proceso comercial para producir cloruro de vinilo.
La química del proceso es la siguiente:
- Producción de acetileno:
- Hidrocloración del acetileno:
Descripción breve de la tecnología de producción:
El acetileno producido, puro y seco (con un contenido de humedad no superior a 1,5 g/m3) se mezcla con cloruro de hidrógeno puro y seco en una proporción aproximada de 1,0:1,1. Esta mezcla gaseosa se introduce en la parte superior del reactor tubular, cuyos tubos se llenan con un catalizador compuesto de carbón activado impregnado de HgCl2 (10-15%). El reactor es de acero al carbono; los tubos tienen una altura de 3-6 metros y un diámetro de 50-80 metros. La temperatura en la zona de reacción es de 150-180 °C. Después del reactor, los gases de reacción se dirigen a una columna especial rociada con ácido clorhídrico para extraer la bicapa de mercurio. Tras la primera columna de absorción, los gases de reacción pasan a la siguiente columna, donde se rocían con agua y álcali para separar el cloruro de hidrógeno, el acetaldehído y el dióxido de carbono. A continuación, los gases se enfrían en un condensador para eliminar el agua y se introducen en un proceso de rectificación para eliminar las impurezas que alcanzan niveles de ebullición muy altos. El cloruro de vinilo resultante se hace pasar por una columna llena de sosa cáustica sólida para su completa deshidratación y neutralización.
En 1967, el método de hidrocloración catalítica en estado gaseoso del acetileno suponía el 32,3% (405.600 toneladas) de la producción de cloruro de vinilo en Estados Unidos. En 2001, la empresa química estadounidense Borden paró su última producción a base de acetileno en Luisiana. Además de las razones económicas, el método de hidrocloración catalítica del acetileno no es seguro desde el punto de vista medioambiental, ya que el mercurio utilizado en la producción, a pesar de reciclarse, entra en el medio ambiente de forma inevitable en forma de residuos gaseosos y aguas residuales. En 2002, en Rusia, estas emisiones alcanzaron unos 31 kg.
El método de hidrocloración catalítica del acetileno a partir de 2010 solo está extendido en China gracias a las reservas ricas en hulla, la disponibilidad de energía hidroeléctrica barata y la escasez de gas natural, que es la principal materia prima para la producción de etileno.
De 2003 a 2008, el método recobró interés debido a un aumento considerable en los precios mundiales del petróleo y el gas, pero la crisis económica de 2008 hizo que el método de cloración oxidativa directa del etileno volviera a ser el más atractivo desde el punto de vista económico.
Método combinado a base de etileno y acetileno
El método combinado etileno-acetileno combina la reacción de cloración del etileno a la que sigue la descomposición del dicloroetano con la reacción de hidrocloración del acetileno, empleando para esta última el cloruro de hidrógeno que procede de la fase de descomposición térmica.
Proceso químico:
Este método permitió sustituir la mitad del acetileno por etileno, mucho más barato, y reciclar el cloruro de hidrógeno, con lo que el aprovechamiento del cloro alcanzó casi el 100%.
Método equilibrado de cloro basado en etileno
Descripción general del método
A partir de 2010, el proceso de cloración oxidativa equilibrada del etileno es el más moderno y el más eficiente desde el punto de vista económico. En 2006, más del 95% del cloruro de vinilo se producía mediante este proceso.
En el proceso basado en el etileno, el cloruro de vinilo se produce por pirólisis del dicloroetano, que a su vez se sintetiza por reacción catalítica del cloro con el etileno. El cloruro de hidrógeno resultante de la deshidrocloración del dicloroetano reacciona con el oxígeno y el etileno en presencia de un catalizador de cobre para formar dicloroetano y reducir así el cloro elemental usado para la cloración directa del etileno. Este proceso se conoce como oxicloración. Para obtener un producto que se pueda vender, el cloruro de vinilo se purifica por destilación, y los subproductos organoclorados se separan para obtener disolventes o se destruyen térmicamente para reciclar el cloruro de hidrógeno de nuevo en el proceso.
El proceso químico es el siguiente:
- Cloración del etileno:
mecanismo de la etapa:
- Deshidrocloración térmica del dicloroetano:
mecanismo de la etapa:
- Cloración oxidativa del etileno:
mecanismo de la etapa:
En este esquema de producción, el etileno se distribuye aproximadamente a partes iguales entre las etapas de cloración directa y oxidativa.
Proceso Vinnolit de VCM
Uno de los procesos de producción de cloruro de vinilo más comunes en el mundo es el proceso Vinnolit de VCM, autorizado por la empresa alemana Vinnolit GmbH & Co. Desde 1964 se han instalado en todo el mundo unos 5,5 millones de toneladas de producción de cloruro de vinilo mediante este proceso.
Breve descripción de las etapas del proceso:
- Cloración directa del etileno:
La reacción de cloración del etileno tiene lugar en la estado líquido dentro de un ambiente de dicloroetano a 50-125 °C con la presencia de un catalizador complejo especial y mejorado (en comparación con el FeCl3) que evita la formación de subproductos que no se consumen en el proceso de síntesis y que permanecen en el interior del reactor. El dicloroetano obtenido no necesita purificarse (tiene una pureza igual o superior al 99,9%) y pasa directamente a la fase de pirólisis.
- Oxicloración del etileno
El proceso de oxicloración es una reacción exotérmica que genera una gran cantidad de calor (ΔH = -238 kJ/mol) y tiene lugar sobre todo en una atmósfera con oxígeno o aire. La mezcla de gases de la reacción se calienta a más de 210 °C y el calor de la reacción liberado se usa para generar vapor. La capacidad de conversión del etileno alcanza el 99% y la pureza del dicloroetano producido es del 99,5%.
- Destilación del dicloroetano
La destilación es necesaria para obtener el dicloroetano procedente del proceso de oxicloración, así como el dicloroetano sin reaccionar (de reutilización) de la fase de pirólisis. El agua y los componentes con niveles bajos de ebullición se eliminan a través de una columna de secado. El residuo en forma de cubo se introduce después en la etapa de regeneración.
- Pirólisis del dicloroetano
La pirólisis del dicloroetano se lleva a cabo en hornos especiales (con un período de actividad de hasta 2 años) a 480 °C; el calor del proceso se utiliza para la evaporación y el calentamiento.
- Destilación del cloruro de vinilo
Los productos de pirólisis compuestos principalmente por dicloroetano, cloruro de vinilo y cloruro de hidrógeno se dirigen a la destiladora. El cloruro de hidrógeno se devuelve al compartimento de oxicloración, el cloruro de vinilo se elimina a través de la parte superior de la columna y el residuo cúbico consistente en dicloroetano sin reaccionar se devuelve al proceso de destilación una vez que se hayan eliminado los subproductos.
- Regeneración de los subproductos
Los subproductos líquidos y gaseosos se queman por completo a 1100-1200 °C, con lo que se produce cloruro de hidrógeno, que tras purificarse se devuelve al proceso de oxicloración; al mismo tiempo se produce vapor a media presión debido a la elevada temperatura.
Estimación del balance de materia y energía del proceso (por cada 1000 kg de cloruro de vinilo):
Etileno: 460 kg
Cloro: 585 kg
Oxígeno: 139 kg
Vapor: 125 kg
Energía eléctrica: 120 kWh
Agua: 150 m³.
Método de cloración oxidativa del etano
La idea de utilizar etano para sintetizar cloruro de vinilo se hizo realidad en 1965-1967 en una fábrica experimental de The Lummus Co. y Armstrong Cork Co. La tecnología de oxicloración directa con la presencia de cloruro de cobre(I) se llamó Proceso Transcat.
Proceso químico:
El proceso se llevó a cabo a 450-550 °C y 1 MPa; el porcentaje de conversión del etano alcanzó el 65-70 %. Este método fue perfeccionado más tarde por ICI, que disminuyó el intervalo de temperatura de la síntesis y utilizó un catalizador diferente.
En mayo de 1998, EVC International NV (Países Bajos) puso en marcha un proyecto piloto con una producción de 1.000 toneladas al año en una fábrica de Wilhelmshaven (Alemania) para probar y después comercializar el método de cloración oxidativa de etano o "proceso Ethane-to-VCM", que había sido patentado. Se preveía que el proyecto fuera un gran avance tecnológico y el comienzo de los trabajos en una fábrica a tamaño real, cuya puesta en marcha estaba prevista para 2003.
Según el fabricante, la temperatura del proceso es inferior a 500 °C, el porcentaje de conversión de la materia prima es del 100% para el cloro, del 99% para el oxígeno y de más del 90% para el etano; además, la producción de cloruro de vinilo es superior al 90%.
En septiembre de 1999, EVC firmó un acuerdo con Bechtel Group, Inc (EE. UU.) para construir una fábrica al completo en Wilhelmshaven, pero por problemas financieros el proyecto no se llevó a cabo.
Tras la adquisición de EVC por INEOS en 2001,se desconoce el destino del proyecto del ''proceso Ethane-to-VCM''.
Métodos alternativos de producción de cloruro de vinilo
Monsanto propuso en 1977 un proceso de un solo paso para producir cloruro de vinilo con un porcentaje de etano de hasta el 85%, utilizando una mezcla de cloruro de hidrógeno y oxígeno a 400-650 °C con un catalizador (haluro de cobre y fosfato de potasio):
En 1980, los científicos soviéticos patentaron un método alternativo para producir cloruro de vinilo mediante cloración en estado gaseoso de una mezcla que contenía etano y etileno a 350-500 °C, que se corresponde con el siguiente esquema químico:
Los subproductos de la reacción son el cloroetano, el 1,1-dicloroetano, el cloruro de vinilideno y otros derivados halogenados.
Uno de los métodos de producción desarrollados más recientemente (2005) es el método de preparación de cloruro de vinilo por interacción de cloruro de metilo y cloruro de metileno en estado gaseoso a una temperatura de 300-500 °C, y una presión de 0,1 a 1 MPa, utilizando catalizadores (óxido o fosfato de aluminio activo, aluminosilicatos, cloruro de zinc con óxido de aluminio):
Todos estos procesos con cloruro de vinilo no se han implantado industrialmente o no han alcanzado la fase de producción experimental.
Producción industrial: aspectos económicos
Resumir
Contexto
Producción mundial de cloruro de vinilo
El cloruro de vinilo se encuentra entre los 20 productos más importantes de la producción petroquímica mundial, solo por detrás del etileno (123 millones de toneladas en 2010), el propileno (77 millones de toneladas en 2010), el metanol (48-49 millones de toneladas en 2010), el ácido tereftálico (42 millones de toneladas en 2008) y el benceno (40 millones de toneladas en 2010). Tras el polietileno y el óxido de etileno, la producción de cloruro de vinilo es el tercer consumo más importante de etileno como materia prima química, con un 11,9% de su consumo mundial (en 2008). La producción mundial de cloruro de vinilo alcanzó aproximadamente los 35 millones de toneladas en 2010 (36,7 millones de toneladas en 2008), lo que supone el 70% de la capacidad de producción total mundial (90% en 2007, 85% en 2008). IHS prevé que el consumo actual de cloruro de vinilo crecerá a un ritmo del 4,4% anual de 2010 a 2015 y del 4,2% en los próximos cinco años (de 2015 a 2020).
Entre 1997 y finales de 2004, la producción mundial de cloruro de vinilo por regiones era la siguiente:
| Región | Producción en 1997 (en miles de toneladas) | Producción en 2004 (en miles de toneladas) |
|---|---|---|
| Norteamérica | 7385
|
8988
|
| América del Sur | 880
|
1035
|
| Europa Occidental | 6409
|
6495
|
Europa Central y Oriental
|
2342
|
2011
|
| África | 405
|
408
|
| Medio Oriente | 862
|
1092
|
| Аsia | 7145
|
13082
|
| Oceanía | 36
|
—
|
| TOTAL | 25 464 | 33 111 |
El mayor productor de cloruro de vinilo del mundo (en cuanto a producción) es EE.UU.: 8,24 millones de toneladas en 2003 (en comparación, en 1967 la producción era de 1,26 millones de toneladas y en 1960 de sólo 0,67 millones de toneladas).
Principales productores estadounidenses y canadienses por volumen de producción en 2003:
- Dow Chemical - 2,4 millones de toneladas (2006)
- Occidental Chemical Corporation - 1,68 millones de toneladas
- Georgia Gulf - 1,18 millones de toneladas
- Oxymar - 1,04 millones de toneladas
- Formosa Plastics Group - 1,00 millones de toneladas.
En 1997, las principales empresas de fabricación del mundo (el 42% de la capacidad total de producción mundial) fueron:
- Dow Chemical - 1.906 miles de toneladas;
- Formosa Plastics Group - 1.643 miles de toneladas
- EVC - 1.370 miles de toneladas
- Solvay - 1.193 miles de toneladas
- The Geon Company - 1.088 miles de toneladas
- Occidental Chemical Corporation - 1.020 miles de toneladas
- Elf-Atochem - 803 mil toneladas
- Georgia Gulf - 726 mil toneladas
- Norsk Hydro - 595 mil toneladas
- Tosoli Corporation - 570 mil toneladas.
En 2005, las compañías de fabricación más grandes del mundo fueron (de mayor a menor):
- Formosa Plastics Group
- Dow Chemical
- Occidental Chemical Corporation
- Solvay
- Georgia Gulf
- Ineos
- Tosoh
- Total Petrochemicals
- LG Chem
- Shin-Etsu Chemical.
Aplicación
Resumir
Contexto
Más del 99% de todo el cloruro de vinilo producido en el mundo (en 2020) se ha destinado a la producción de PVC. Más de la mitad de la producción mundial de PVC (57% en 2009) se concentra en Asia, con un 20% en China. El país que más cloruro de vinilo consume en el mundo es China, con cerca del 30% de la producción mundial, seguido de EE. UU. y Canadá, con cerca del 20% (en 2008).
En la actualidad existen cuatro tecnologías de polimerización de cloruro de vinilo diferentes (enumeradas según su importancia, de mayor a menor):
- polimerización en suspensión: la polimerización del cloruro de vinilo presente en gotitas de emulsión que se obtienen dispersando el monómero en agua, y en presencia de un estabilizador de emulsión y de un activador de la polimerización que sea soluble en el monómero.
Composición de la masa habitual para la polimerización en suspensión:
- cloruro de vinilo - 33,3 %;
- agua - 66,6 %;
- activador (por ejemplo, peróxido orgánico) - 0,015
- estabilizador (por ejemplo, alcohol polivinílico) - 0,005 %.
- polimerización en dispersión: es la polimerización del cloruro de vinilo en agua con la presencia de tensoactivos y de activadores hidrosolubles (persulfato de potasio, persulfato de amonio, percarbonato de sodio, ácido peroxiacético, peróxido de hidrógeno e hidroperóxido de cumol, etc.) para formar dispersiones estables de partículas muy pequeñas.
- polimerización a granel: es el tercer método más importante, que consiste en polimerizar el cloruro de vinilo en su totalidad, sin adición de agua, tensioactivos, disolventes u otros componentes auxiliares (excepto los activadores solubles en los monómeros, como, como el di-(2-etilhexanol)peróxido, el 3,5,5-trimetilhexanolperóxido, el di-(tret-butil)peroxioxalato, el di-2-butoxietilperoxidicarbonato, el di-4-clorobutilperoxidicarbonato, el azobis-(isobutironitrilo) y el azobis-(ciclohexilcarbonitrilo)
- polimerización en solución: es el método más raro y específico utilizado para producir copolímeros utilizados en los revestimientos a base de polímeros.
La polimerización en suspensión es el método más común en todo el mundo (80% de la producción total), y las siguientes tecnologías son las más modernas y populares:
- Proceso Chisso PVC
- Proceso ''PVC Vinnolit Suspension''.
Proceso Chisso PVC
La empresa Chisso Corporation, líder en la industria japonesa de polímeros, desarrolló una tecnología avanzada para la producción de PVC a partir de lodos: el Proceso Chisso PVC. Se caracteriza por su producción de alta calidad mediante una tecnología segura y respetuosa con el medio ambiente, su bajo coste de inversión y sus costes mínimos de explotación.
El Proceso Chisso PVC está implantado en 19 fábricas de todo el mundo, con una producción total de más de 1,5 millones de toneladas al año.
Proceso ''PVC Vinnolit Suspension''
El método de polimerización de cloruro de vinilo en suspensión fue inventado y patentado en 1935 por Wacker Chemie GmbH, uno de los antiguos fundadores de Vinnolit. Tras realizar muchos ajustes, el proceso ''PVC Vinnolit Suspension'' se ha convertido en uno de los procesos más modernos y rentables para la producción de policloruro de vinilo en todo el mundo.
La reacción de polimerización se lleva a cabo en lotes en reactores de un volumen de unos 170 m³, y gracias a su diseño es posible eliminar eficazmente el calor de la mezcla de reacción sin necesidad de utilizar un condensador de reflujo ni agua para la refrigeración, lo que permite conseguir una producción muy alta. Además, la tecnología permite obtener un producto acabado con una cantidad reducida de cloruro de vinilo sin reaccionar, y sin necesidad de desgasificación por temperatura, con lo que se mantiene la estructura del polímero.
Otras aplicaciones
Aproximadamente el 1 % de cloruro de vinilo se utiliza para hacer copolímeros con acetato de vinilo y otros monómeros.
No se utiliza más del 1 % de cloruro de vinilo para la síntesis orgánica de los siguientes compuestos:
Hasta mediados de los años 70, el cloruro de vinilo se empleaba como refrigerante, como componente de latas de aerosol y como ingrediente de algunos cosméticos.
Riesgos de incendio
Esta sustancia es extremadamente inflamable, sus mezclas con el aire son explosivas; cuando se quema, emite sustancias irritantes, tóxicas y corrosivas, entre las que se encuentra el fosgeno, altamente tóxico.
Punto de inflamabilidad: -78 °C; temperatura de autoignición: 472 °С; límites de inflamabilidad: 3,6-33%.
En caso de incendio de cloruro de vinilo, no apagar las llamas hasta que se detenga el flujo de gas, usando agua lo más lejos posible de la fuente de combustión, para crear una cortina densa parecida a la niebla y así enfriar las superficies calientes.
Clasificación según la NFPA 704: ![]()
![]()
![]()
(el '4' en el diamante rojo indica 'que es inflamable por debajo de los 25 °C', el '2' del diamante azul indica que se trata de un 'compuesto peligroso' y el '2' del diamante amarillo indica que 'la sustancia puede explotar tanto por calor como por golpes'.)
Efectos sobre el organismo
Resumir
Contexto
El cloruro de vinilo es muy tóxico. Tiene un efecto de toxicidad muy complejo en el cuerpo humano, que causa daños en el sistema nervioso central, el sistema óseo, y daños en el tejido conjuntivo, el cerebro y el corazón. Puede afectar al hígado, originando angiosarcomas. Causa alteraciones inmunitarias y tumores, tiene efectos carcinógenos, mutagénicos y teratogénicos.
Varios estudios han señalado que la exposición humana al cloruro de vinilo provoca neoplasias malignas en diversos tejidos y órganos, como el hígado (con tumores distintos del angiosarcoma), el cerebro, el pulmón o los sistemas linfático y hematopoyético (órganos y tejidos que intervienen en la formación de la sangre). Sin embargo, el uso de etanol sólo potencia el efecto carcinógeno del cloruro de vinilo.
La intoxicación crónica con cloruro de vinilo es conocida como la "enfermedad del cloruro de vinilo".
Los efectos del cloruro de vinilo en los seres humanos se producen principalmente por inhalación, y su concentración en el aire (1 parte por millón) se sitúa por debajo del umbral detectable por el olfato humano (3.000 ppm). Las concentraciones de 8000 ppm provocan mareos, mientras que los niveles de 20 000 ppm provocan somnolencia, pérdida de coordinación, alteraciones visuales y auditivas, desorientación, náuseas, dolor de cabeza y sensación de quemazón en las extremidades. La exposición prolongada a concentraciones más elevadas de cloruro de vinilo puede causar la muerte por parálisis del sistema nervioso central o parada respiratoria. Hay que tener en cuenta que este gas es más pesado que el aire y puede causar asfixia en espacios mal ventilados o cerrados.
En los seres humanos, el cloruro de vinilo se biotransforma sobre todo por las enzimas hepáticas, siendo el ácido tiodiglicólico el principal metabolito que se excreta por la orina.
Los efectos tóxicos agudos del cloruro de vinilo en diferentes tipos de animales:
Ratas: DL50 ⩾ 400 mg/kg (por vía oral);
Ratas: CL50 = 390 000 mg/m3 (por inhalación);
Impacto en el medio ambiente
En el medio ambiente, el cloruro de vinilo se emite solamente durante la producción y la transformación. Se estima que más del 99% de las emisiones de cloruro de vinilo se quedan en el aire, donde se va degradando fotoquímicamente por medio de radicales hidroxilo, con una vida media de 18 horas (aunque otras estimaciones sitúan el tiempo entre los 2,2 y los 2,7 días).
El cloruro de vinilo se evapora rápidamente de la superficie del suelo, pero puede llegar a las profundidades a través de las aguas subterráneas. No se absorbe ni en plantas ni por los animales.
En el suelo y el agua, el cloruro de vinilo experimenta una biodegradación aeróbica (principalmente CO2) producida por microorganismos como Mycobacterium. En las aguas subterráneas la biodegradación también puede ser anaeróbica, con productos como el metano, el etileno, el dióxido de carbono y el agua.
Los estudios demuestran que el cloruro de vinilo se descompone un 30% en 40 días y un 99% en 108 días en el suelo y el agua cuando se expone a microorganismos.
Normas de higiene
Normas básicas de higiene para el cloruro de vinilo:
- Límite Máximo de Exposición (LME): 7 ppm.
- Umbral de Valor Límite - Tiempo Medio Ponderado (TLV-TWA): 1 ppm.
Niveles Mínimos de Riesgo (MRL):
- exposición aguda por inhalación: 0,5 ppm;
- exposición oral única: 0,03 ppm;
- exposición oral crónica: 0,003 mg/kg por día.
Evaluación y control de la exposición
Está clasificado como cancerígeno tipo 1 (demostrado en humanos) en el RD 363/1995 y en la lista de la IARC (Agencia Internacional para la Investigación del Cáncer). Por tanto, siempre hay que mantener el nivel de exposición lo más bajo posible.
Valores límites ambientales: Orden 9/4/1986, art. 3:
1. Límite de exposición anual: 3 ppm.
2. Límite de exposición diaria: 7 ppm.
3. Niveles de alarma:
- 3.1. Concentración promediada durante una hora: 15 ppm.
- 3.2. Concentración promediada durante 20 minutos: 20 ppm.
- 3.3. Concentración promediada durante 2 minutos: 30 ppm.
Manipulación, almacenaje y transporte
Resumir
Contexto
El cloruro de vinilo se almacena lejos de fuentes de calor y fuego y en estado líquido a de -14 a -22 °C en contenedores metálicos de gran tamaño, esféricos y con conexión a tierra, a los que se añade un poco de estabilizante (por ejemplo, hidroquinona). Los depósitos deben estar equipados con válvulas de cierre automático, dispositivos de control por presión y parachispas. El recipiente con la sustancia debe conservarse en lugares bien ventilados y a una temperatura ambiente de menos de 50 °C. Debe evitarse el contacto con el cobre, todas las fuentes de fuego o calor, los agentes oxidantes, la sosa cáustica y los metales activos. El cloruro de vinilo estabilizado se transporta en estado líquido en tanques de acero refrigerados, que deben secarse primero a fondo y limpiarse con nitrógeno.

Accidente en Ohio
El 3 de febrero de 2023, un tren que transportaba cloruro de vinilo se descarriló cerca de East Palestine, Ohio, en Estados Unidos. La compañía Norfolk Southern, propietaria de los productos químicos, se vio obligada a quemar el contenido de los contenedores, lo que provocó una gigantesca nube en forma de hongo sobre el estado, la muerte de animales y la contaminación del río Ohio.
Referencias
Enlaces externos
Wikiwand - on
Seamless Wikipedia browsing. On steroids.






![{\displaystyle {\ce {CH2=CHCl{}+ 2 HF ->[{\ce {SnCl4}}] CH3-CHF2{}+ HCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ba7f6f18c056267dfe322003a88ad6871887538c)
![{\displaystyle {\ce {CH2=CH-Cl{}+ HBr ->[{\ce {ROOH}}] CH2Br-CH2Cl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/92265af5c2de414633c6447920fb4e45bc7c348b)
![{\displaystyle {\ce {CH2=CH-Cl{}+ HI ->[{\ce {I_2}}] CH3-CH(I)Cl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/fe166bfa3ac1dccbc563eb52a87f39dd51a9b707)

![{\displaystyle {\ce {CH2=CH-Cl{}+ HClO -> [ClCH2-CH(OH)Cl] -> ClCH2-CHO{}+ HCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/1bfd3f64698b8ba85f0becc7d2bd7607c82c13fa)
![{\displaystyle {\ce {CH2=CH-Cl{}+Cl2{}+CH3OH->ClCH2-CH(OCH3)Cl{}+HCl->[+~{\ce {CH3OH}}]ClCH2-CH(OCH3)2{}+HCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8452a89be50ada7b0d0eee417a6edbcb1b89e872)








![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+CH_{3}COONa\ {\xrightarrow[{CH_{3}COOH}]{PdCl_{2}}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!OCOCH_{3}+NaCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/1e0dca5b981978525bcc34a6792133d3c09bae6b)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+C_{2}H_{5}ONa\ {\xrightarrow[{C_{2}H_{5}OH}]{100\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!OC_{2}H_{5}+NaCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/82162f9cc9f5bad24489b2997394b469faae271c)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+HNRR'\ {\xrightarrow[{t-BuONa,\ C_{6}H_{5}CH_{3},\ 70-90\ ^{o}C}]{PdCl_{2},\ [o-CH_{3}(C_{6}H_{4})]_{3}P}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!NRR'+HCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/404a60a5ee715c9051adb58901d3d69dd2b49438)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+NH_{3}\ {\xrightarrow[{Na-Hg}]{50\ ^{o}C}}\ (CH_{2}\!\!-\!\!CH_{2})NH+HCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/bcb8d913978449e907e875a11a554388707bc58f)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+Mg\ {\xrightarrow[{THF}]{40-50\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!MgCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/d503588f404f4a7e6c127e4d4d4dba2b57227a4a)

![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+2K\ {\xrightarrow[{THF}]{Na,\ 0\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!K+KCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/90c653578ca9d49c738a3e2d22cee948f08a892f)
![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+2Li\ {\xrightarrow[{THF}]{Na,\ 0-10\ ^{o}C}}\ CH_{2}\!\!=\!\!CH\!\!-\!\!Li+LiCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/bd2d256c4d1bca7ac6c997b6a022d34956d0c116)















![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+R\!\!-\!\!COCl\ {\xrightarrow {AlCl_{3}}}\ CH_{2}Cl\!\!-\!\!CHCl\!\!-\!\!C(O)R{\xrightarrow[{-HCl}]{\ }}CHCl\!\!=\!\!CHC\!\!-\!\!C(O)R}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8c0c7734dc0545f11322b1593dec2a71027ec757)

![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+5[O]\ \xrightarrow {KMnO_{4},\ H_{2}O\ ,\ ^{o}t} \ 2CO_{2}+H_{2}O+HCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/0f84d5bf185cd352c85955d22a307ebd0cdba58c)





![{\displaystyle {\mathsf {CH_{2}\!\!=\!\!CH\!\!-\!\!Cl+2H_{2}\ {\xrightarrow[{-HCl}]{Ni_{Reney},\ KOH}}\ CH_{3}\!\!-\!\!CH_{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/f762b76b49d67598c4e89b67e4754b5442ed93f7)






























![{\displaystyle {\ce {CH2=CHCl{}+ HCl ->[{\ce {FeCl3}}] CH3-CHCl2}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/21d585a0103dbd87f24b4ce3157351eb71b42211)
![{\displaystyle {\ce {CH3-CHCl2{}+Cl2->[{\text{370—400 °C}}]CH3-CCl3{}+HCl}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/bf7b36880fd2595f8a7aa3be2705518d3d769e5d)


