Top-Fragen
Zeitleiste
Chat
Kontext
Limonen
organische Verbindung, Naturstoff, Duftstoff, Lösungsmittel Aus Wikipedia, der freien Enzyklopädie
Remove ads
Limonen [] ist ein Naturstoff aus der Gruppe der Terpene (monocyclisches Monoterpen).
Remove ads
Struktur
Limonen kommt in Form zweier Enantiomere vor, dem (R)-(+)-Limonen [auch als D-(+)-Limonen oder kurz (+)-Limonen bezeichnet] und dem (S)-(−)-Limonen [auch als L-(−)-Limonen oder kurz (−)-Limonen bezeichnet]. Das Racemat der beiden Enantiomere wird auch Dipenten genannt.
| Limonen | ||
| Name | (R)-Limonen | (S)-Limonen |
| Andere Namen | (+)-Limonen D-Limonen |
(−)-Limonen L-Limonen |
| Strukturformel | 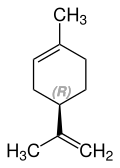 |
 |
| CAS-Nummer | 5989-27-5 | 5989-54-8 |
| 138-86-3 (unspez.) | ||
| EG-Nummer | 227-813-5 | 227-815-6 |
| 205-341-0 (unspez.) | ||
| ECHA-Infocard | 100.025.284 | 100.025.286 |
| 100.004.856 (unspez.) | ||
| PubChem | 440917 | 439250 |
| 22311 (unspez.) | ||
| FL-Nummer | 01.045 | 01.046 |
| Wikidata | Q27888324 | Q27089405 |
| Q278809 (unspez.) | ||
Remove ads
Geschichte
Limonen wurde erstmals 1878 von Gustave Bouchardat durch Erhitzen von Isopren hergestellt.
Vorkommen
Limonen ist das in Pflanzen am häufigsten vorkommende Monoterpen. (R)-(+)-Limonen ist vor allem in Pomeranzenschalenöl, in Kümmelöl, in Dill,[8] in Grünem Kardamom,[9] in Sellerie,[9] in Korianderöl, in Krauseminzöl,[10] in Lorbeer,[9] in Muskatnuss,[9] in Petersilie,[9] in Teebaumöl,[9] in Zitronenöl (ca. 65 %)[11] und in Orangenöl (meist >90 %)[12] enthalten. Es weist einen orangenartigen Geruch auf. Dagegen ist (S)-(−)-Limonen in Minzölen[13] (wie Pfefferminze, Acker-Minze,[14] Speer-Minze,[14] Polei-Minze[14] und Wasserminze[14]) sowie in Baldrian (Valeriana officinalis),[14] Edeltannen- und Koniferenöl[13] und in Hanf (Cannabis sativa L.)[15] enthalten und riecht nach Terpentin. Das racemische Limonen kommt unter anderem im Kienöl, im sibirischen Bayöl,[16] Fichtennadelöl, Neroliöl, Muskatnussöl[17] und Campheröl, im Basilikum,[18] Wacholder[19] und in Waldkiefern[19] vor.
- Zitronenöl enthält ca. 65 % (R)-(+)-Limonen.
- Baldrian enthält (S)-(−)-Limonen.
Gewinnung/Darstellung
Limonen wird in erster Linie durch Naturstoffextraktion gewonnen. (R)-(+)-Limonen fällt in großen Mengen als Nebenprodukt bei der Orangensaftproduktion an und wird durch Wasserdampfdestillation der dabei anfallenden Schalen gewonnen.[20] (S)-(−)-Limonen wird in verhältnismäßig kleinen Mengen aus den entsprechenden Ölen extrahiert. Das racemische Limonen fällt als Nebenprodukt bei der säurekatalysierten Isomerisierung von α- und β-Pinen an.
Biosynthese
Die Biosynthese von Limonen geht von Geranylpyrophosphat (GPP) aus.

Remove ads
Eigenschaften
Zusammenfassung
Kontext
Physikalische Eigenschaften
Der spezifische Drehwinkel beträgt [α]20D +126,3° [D-Limonen] bzw. −126,3° [(S)-Limonen].[21]
Chemische Eigenschaften
Limonen ist licht-, luft-, wärme-, alkali- und säureempfindlich und autoxidiert zu Carvon.
Durch zwei aufeinander folgende Reaktionen mit Sauerstoff und Kohlendioxid entsteht Polylimonencarbonat, ein Stoff mit Polystyrol-ähnlichen Eigenschaften. Es ist Ausgangsstoff zur Synthese des β-Selinen, wobei es im ersten Schritt mit Diboran reagiert und dann mit Wasserstoffperoxid oxidiert wird.
Sicherheitstechnische Kenngrößen
Limonen bildet bei höherer Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 50 °C.[3][22] Der Explosionsbereich liegt zwischen 0,7 Vol.‑% (39 g/m3) als untere Explosionsgrenze (UEG) und 6,1 Vol.‑% (345 g/m3) als obere Explosionsgrenze (OEG).[3][22] Die Grenzspaltweite wurde mit 1,14 mm bestimmt.[3][22] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[3][22] Die Zündtemperatur beträgt 255 °C.[3][22] Der Stoff fällt somit in die Temperaturklasse T3.
Geruch
Reines (R)-Limonen riecht höchstens schwach nach Orange. Der Orangengeruch von (R)-Limonen wird größtenteils von Verunreinigungen aus dem Ausgangsprodukt Orangenöl erzeugt. (S)-Limonen hingegen riecht nicht nach Zitrusfrüchten, sondern terpentinartig.[23]
Remove ads
Verwendung

Traditionell wird Limonen als preiswerter Duftstoff eingesetzt.[24] Es ist als Aromastoff in Lebensmitteln zugelassen.[25]
Das gramnegative Bakterium Pseudomonas putida DSM 12264 vermag R-(+)-Limonen regioselektiv zur R-(+)-Perillasäure zu oxidieren, einem natürlichen Konservierungsmittel für Kosmetika.[26] Die biotechnologische Herstellung von R-(+)-Perillasäure aus R-(+)-Limonen im Labormaßstab wurde im Jahr 2010 verbessert. Der entwickelte Bioprozess stellt eine vielversprechende Option für eine industrielle Anwendung dar.[27]
Das R-(+)-Limonen wird als pflanzliches Insektizid verwendet.
Auch dient es als Ausgangsstoff für die Synthese von synthetischem THC (Dronabinol).[28] In neueren Prozessen dient Limonen auch als Ausgangsprodukt für Biokunststoffe.[29][30]
Heute wird es vorwiegend als biogenes Lösungsmittel verwendet und dient als Reiniger und Verdünnungsmittel, beispielsweise in der Lackindustrie.
Remove ads
Biologische Bedeutung
Beim Metabolismus des Limonens entsteht hauptsächlich Perillasäure, Dihydroperillinsäure, Limonen-1,2-diol und Uroterpenol. Limonen wirkt reizend. Seine Oxidationsprodukte D-(−)-Carvon und mehrere Isomere des Limonenoxid, die aus Limonen an der Luft entstehen, sind allergieauslösend.[31]
Sicherheitshinweise
R-(+)-Limonen wurde als für den Menschen nicht karzinogen eingestuft.[32]
Weblinks
Commons: Limonen – Sammlung von Bildern, Videos und Audiodateien
- Eintrag zu Limonene in der Spectral Database for Organic Compounds (SDBS) des National Institute of Advanced Industrial Science and Technology (AIST)
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads






