Top-Fragen
Zeitleiste
Chat
Kontext
Anthocyanidine
Aus Wikipedia, der freien Enzyklopädie
Remove ads
Die Anthocyanidine sind eine Gruppe von sekundären Pflanzenstoffen innerhalb der Stoffgruppe der Flavonoide. Die Grundstruktur der Anthocyanidine ist das Flavylium-Kation, wobei mehrere Wasserstoffatome des Flavylium-Kations durch Hydroxy- bzw. Hydroxy- und Methoxy-Gruppen substituiert sind. Sie stellen den farbgebenden Anteil der Anthocyane (einer Gruppe von Pflanzenfarbstoffen) dar. Anthocyane bestehen strukturell aus einem Aglycon in der Form eines Anthocyanidins und einem glycosidisch an dieses Aglycon gebundenen Zuckers. Da an die Anthocyanidine unterschiedliche Zucker gebunden sein können, ergibt sich ausgehend von den Anthocyanidinen eine Vielfalt von ca. 250 Anthocyanen. Die glycosidische Bindung in Anthocyanen kann säurekatalysiert gespalten und so die Anthocyanidine freigesetzt werden.

Remove ads
Geschichte
Wesentliche Beiträge zur Strukturaufklärung der Anthocyane leistete Richard Willstätter[1][2][3][4][5][6][7][8][9][10][11], der für seine systematische Pionierarbeit auf diesem Gebiet den Nobelpreis für Chemie im Jahre 1915 erhielt. Es gelang ihm, aus Pflanzenextrakten die Anthocyane zu isolieren sowie hieraus durch Abbaureaktionen die Anthocyanidine freizusetzen und zu identifizieren. Letztlich sind nur circa zehn Anthocyanidine als natürliche Stammverbindungen bekannt.
Remove ads
Struktur
Zusammenfassung
Kontext
Die Anthocyanidine sind die Salze von mehrfach hydroxysubstituierten bzw. hydroxy- und methoxysubstituierten Derivaten des Flavylium-Kations.[12] Als anionisches Gegenion fungieren in der Natur meist die Carboxylate diverser wasserlöslicher Carbonsäuren, bei Laborpräparaten häufig Chlorid. Zur Kristallisation benutzte man früher Pikrate.
Die normalen Anthocyanidine (vgl. im Unterschied hierzu die 3-Desoxyanthocyanidine weiter unten) weisen in Position 3 und 4' immer eine Hydroxygruppe auf. Sie unterscheiden sich durch das weitere Substitutionsmuster mit Hydroxy- bzw. Methoxygruppen am Flavylium-Kation (vgl. die folgende Tabelle). Dabei sind die am häufigsten natürlich vorkommenden Anthocyanidine in 5- und 7-Position des A-Rings hydroxysubstituiert.
Die mit Abstand häufigsten Anthocyanidine sind Cyanidin, gefolgt von Delphinidin und Pelargonidin. Deren Methylether Peonidin, Petunidin und Malvidin finden sich ebenfalls häufig.

Neben der Gruppe der Anthocyanidine gibt es noch die kleine Gruppe der 3-Desoxyanthocyanidine (mit R3 = H). Hierzu zählen
- Apigeninidin (3-Desoxypelargonidin, Gesneridin)
- Luteolinidin (3-Desoxycyanidin) und als Methylether Diosmetinidin (3-Desoxypeonidin)
- Tricetinidin (3-Desoxydelphinidin)
- Columnidin
3-Desoxyanthocyanidine verhalten sich in Bezug auf Farbe und Acidität[18] wie Anthocyanidine.
Remove ads
Eigenschaften
Zusammenfassung
Kontext


Anthocyanidine sind licht-, luft- und temperaturempfindlich, bei pH-Werten unter 3 sind sie in Form ihrer Flavyliumsalze am stabilsten.
Anthocyanidine absorbieren Licht im sichtbaren Bereich zwischen 450 und 650 nm und erscheinen daher rot, violett oder blau. Der Wellenlängenbereich wird außer von der Molekülstruktur auch vom pH-Wert der Lösung beeinflusst. Im sauren Milieu überwiegt die Rotfärbung, im basischen sind vor allem Blau- und Violetttöne zu finden.
Die Bildung von Anthocyanidinen ist der zugrundeliegende Mechanismus der „Proanthocyanidinreaktion“, einer Farbreaktion mittels Erhitzen von Proanthocyanidinen mit verdünnten Mineralsäuren.
pH-Abhängigkeit des Farbumschlags
Die Farbänderungen beruhen auf chemischen Reaktionen.[19]
- Bei pH-Werten unter 3 sind sie rot gefärbt und liegen in Form von Flavyliumkationen vor.
- pH-Werte zwischen 4 und 5 führen durch Hydroxylierung zu farblosen Carbinol-Pseudobasen („Leucobasen“, Chromenol).
- Bei pH-Werten zwischen 5 und 7 liegen sie als Flavenole mit chinoider Struktur vor und sind purpur.
- Bei pH-Werten zwischen 7 und 8 wird dieses Molekül zum Flavenolatanion deprotoniert, das eine blaue Farbe aufweist. Hier sind die Π-Elektronen im gesamten Molekül über eine längstmögliche Distanz delokalisiert und daher mit niedrigster Lichtenergie anregbar.
- pH-Werte ab 8 führen bei Fehlen von Glycosidgruppen in 5-Position auch zu Flavenolat-Dianionen, jedoch konkurriert im Alkalischen die hydrolytischen Öffnung des Pyranringes. Das Molekül wird dabei irreversibel zu einem gelben[20] Chalkon-Anion umgewandelt.[21]
- Verglichen mit den pKS-Werten von Dihydroxybenzolen (pKS ca. 9,5 und 11,7) sind Anthocyanidine mehr als 1000-fach acider. Flavyliumsalze in Wasser sind mehr als 10-fach saurer als Ameisensäure (pKS 3,8).
Synthese
Zusammenfassung
Kontext
Robert Robinson kam 1921 aufgrund der Analyse der Substitutionsmuster der Flavonoide zu der Erkenntnis, dass die Flavonoide und damit die Anthocyanidine biochemisch aus einer C6- und einer C6-C3-Einheit aufgebaut sein müssen. 1953 erweiterten Arthur Birch und F. W. Donovan diese Theorie: Die Flavonoid-Biosynthese muss von einer p-Hydroxyzimtsäure und drei Acetateinheiten ausgehen, als Intermediat wird eine Polyketosäure gebildet.
Synthetisch werden die Anthocyanidine vielfach nicht direkt, sondern über ähnliche Flavonoide hergestellt. Flavone sind redoxäquivalent mit Anthocyanidinen, Flavanone mit 3-Desoxyanthocyanidinen. Es sind zahlreiche Methoden bekannt, um Flavone, Flavanone und Flavonole zu den entsprechenden Anthocyanidinen bzw. 3-Desoxyanthocyanidinen zu reduzieren.[22]
Anthocyanidine
Präparativ sind die Anthocyanidine durch eine Knoevenagel-Kondensation von 3,5-dimethoxysubstituierten Salicylaldehyden mit α-Methoxyacetophenonen zugänglich. Das Primärprodukt tautomerisiert unter Ringschluss zum α-Flavanol, das bei Zugabe von Säure Wasser abspaltet und das methoxysubstituierte Flavylium-Salz ergibt (Robinson-Anellierung). Methylether-Gruppen lassen sich schonend mit Iodwasserstoffsäure abspalten.

Flavone
Die Allan-Robinson-Kondensation[23] sowie deren intramolekulare Variante, die Baker-Venkataraman-Umlagerung, führen durch basenkatalysierte Kondensationsreaktionen zu Flavonen.

Flavonole
Bereits 1908 entdeckte Karl von Auwers durch Zufall eine Ringerweiterungsreaktion (Auwers-Synthese), die von Cumaronen zu Flavonolen führt.[24][25][26][27][28]

Die Algar-Flynn-Oyamada-Reaktion ist eine basenkatalysierte Ringschlussreaktion mit Wasserstoffperoxid. Hierbei werden Flavon-Zwischenstoffen bis zum Flavonol oxidiert.
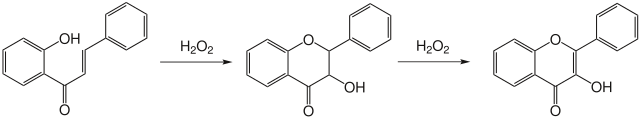
Reduktion
Mit klassischen milden Reduktionmethoden können spezifisch Flavone zu 3-Desoxyanthocyanidinen bzw. Flavonole zu Anthocyanidinen reduziert werden. Mit drastischen Reduktionsmethoden (Natriumamalgam in Wasser) lassen sich jedoch auch Flavanone zu rot gefärbten Flavyliumsalzen umsetzen.[29]

Remove ads
Biologische Bedeutung
Wichtige natürliche Farbmittel bestehen aus Anthocyanidinen. In Früchten enthaltene Anthocyanidine werden durch ihr antioxidatives Potential als Radikal-Fänger für die Gesundheit förderlich angesehen. In Rotweinen vorkommende Anthocyanidine wurden mittels Elektronenspinresonanz-Spektroskopie und „Spin-Trapping“ systematisch untersucht. Die Inhaltsstoffe fingen das Radikal des Superoxidanions mit hoher Wirksamkeit ab.[30]
Remove ads
Übersichtsartikel
- H. Halbwirth: The Creation and Physiological Relevance of Divergent Hydroxylation Patterns in the Flavonoid Pathway. In: Int J Mol Sci. Nr. 11, 2010, S. 595–621, PMC 2852856 (freier Volltext).
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

