Loading AI tools
durch Rundwürmer verursachte Hundekrankheiten Aus Wikipedia, der freien Enzyklopädie
Fadenwurminfektionen des Hundes – die Ansteckung (Infektion, auch Infestation) von Hunden mit parasitisch lebenden Fadenwürmern (Nematoda) – sind neben dem Bandwurmbefall und den Infektionen mit Einzellern (Giardiose, Neosporose) häufige Parasitosen in der tierärztlichen Praxis. Saugwurminfektionen sind dagegen seltener. Fadenwürmer besiedeln als sogenannte Endoparasiten („Innenschmarotzer“) verschiedene innere Organe – die meisten von ihnen den Verdauungstrakt – und die Haut. Bislang sind bei Haushunden etwa 30 verschiedene Fadenwurmarten nachgewiesen worden; sie sind im Wesentlichen auch bei wildlebenden Hundearten zu finden. Die Mehrzahl davon ruft aber bei erwachsenen Tieren häufig keine oder nur geringe Krankheitserscheinungen hervor. Die Infektion muss sich also nicht zwangsläufig auch in einer Wurmerkrankung (Helminthose) äußern. Für die meisten Fadenwürmer lässt sich eine Infektion durch eine Untersuchung des Kots auf Eier oder Larven nachweisen. Von gesundheitspolitischer Bedeutung ist in Mitteleuropa vor allem der Befall mit dem Hundespulwurm und dem Hundehakenwurm, da sie auch auf den Menschen übergehen können (Zoonose). Eine regelmäßige Entwurmung kann die Befallshäufigkeit und damit die Infektionsgefahr für Menschen und Hunde deutlich reduzieren.


Bei Hunden treten zwei Spulwurmarten auf: Toxocara canis und Toxascaris leonina.
T. canis ist ein 8 bis 18 cm langer Fadenwurm, der im Dünndarm parasitiert (als Parasit lebt). Dort geben die erwachsenen Weibchen etwa 85 µm große ungefurchte Eier ab, deren Schale dick und rau (golfballähnlich) ist und die über den Kot in die Außenwelt gelangen. Der Zeitraum von der Infektion bis zur Eiablage (Präpatenz) beträgt je nach Infektionsweg und Alter des Hundes drei bis sechs Wochen. Für die Entwicklung benötigt T. canis keinen Zwischenwirt, die Ansteckung der Hunde kann aber über Sammelwirte wie Nagetiere und Vögel erfolgen. In Sammelwirten (paratenischen Wirten) kommt es zu keinem vollständigen Entwicklungszyklus der Parasiten, aber durch Mehrfachinfektionen können sich in ihnen infektiöse Stadien anreichern. Prinzipiell sind für T. canis drei Infektionswege möglich: Die perorale Infektion sowie die bei Welpen wesentlich häufigere transplazentare und galaktogene Infektion.

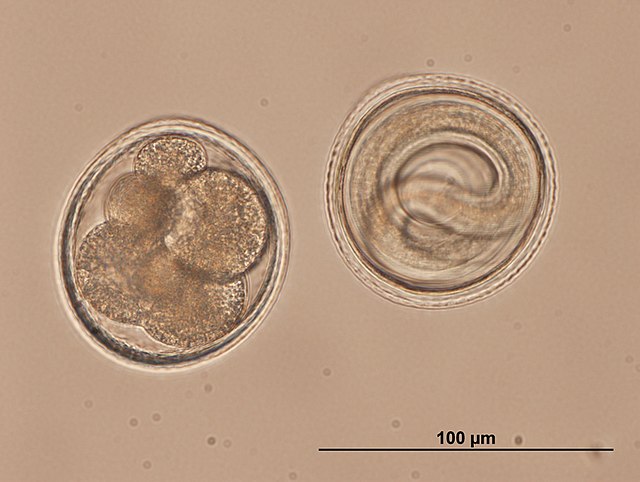

T. leonina ist 6 bis 10 cm lang, die Eier sind etwa 80 µm groß und dickschalig. Im Gegensatz zu den Eiern von T. canis haben sie eine glatte Oberfläche. Die Ansteckung erfolgt peroral durch Aufnahme mit Eiern kontaminierter (verunreinigter) Nahrung oder über Sammelwirte wie Nagetiere, Vögel, Reptilien oder Gliederfüßer. Die Präpatenz beträgt 7 bis 10 Wochen.[2]
In einer deutschen Studie wurde T. canis in einer Häufigkeit (Prävalenz) von 22,4 %, T. leonina nur bei 1,8 % der Haushunde nachgewiesen.[3] In Österreich wurde für T. canis eine Prävalenz von 5,7 %, für T. leonina von 0,6 % ermittelt.[4] Beide Spulwürmer kommen weltweit vor. Eine tschechische Studie zeigt große Unterschiede in der Prävalenz je nach Lebensverhältnissen: 6 % der Hunde in privater Haltung in Prag, 6,5 % der Tierheimhunde und fast 14 % der Hunde aus ländlichen Gebieten waren mit T. canis infiziert. Darüber hinaus wurde ein Anstieg der Prävalenz im Herbst aufgezeigt.[5] Haushunde in Belgien zeigten für T. canis eine mittlere Befallshäufigkeit von 4,4 %, solche aus größeren Zwingerhaltungen von bis zu 31 %.[6] Bei Haushunden in Serbien war T. canis bei 30 % der Tiere nachweisbar[7], bei Hüte- und Jagdhunden in Griechenland bei 12,8 % und T. leonina bei 0,7 % der Tiere.[8] In einer Studie aus dem Jahr 2024 wurde festgestellt, das die Prävalenz von T. leonina in einigen Regionen Eurasiens vermutlich deutlich höher ist als bislang angenommen. Hier ließen sich in knapp 54 % der Kotproben T. leonina und in knapp 15 % Toxocara spp. nachweisen.[9]
In Kanada wurde für T. canis eine Prävalenz von 3,9 % ermittelt[10], im Nordosten der USA von 12,6 %.[11] In Australien wurde T. canis bei 38 % der Haushunde nachgewiesen, bei Tieren innerhalb des ersten Lebensjahrs sogar bei 73 %.[12] In Brasilien ließ sich T. canis bei etwa 9 % der Haushunde nachgewiesen[13], in Thailand bei 7,4 %.[14] In Nigeria wurde T. canis in einer Häufigkeit von 9 % beobachtet, T. leonina nur in einer von 0,6 %[15], in Gabun waren 58,5 % der Haushunde mit T. canis infiziert.[16] Bei Wölfen, die in der gemäßigten Klimazone leben, ist dagegen T. leonina der häufigste Darmfadenwurm überhaupt (Prävalenz 74 %).[17] Untersuchungen am Rotfuchs in Südengland zeigten eine Prävalenz von 56 % (T. canis) bzw. 1,5 % (T. leonina)[18], in Dänemark von 59 bzw. 0,6 %.[19] Füchse stellen damit ein natürliches Erregerreservoir dar.
Während die Infektion mit T. leonina nur sehr selten klinische Erscheinungen wie Durchfall hervorruft, ist die krankheitsauslösende (pathogene) Wirkung von T. canis deutlich stärker. Bei Welpen treten ein herabgesetztes Allgemeinbefinden, struppiges Fell, Zurückbleiben im Wachstum, abwechselnd Durchfall und Verstopfung, ein aufgetriebener Bauch („Wurmbauch“) und Blutarmut auf. Komplikationen des T.-canis-Befalls mit teilweise tödlichem Ausgang sind Darmverschluss durch Wurmknäuel, Dünndarmdurchbruch, Lungenentzündung, Leberentzündung oder neurologische Erscheinungen durch verirrte Wanderlarven im Zentralnervensystem.[2]
Die Diagnose kann bei Würmern in Erbrochenem bereits ohne Spezialuntersuchungen gestellt werden. Relativ sicher kann ein Spulwurmbefall durch den mikroskopischen Nachweis der über das Flotationsverfahren aus dem Kot herausgelösten Eier nachgewiesen werden, allerdings erst nach Ablauf der Präpatenz.[2]


Bei Hunden kommen vor allem zwei Hakenwurmarten vor: Ancylostoma caninum und Uncinaria stenocephala. Sie parasitieren im Dünndarm und verursachen durch das Saugen von Blut eine Blutarmut sowie Schädigungen der Darmschleimhaut.[20] Die Würmer haben mit etwa 5–15 mm nur etwa ein Zehntel der Länge von Spulwürmern, ein hakenförmig abgewinkeltes Vorderende (daher der Name „Hakenwurm“) und eine große Mundkapsel mit Schneidplatten.
Weibchen von A. caninum geben etwa 65×40 µm große Eier ab, die bei der Ablage bereits 4–10 Furchungstadien aufweisen. Sie sind oval und dünnschalig und gelangen über den Kot in die Außenwelt. Die Präpatenz beträgt zwei bis vier Wochen. Die aus den Eiern freiwerdenden Larven können sich durch die Haut in einen neuen Wirt bohren (perkutane Infektion) oder peroral aufgenommen werden – zumeist über Sammelwirte wie Nagetiere. Wie bei T. canis ist eine Ansteckung der Welpen auch über die Muttermilch möglich (galaktogene Infektion). Die in der Milchdrüse ruhenden Larven können nach einmaliger Infektion einer Hündin über einen Zeitraum von bis zu drei Säugeperioden ausgeschieden werden.[20]
Die Eier von U. stenocephala ähneln denen von A. caninum, haben mit 85×45 µm aber eine größere Längsachse. Die Infektion erfolgt ausschließlich über die perorale Aufnahme von Larven über kontaminiertes Futter beziehungsweise Sammelwirte.
In Deutschland wurde eine Befallshäufigkeit von 8,6 % ermittelt[3], in Österreich von 0,1 % für A. caninum und 0,2 % für U. stenocephala.[4] Eine tschechische Studie ermittelte für beide Hakenwürmer eine Prävalenz von je 0,4 %[5], eine griechische von zusammen 2,8 %.[8] In Studien an Haushunden in Serbien[7] und Nigeria[21] waren bei einem Viertel der untersuchten Haushunde Hakenwürmer nachweisbar, U. stenocephala aber nur bei 0,4 % der Tiere.[15] In Gabun waren beide Hakenwürmer bei 35 % der Haushunde nachweisbar.[16] In Kanada wurde A. caninum bei lediglich 1,3 % der Haushunde nachgewiesen[10], im Nordosten der USA dagegen bei 12 %.[11] In einer brasilianischen Studie (37,8 % der Haushunde)[13] und einer thailändischen Studie (58,1 % der Haushunde)[14] war A. caninum sogar der häufigste Fadenwurm überhaupt. In Australien wurde eine Prävalenz von 26 % für U. stenocephala ermittelt.[12] Bei Wölfen, die Tundren besiedeln, ist dagegen U. stenocephala der häufigste Darmfadenwurm (Prävalenz 45 %).[17] Bei Rotfüchsen ist dieser Parasit mit einer Vorkommenshäufigkeit von 68 % ebenfalls sehr häufig.[18][19]
Während der Befall mit U. stenocephala häufig nur geringe Krankheitserscheinungen wie Durchfall verursacht, kann der Befall mit A. caninum vor allem bei Welpen schwere Krankheitsbilder verursachen. Dabei können blutiger Durchfall, starke Abgeschlagenheit und Blutarmut auftreten, teilweise mit akutem oder perakuten Verlauf und plötzlichen Todesfällen. Bei chronischem Verlauf bleiben die Jungtiere im Wachstum zurück, sind teilnahmslos, zeigen mangelnden Appetit, Durchfall und Abmagerung. Eher selten tritt eine Lungenentzündung durch wandernde Larven auf. Ein Hakenwurmbefall kann durch den Nachweis der Eier im Kot mittels Flotationsverfahren diagnostiziert werden.[20]


Der häufigste Peitschenwurm des Hundes ist Trichuris vulpis. Er ist 4–8 cm lang, hat ein langes dünnes Vorder- und ein verdicktes Hinterende. Die Eier sind zitronenförmig, 80×40 µm groß, bräunlich, dickschalig und haben an den Polen Verdickungen („Polpfröpfe“). Sie sind bei der Eiablage ungefurcht. Die Infektion erfolgt durch Aufnahme der in der Außenwelt embryonierenden (eine Larve enthaltenden) Eier. Die Präpatenz ist mit 9–10 Wochen relativ lang. T. vulpis parasitiert im Blind- und Grimmdarm.[22]
T. vulpis ist weltweit verbreitet. In Deutschland sind etwa 4 % der Haushunde befallen[3], in Österreich 3,1 %.[4] In Tschechien wurde eine Prävalenz von etwa 1 % ermittelt[5], in Griechenland von 9,6 %.[8] In einer Studie an Haushunden in Serbien war T. vulpis dagegen der häufigste Darmparasit und bei 47 % der untersuchten Tiere nachweisbar.[7] Im Nordosten der USA waren 15 % der Haushunde befallen.[11] In Nigeria wurde er in einer Studie nur bei 0,5 % der Tiere nachgewiesen[15], in einer anderen Studie deutlich häufiger[21], in Gabun waren 50 % der Haushunde infiziert.[16] In Brasilien betrug die Befallshäufigkeit 7 %[13], in Thailand 20,5 %.[14] In Australien war T. vulpis mit einer Prävalenz von 41 % der häufigste Fadenwurm bei ausgewachsenen Hunden.[12] Beim Rotfuchs liegt die Befallshäufigkeit bei 0,5 %.[18][19]
Die krankheitsauslösende Wirkung von T. vulpis ist mittelgradig. Befallene Hunde zeigen Durchfall, der blutig, bei weniger schwerem Verlauf mit Schleim durchsetzt ist. Die Tiere magern ab, Jungtiere bleiben im Wachstum zurück, bei starkem Befall kann sich eine Blutarmut entwickeln. Eine sichere Diagnose kann nur über den Einachweis im Kot mittels Flotationsverfahren gestellt werden.[22]
Die Infektion mit dem Zwergfadenwurm (Strongyloides stercoralis, Syn. S. canis)[23] ist eigentlich ein Parasit beim Menschen, aber auch Hundeartige können befallen werden und stellt vermutlich ein bedeutendes Erregerreservoir für Infektionen beim Menschen dar.[24] Er kann durch Aufnahme infektiöser Larven über die Muttermilch, perorale Aufnahme oder durch aktives Eindringen der Larven durch die Haut erfolgen. Eine Autoinfektion, also die Infektion des gleichen Tieres durch von ihm ausgeschiedene Larven, ist möglich. Der Zwergfadenwurm parasitiert im Dünndarm. Die Eier sind etwa 50 µm lang und enthalten bei Ausscheidung mit dem Kot bereits die infektiöse Larve.[25] Bei griechischen Hüte- und Jagdhunden wurde eine Prävalenz von 1,8 % ermittelt[8], bei Haushunden in Thailand eine von 2 %.[14]
Die Strongyloidiasis verursacht bei Welpen akuten bis chronischen Durchfall, gelegentlich auch eine Verstopfung.[26] Die Diagnose kann durch den Nachweis der Eier im Kot mittels Flotationsverfahren gestellt werden.[25]
Magenwürmer gehören zu einer weltweit verbreiteten Gattung von Fadenwürmern, welche die Schleimhaut von Magen und Zwölffingerdarm befallen können. Bei Hunden kommen zwei Physaloptera-Arten vor, am häufigsten P. rara. Männliche Würmer sind bis zu 30 mm, weibliche bis zu 40 mm lang. Die Eier sind oval, dickschalig, 55 × 32 µm groß und enthalten bereits eine Larve. Die Larven bilden Zysten in verschiedenen Insekten – insbesondere Käfer, Schaben und Grillen sind Zwischenwirte. Mäuse und Frösche können den Hund als Sammelwirte ebenfalls infizieren. Die Larven schlüpfen im Magen, heften sich direkt an die Schleimhaut und häuten sich zu Adulten (geschlechtsreifen Würmern).[27]
Die Magenwürmer verursachen Schäden an der Magenschleimhaut, was zu Gastritis, Blutungen und chronischem Erbrechen führt.[28] Bei starkem Befall kommt es zu Gewichtsverlust und Blutarmut. Der Nachweis der Eier im Kot mit dem Flotationsverfahren ist unsicher, da sie kaum aufschwemmen. Daher gibt es keine systematischen Untersuchungen zur Vorkommenshäufigkeit. Eine sichere Diagnose kann mittels Magenspülproben oder einer Magenspiegelung gestellt werden.[29]
Der Speiseröhrenwurm (Spirocerca lupi) ist ein hellroter Wurm, der zu Knötchen in der Speiseröhrenwand führt. Männliche Würmer messen etwa 40 mm, weibliche Würmer sind ungefähr 70 mm lang. Die Infektion erfolgt peroral über Zwischenwirte (verschiedene Mistkäfer) oder über paratenische Wirte wie Hühner, Reptilien und Nagetiere, welche sich durch den Verzehr der Käfer infiziert haben. Die Larve wandert durch die Wand der Aorta, in der sie etwa drei Monate verbleibt, und von dort in die Speiseröhrenwand, wo sie sich zum adulten Wurm entwickelt. Die Präpatenz beträgt fünf bis sechs Monate. Die Eier sind von zylindrischer Form, haben abgerundete Kappen, eine dünne, glatte Wand und messen 30–37 × 11–15 µm. Zum Zeitpunkt der Ausscheidung befindet sich in ihnen bereits die Larve.[30]
Die Infektion ist im Süden der USA sowie in tropischen Ländern verbreitet. In Gabun ließ sich der Parasit bei einem Viertel der Haushunde nachweisen.[16]
Die Würmer können während ihrer Wanderung gelegentlich ein Aortenaneurysma verursachen, oft sind befallene Hunde jedoch symptomlos. In der Speiseröhre selbst verursacht S. lupi eine granulomatöse Gewebsreaktion, welche ohne Behandlung sehr oft entartet und dann verschiedene bösartige Tumoren bildet. Neben Plattenepithelkarzinomen und Fibrosarkomen können die Speiseröhrenzellen auch zu Osteosarkomen entarten.[31] Durch die tumorbedingte Raumforderung im Brustkorb kann es zusätzlich auch zu einer hypertrophischen Osteopathie kommen.
Diagnostiziert wird ein Befall durch eine Endoskopie. Diese zeigt eine Masse in der Speiseröhre mit Parasiten an den warzenartigen Öffnungen. Bestätigt werden kann die Diagnose durch den Nachweis embryonierter Eier im Kot.[32]
Der Leberhaarwurm Capillaria hepatica kommt vor allem bei Nagetieren und Hasenartigen vor, Infektionen von Hunden sind selten. Die Infektion erfolgt durch das Fressen der Leber eines Nagetieres. Klinisch treten Symptome wie Bauchbeschwerden und Lebervergrößerung auf, die durch die Wanderung der Larven durch die Leber und die Eiablage entstehen. Eine sichere Diagnose ist nur durch eine Leberbiopsie möglich.[33]

Der Lungenhaarwurm (Capillaria aerophila, Syn.: Eucoleus aerophilus) ist bis zu 25 mm lang und parasitiert in den unteren Luftwegen. Die von den Wurmweibchen produzierten Eier besitzen zwei Polpfröpfe und eine farblose bis grünliche, körnige Schale. Sie gelangen durch Hochhusten und Abschlucken in den Magen-Darm-Kanal und schließlich über den Kot in die Umwelt. Die Infektion erfolgt durch Aufnahme von mit Eiern kontaminierten Futters oder Wasser. Im Darm schlüpfen die Larven und gelangen über den Blutkreislauf in die Lunge. Die Präpatenz beträgt etwa 40 Tage.[34]
In Deutschland wurde bei Haushunden eine Befallshäufigkeit von 2,3 % ermittelt[3], in Österreich von 0,2 %[4], in Tschechien von 0,6 %[5] und in Kanada von 0,3 %.[10] Bei Rotfüchsen in Südengland wurde für C. aerophila eine Prävalenz von 0,2 % ermittelt[18], in Dänemark dagegen von 74 %, womit Lungenhaarwürmer zu den am häufigsten vorkommenden Fadenwürmern zählen und Füchse ein bedeutendes natürliches Erregerreservoir für die Ansteckung von Hunden darstellen.[19] Auch andere Raubtiere wie Wölfe, Marderhunde, Marderartige, Luchse und Katzen werden befallen.[35]
Der Befall mit dem Lungenhaarwurm ruft nur selten klinische Symptome wie Husten, Niesen und Nasenausfluss hervor. Bei bakterieller Sekundärinfektion können aber auch tödlich verlaufende Bronchopneumonien auftreten.[36] Die Diagnose kann durch eine Kotuntersuchung mittels Flotationsverfahren auf Eier oder durch eine Lungenbiopsie gestellt werden.[34]
Der Lungenwurm Crenosoma vulpis ist bis zu 1,6 cm lang und wird indirekt über das Fressen von Zwischenwirten wie Schnecken übertragen.[37] Er besiedelt die Luftröhre und die Bronchien. Hauptwirt ist der Rotfuchs, aber auch Hunde, Marderhunde, Wölfe und Kojoten werden befallen.[36]
C. vulpis wurde in Deutschland bei etwa 1 % der Haushunde nachgewiesen[3], bei Hunden mit Lungensymptomatik bei 2,4 bis 6 % der Tiere[36]. In Kanada wurde eine Befallsrate von 3,2 % ermittelt.[10] Bei Rotfüchsen in Dänemark wurde eine Prävalenz von 17 % ermittelt[19], in Nordamerika Befallsraten zwischen 25 und 50 % – der Rotfuchs kann also als natürlicher Hauptwirt angesehen werden.[10]
Klinisch ist eine Infektion durch chronischen Husten gekennzeichnet und ähnelt einer allergischen Bronchitis.[10]
Der Nachweis von C. vulpis in Kotproben mit Standardflotationsverfahren ist relativ unsicher, lediglich 28,5 % der nach dem Larvenauswanderungsverfahren positiven Kotproben führten auch mit dem Standardverfahren zu einem positiven Ergebnis.[10]
Filaroididae sind eine Gruppe von in der Lunge und der Luftröhre schmarotzenden Fadenwürmern. Die häufigsten Spezies sind Oslerus osleri (Syn. Filaroides osleri), der in der Luftröhre – vor allem in der Gegend der Luftröhrengabel (Bifurcatio tracheae) – parasitiert (Oslerose) und Filaroides hirthi, der das Lungengewebe befällt (Filaroidose). Männliche O. osleri werden etwa 6–7 mm groß, weibliche 10 bis 13 mm. Die Eier messen 80–120 × 60–70 µm, die Larve L1 ist etwa 250 µm lang. F. hirthi ist 2–3 mm (Männchen) bzw. 7–13 mm (Weibchen), die Larve L1 ist 240–290 µm lang.[38] Andersonstrongylus milksi (Syn. Filaroides milksi) ist ein beim Hund seltener Vertreter der Filaroididae und ähnelt in Aussehen, Lebenszyklus und klinischem Bild weitgehend Filaroides hirthi.[39]
Die Parasiten verursachen kleine Knötchen im Bereich der Aufzweigung der Luftröhre bzw. im Lungengewebe; abgestorbene Würmer können auch größere Granulome verursachen. Die weiblichen Würmer legen Eier, aus denen die Larven schlüpfen, die sich über fünf Häutungen zum adulten Wurm entwickeln. Die Infektion erfolgt entweder über Eier oder die erste Larve, meist über direkten Kontakt mit Speichel, Nasensekret oder über regurgitierten Mageninhalt bei der Fütterung der Welpen durch die Mutter. Eine Ansteckung über das Fressen von Kot ist möglich, aber selten. Eine Selbstinfektion befallener Tiere ist ebenfalls möglich, da die Würmer keinen Zwischenwirt benötigen. Bei der Infektion wandert die Larve aus dem Darm über Blut- oder Lymphgefäße in den Blutkreislauf, von wo aus sie in die Lunge bzw. Luftröhrenwand gelangt und sich zum adulten Wurm entwickelt.[40] Die Präpatenz für O. osleri beträgt zehn Wochen, für F. hirthi fünf Wochen.[38]
Die Vertreter der Filaroididae kommen weltweit vor. O. osleri ist vor allem bei Füchsen und anderen wildlebenden Hundeartigen verbreitet, Infektionen von Haushunden sind selten. F. hirthi wurde erstmals bei Hunden der Rasse Beagle in den USA beobachtet, tritt aber mittlerweile weltweit und auch bei anderen Hunderassen auf, vor allem jedoch bei als Laborhunden gehaltenen Beagles.[38]
Die Infektion mit O. osleri ruft eine chronische Entzündung der Luftröhre und Bronchien mit starkem trockenen Husten sowie krankhaften Atemgeräuschen bei der Einatmung hervor. Die Erkrankung manifestiert sich in der Regel erst am Ende des ersten Lebensjahres und spricht auf eine antibiotische Behandlung nicht an. Das gleichzeitige Auftreten ähnlicher Symptome bei der Mutter und ihrer Welpen ist ein Hinweis auf eine solche Infektion. Gelegentlich kann bei Belastung eine anfallsartige Atemnot auftreten. Fieber tritt zumeist nicht auf.[41]
Zur Diagnose kann der Nachweis von Knötchen mittels Lungenspiegelung, eventuell auch auf Röntgenbildern des Brustkorbs, sowie der Larven in Lungenspülflüssigkeit oder Luftröhrenabstrichen genutzt werden. Der Nachweis von Larven im Kot mittels Flotationsverfahren ist unsicher, zumal die Larven nur unregelmäßig über den Kot ausgeschieden werden, während der relativ langen Präpatenz überhaupt nicht.[41]

Erreger der Erkrankung ist Dirofilaria immitis, ein Fadenwurm von 1 mm Dicke und 20–30 cm Länge. Er benötigt für seine Entwicklung einen Zwischenwirt, ein Teil des Entwicklungszyklus – vom Larvenstadium L1 bis L3 (Mikrofilarien) – verläuft in Stechmücken. Die Übertragung auf den Hund erfolgt beim Saugakt. In der Unterhaut entwickelt sich die Larve L4, welche in die Blutbahn eindringt und sich dort zu den erwachsenen Würmern häutet. Die adulten Herzwürmer besiedeln die rechte Herzhälfte, den Lungengefäßstamm und die herznahen Abschnitte der Hohlvenen. Erst etwa sechs Monate nach der Infektion bilden die Weibchen wiederum Mikrofilarien (Larve L1), die mit dem Blut in kleinere Blutgefäße gelangen und beim Saugakt erneut von Mücken aufgenommen werden.[42]
Bislang wurden über 70 Stechmückenarten als Überträger nachgewiesen, allerdings keine in Mitteleuropa heimischen Arten. In der Türkei haben 26 % der Haushunde Antikörper gegen D. immitis (Seroprävalenz).[43] In den Südstaaten der USA liegt die Seroprävalenz bei 4 %, in den nördlichen Bundesstaaten bei 1 %.[44] Im australischen Bundesstaat Viktoria wurde bei 8 % der über zwei Jahre alten Hunde Antikörper gegen D. immitis nachgewiesen[12], in Südkorea beträgt die Seroprävalenz etwa 40 %.[45]
Befallene Tiere zeigen mit der Entwicklung der reifen Würmer, also erst etwa sechs Monate nach der Infektion, eine reduzierte Leistungsfähigkeit und ermüden schnell. Es entwickelt sich eine Rechtsherzinsuffizienz mit Überlastung und Erweiterung der rechten Herzseite (Cor pulmonale), die sich in Atemnot, Husten und der Bildung von Ödemen äußert. Infolge der Herzinsuffizienz kann auch ein Leber- und Nierenversagen entstehen.[42]
Zur Diagnostik wird vorzugsweise der serologische Nachweis von D.-immitis-Antigen angewendet, der hochspezifisch und sensitiv ist. Darüber können über eine Blutuntersuchung mit Anreicherung oder gelegentlich auch mit einem einfachen Blutausstrich Mikrofilarien mikroskopisch nachgewiesen werden. Allerdings sind diese Nachweise auf die Phasen beschränkt, in denen wirklich Mikrofilarien in größerer Anzahl im Blut vorhanden sind, weshalb sie als aufgrund vieler falsch-negativer Befunde als wenig sensitiv angesehen werden.[42]
Der Französische Herzwurm (Angiostrongylus vasorum) ist ein Parasit des Lungengefäßstamms, der Lungenarterien und der rechten Herzkammer. Die sehr dünnen (170–360 µm), rosafarbenen Würmer werden 1,4 bis 2 cm lang. Die Präpatenz variiert zwischen 35 und 60 Tagen. Hauptsächlicher Endwirt des Parasiten sind Füchse, aber auch Hunde, Wölfe, Kojoten, Dachse, Pampasfüchse, Brasilianische Kampfüchse, Krabbenfüchse und Kleine Pandas werden befallen[36]. Ursprünglich war der Parasit vor allem in Frankreich, Dänemark und Großbritannien verbreitet. Weltweit steigt die Befallshäufigkeit seit einigen Jahren deutlich an, so gibt es endemische Herde auch in den Vereinigten Staaten, Südamerika, Australien und im asiatischen Teil Russlands.[36] Jüngste Zahlen zeigen in Deutschland eine Befallshäufigkeit von 7,4 % bei Tieren mit einer Lungenerkrankung[46] bzw. 0,5 % der Gesamthundepopulation[35].
Weibliche Würmer legen undifferenzierte Eier, die über die Blutbahn in die Lungenkapillaren gelangen, wo die Larven L1 schlüpfen und in die unteren Luftwege auswandern. Die Larven werden ausgehustet, abgeschluckt und mit dem Kot ausgeschieden. Die Ausscheidungsdauer (Patenz) beträgt bis zu fünf Jahre. In Zwischenwirten (verschiedene Schneckenarten) entwickeln sie sich zur infektiösen Larve L3. Nach Aufnahme dringen die Larven in die Darmwand ein und entwickeln sich in den Lymphknoten der Bauchhöhle weiter. Danach gelangen sie auf dem Blutweg in die rechte Herzkammer und die Lungenarterien, wo sie sich zu den adulten Würmern häuten.[47][46]
Die Larven erreichen die Lungenarterien zehn Tage nach der peroralen Infektion und verursachen schwere Lungenveränderungen und Störungen der Blutgerinnung auftreten. Gelegentlich wandern die Würmer und Larven auch in andere Organe (Larva migrans).
Klinisch zeigen befallene Hunde eine langsam fortschreitende Einschränkung der Herz- und/oder Lungenfunktion. Chronischer Husten, Atemnot, Nahrungsverweigerung und Gewichtsabnahme, Durchfall, zentralnervöse Symptome und Gewebsblutungen sind ebenfalls häufige Symptome.[36] Die Diagnose wird durch den Nachweis der Larve L1 im Kot mittels Larvenauswanderungsverfahren gestellt. Das zeitaufwändige Larvenauswanderungsverfahren kann durch serologische (Sandwich-ELISA) oder PCR-Nachweis ersetzt werden.[46] Für den serologischen Nachweis ist ein Schnelltest (IDEXX Angio Detect) verfügbar.
Der Riesennierenwurm (Dioctophyme renale; Syn. Dioctophyma renale) ist der größte bekannte parasitische Fadenwurm und kann beim Hund die Niere, gelegentlich auch die Bauchhöhle befallen. Weibliche Würmer erreichen Längen von über einem Meter bei einem Durchmesser von bis zu 12 mm; männliche Würmer messen 20 cm auf 6–8 mm. Beide Geschlechter haben eine blutrote Farbe. Der Parasit ist weltweit verbreitet, in Europa allerdings selten. Er ist nicht auf den Hund als Endwirt beschränkt, sondern kann die meisten Säugetiere (inklusive Mensch) befallen.[48] Zur Fortpflanzung und Eiausscheidung kann es nur kommen, wenn dieselbe Niere sowohl von einem weiblichen als auch von einem männlichen Wurm befallen ist und die Würmer das Nierenbecken bereits perforiert haben. Über das Nierenbecken werden Eier mit dem Urin ausgeschieden. Diese Eier sind oval bis zylindrisch, gelbbraun, dickwandig, mit rauer, genoppter Oberfläche und 71–84 × 45–52 µm groß.[49] Die Eier embryonieren je nach Umgebungstemperatur innerhalb von zwei Wochen bis drei Monaten und sind dann für Zwischenwirte infektiös.[50]
Die Infektion erfolgt über den Verzehr von Zwischenwirten oder paratenischen Wirten, welche Zysten mit Larven des Parasiten enthalten. Zwischenwirte sind Regenwürmer und wasserlebende Wenigborster, in denen die Larve L1 schlüpft und sich bis zur Larve L3 entwickelt; paratenische Wirte sind Süßwasserfische oder Frösche, in denen sich die Larve L3 im Muskelfleisch einkapselt. Die Larve wird im Verdauungstrakt des Endwirts aus ihrer Zyste freigesetzt, durchdringt die Darmwand und wandert für etwa 50 Tage in die Leber. Im Anschluss daran dringt sie direkt durch die Bauchhöhle in die Niere ein, wo sie sich zum adulten Wurm entwickelt. Dabei ist die rechte Niere häufiger betroffen als die linke. Bei Hunden verbleibt der Parasit allerdings recht häufig in der Bauchhöhle, was für den Hund weniger gravierende Folgen hat als ein Befall der Niere. Die befallene Niere wird durch den Parasiten langsam zerstört, der dabei üblicherweise auch das Nierenbecken perforiert.[50] Da Eier im Urin sehr selten auftreten, ist deren Nachweis zur Diagnostik ungeeignet. Ein Nierenwurmbefall kann mittels Sonografie nachgewiesen werden.
Der Harnblasenhaarwurm Capillaria plica ist 13 bis 60 mm lang und besiedelt die Harnblase, gelegentlich auch den Harnleiter und das Nierenbecken. Die Eier sind 63–68 × 24–27 µm groß, bedeckelt und haben eine leicht aufgeraute Schale. Sie werden über den Urin ausgeschieden. Als Zwischenwirte dienen Regenwürmer, in denen sich die infektiöse Larve L1 entwickelt. Die Ansteckung erfolgt durch Aufnahme der Zwischenwirte oder indirekt über Sammelwirte.[51]
Bei Haushunden in größeren Zwingern können bis zu drei Viertel der Tiere befallen sein.[52] Bei Rotfüchsen in Dänemark wurde eine Prävalenz von 80 % festgestellt, womit Harnblasenhaarwürmer die am häufigsten vorkommenden Fadenwürmer waren und Füchse ein bedeutendes natürliches Erregerreservoir für die Ansteckung von Hunden darstellen.[19]
C. plica ruft selten Krankheitserscheinungen hervor. Bei stärkerem Befall kann es zu einer Harnblasenentzündung mit Harndrang und Harninkontinenz kommen. Die Diagnose kann durch den Einachweis im Urin gestellt werden, allerdings aufgrund der langen Präpatenz nicht bei Tieren, die jünger als acht Monate sind.[52]
Pelodera strongyloides (Syn. Rhabditis strongyloides) ist ein normalerweise frei lebender Fadenwurm, der weltweit in feuchtem, faulendem organischen Material vorkommt und dessen Larve L3 gelegentlich die Haut von Hunden befällt. Die Ansteckung erfolgt durch direkten Kontakt mit larvenhaltigem Material in feuchten und verschmutzten Liegeplätzen (beispielsweise bei der Verwendung von feuchtem Stroh als Einstreu). Es ist unklar, ob die Larven in die gesunde Haut eindringen können; jedenfalls begünstigen bereits bestehende Hauterkrankungen und feuchte, die Haut aufweichende Verhältnisse die Infektion. Die Larven schmarotzen in den Haarfollikeln und den oberen Schichten der Lederhaut.[53][54]
Die Läsionen sind normalerweise auf diejenigen Hautteile beschränkt, die in direktem Kontakt mit dem infektiösen Material waren, meistens also Bauch, Unterbrust und Extremitäten. Die betroffene Haut ist gerötet, mäßig bis stark entzündet und teilweise bis völlig haarlos. Es besteht ein ausgeprägter Juckreiz, der zu weiteren Hautläsionen (Krustenbildung) und bakteriellen Sekundärinfektionen führen kann. Normalerweise ist die Krankheit selbstlimitierend, auch weil der Hund für die Würmer einen Fehlwirt darstellt. Die Diagnose wird durch ein Hautgeschabsel gestellt, in dem die etwa 600×38 µm messenden Larven mit dem Mikroskop leicht erkannt werden können.
Dracunculus insignis ist ein vor allem in Nordamerika vorkommender Fadenwurm, dessen Hauptwirt Waschbären darstellen.[55] Der Medinawurm (D. medinensis) kommt in Asien und Afrika vor und befällt zahlreiche Säugetiere einschließlich des Menschen.[56] Beide Parasiten kommen in diesen Gebieten gelegentlich auch beim Haushund vor. Die Infektion erfolgt peroral durch Aufnahme von Wasser mit Hüpferlingen, die als Zwischenwirt dienen, oder indirekt über die Aufnahme von Sammelwirten wie Fröschen. Die Larven werden bei der Verdauung freigesetzt und bohren sich durch die Darmwand. Weibliche Würmer wandern nach der Paarung in die Unterhaut. Hier bilden sie schmerzhafte und teilweise fistelnde Pseudozysten, die bei Kontakt mit Wasser aufplatzen und die etwa 0,5 mm langen Larven freisetzen. Die Diagnose kann durch den Nachweis der Larven oder der Wurmweibchen in solchen Zysten erfolgen.[55]
Dirofilaria repens ist ein Parasit des Unterhautgewebes bei Hunden. Als Zwischenwirt und Überträger fungieren Stechmücken. Er kommt vor allem in Süd-, südlichem Ost- und Westeuropa sowie weiten Teilen Asiens vor,[57] breitet sich aber immer weiter nach Nordeuropa aus und wird auch in Deutschland zunehmend nachgewiesen.[58]
Der Befall mit D. repens verursacht gelegentlich Hautknoten, Schwellungen, Juckreiz, Abszesse und Haarausfall, verläuft aber oft auch völlig ohne klinische Symptome. Zur Diagnose kann die Saure-Phosphatase-Reaktion angewendet werden.[59]
Acanthocheilonema reconditum (Syn. Dipetalonema reconditum) kommt in Südeuropa und in wärmeren Zonen Amerikas vor. Die Befallsraten liegen in Süditalien bei 16,5 %, in Griechenland bei bis zu 8 %, in Als Überträger dienen der Katzen- und der Hundefloh. Die Würmer parasitieren vor allem in der Unterhaut, ein kleiner Teil der Parasiten ist auch in inneren Organen zu finden.[60] Acanthocheilonema dracunculoides (Syn. Dipetalonema dracunculoides) ist ein Parasit der Körperhöhlen. Er kommt in Afrika und auf der Iberischen Halbinsel vor. In Afrika sind vor allem Lausfliegen die Überträger, in Spanien, wo die Prävalenz bei 1,5 % liegt, die Braune Hundezecke. Die Präpatenz beträgt 2–3 Monate.[60] Aber selbst ein massiver Befall löst bei Hunden keine klinische Erkrankung aus. Der Parasit ist vor allem differentialdiagnostisch von Bedeutung, weil die Mikrofilarien mit denen des Herzwurms verwechselt werden können und selbst der Antigen-Test Kreuzreaktionen zeigt.[61]
Cercopithifilaria grassi kommt in Südeuropa vor, in Griechenland sind etwa 1 % der Hunde befallen. Cercopithifilaria bainae kommt nicht nur in Südeuropa, sondern weltweit in den Subtropen vor, in Südportugal sind 23 % der Hunde von einer Cercopithifilaria-Art befallen.[62] Überträger ist die Braune Hundezecke. Diese beiden Filarien besiedeln die Unterhaut, die Mikrofilarien kommen in den oberen Hautschichten, nicht aber im Blut vor. Der Mikrofilariennachweis kann mikroskopisch anhand einer mit physiologischer Kochsalzlösung versetzten Hautprobe erfolgen.[63]
Die Thelaziose wird durch Vertreter der Gattung Thelazia hervorgerufen. Es handelt sich um weißliche Fadenwürmer von etwa 1,5 cm Länge. Thelazia callipeda ist vor allem im Fernen Osten (Japan, China, Korea, Indien und Russland) verbreitet, aber auch in einigen Regionen Italiens mit Befallsraten von bis zu 60 % ein häufiger Erreger von Augenerkrankungen. In der Schweiz und Frankreich kommt es in jüngerer Zeit vermehrt zu Einzelfällen.[64] In Deutschland wurden bislang vier Fälle dokumentiert, drei davon nach einem Aufenthalt in Italien.[65] Thelazia californiensis ist in Kalifornien verbreitet.[64] Die Biologie dieser Fadenwürmer ist nicht endgültig geklärt, als Überträger werden Fliegen vermutet[66], die die Larve L1 aufnehmen und in denen die Entwicklung bis zur infektiösen Larve L3 stattfindet.[64][67]
Thelazien parasitieren am Augapfel unter der Nickhaut sowie in den Tränenwegen und verursachen eine Bindehautentzündung und vermehrten Tränenfluss. Auch eine Verlegung der Tränenwege oder eine Hornhautentzündung kann auftreten. Bei starkem Befall sind die Würmer bereits mit bloßem Auge sichtbar. Eine sichere Diagnose kann durch den Nachweis der Würmer oder ihrer Larven in Augenspülproben oder einem Bioptat der Tränendrüse erfolgen.[65]
Erreger der Onchozerkose der Hunde ist Onchocerca lupi.[68] Die Erkrankung kommt in Nordamerika und einigen Ländern Europas (Griechenland, Ungarn) vor, ist aber selten – bislang wurden 64 Fälle beschrieben.[69] Die Würmer rufen erbsen- bis bohnengroße granulomatöse Knötchen in der Sclera, der Augenumgebung und Bindehaut hervor. Unter Umständen kann sich eine lymphoplasmazytäre Entzündung der mittleren Augenhaut entwickeln. Die Diagnose kann durch den Nachweis der Würmer in den Knötchen gestellt werden.[70]
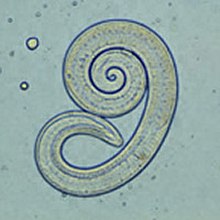
Trichinen (Trichinella spp.) sind eine Gattung von Fadenwürmern, deren Larven in die Skelettmuskulatur einwandern. Trichinen haben keine Außenweltphase, die Infektion erfolgt durch den Verzehr von rohem Muskelfleisch eines befallenen Tieres. In Europa ist Trichinella spiralis bei Haustieren am weitesten verbreitet, darüber hinaus kommen Trichinella britovi und Trichinella nativa beim Hund vor.
Im Darm werden das Muskelfleisch und die Zystenkapseln verdaut, wodurch die Larven freigesetzt werden und in die Schleimhaut von Zwölffinger- und Leerdarm eindringen. Dort entwickeln sie sich innerhalb von etwa vier Tagen zur adulten Trichine. Nach der Paarung bohren sich die weiblichen Würmer tiefer in die Schleimhaut und legen über vier bis 16 Wochen bis zu 1500 Eier pro Individuum. Die geschlüpften Larven sind etwa 100 Mikrometer lang. Sie wandern zunächst in die Lymphgefäße und danach über die Pfortader ins periphere Blutgefäßsystem. Sobald sie dabei die Muskulatur erreichen, verlassen sie das Blutgefäß und bohren sich in eine einzelne Muskelfaser. Dort wachsen sie rasch auf eine Länge von 1 mm heran, kapseln sich ein und beginnen die typische eingerollte Form anzunehmen. Die Kapselbildung im Muskelgewebe beginnt etwa 15 Tage nach der Infektion und ist nach vier bis acht Wochen abgeschlossen – das Fleisch des Wirts ist dann infektiös. Die Larven können in den Muskeln eines Wirts über Jahre hinweg infektiös bleiben; am häufigsten findet man sie in Zwerchfell, Zunge, Kaumuskeln und Zwischenrippenmuskeln.[71]
Zur Häufigkeit des Trichinenbefalls bei Hunden existieren nur wenig Daten. In Finnland, das eine sehr hohe Prävalenz von Trichinen bei Wildtieren aufweist, wurde bei Hunden serologisch eine Befallshäufigkeit zwischen 4,9 % und 8,6 % festgestellt. In derselben Studie wurden aber bei lediglich einem von 102 Hunden Zysten in der Muskulatur nachgewiesen.[72] In China, wo Hunde zum menschlichen Verzehr geschlachtet werden, wurden im Rahmen der Trichinenschau bei durchschnittlich 16,2 % der geschlachteten Hunde Trichinen festgestellt, wobei die Prävalenz je nach Region zwischen 1,2 und 44,8 % schwankte.[73]

Der Waschbärspulwurm (Baylisascaris procyonis) ist ein Verwandter des Hundespulwurms (Toxocara canis, siehe oben), der sich auf den Waschbären als Endwirt spezialisiert hat. In Deutschland sind 70 % aller Waschbären mit dem Parasiten infiziert. Infektionen des Hundes als Endwirt und Eiausscheider sind aus den USA bekannt, in ihrer Häufigkeit tendenziell zunehmend und stellen eine beträchtliche Zoonosegefahr dar. Klinisch schwerwiegender ist jedoch der Befall des Hundes als Fehlwirt durch die Aufnahme von Eiern. Die Larve des Waschbärspulwurms wandert sehr häufig in das zentrale Nervensystem des Fehlwirtes und verursacht dort schwere neurologische Ausfallerscheinungen, die tödlich sein können.[74]
Die meisten Infektionen sind für erwachsene Hunde eher harmlos, da sich bei intaktem Immunsystem ein Erreger-Wirt-Gleichgewicht einstellt. Da aber einige von ihnen gesundheitliche Störungen auslösen können und einige auch eine potentielle Gefahr für den Menschen darstellen, sind regelmäßige Wurmkuren bei Hunden durchaus sinnvoll. Vor allem für Hunde in größeren Haltungen, Jungtiere, Hunde mit Kontakt zu anderen Tieren, Jagdhunde, Streuner und Tiere, die mit rohen Fleischprodukten gefüttert werden, besteht ein höheres Infektionsrisiko.[75] Der European Scientific Counsel Companion Animal Parasites (ESCCAP) – die europäische Vereinigung der Fachleute für Parasiten bei Hund und Katze – hat daher Empfehlungen für die Bekämpfung der Wurminfektionen herausgegeben. Diese werden durch nationale tiermedizinische Fachgesellschaften an regionale Besonderheiten angepasst. In den Vereinigten Staaten gibt es ebenfalls solche Leitlinien, die hier vom Companion Animal Parasite Council (CAPC) herausgegeben werden.
Die zuletzt im Juli 2014 nach den ESCCAP-Richtlinien für Deutschland angepassten Empfehlungen zielen darauf, Hunde „(…) durch eine fachgerechte Diagnostik, Medikation und Prävention vor Infektionen mit Würmern und deren Folgen zu schützen“.[75] Eine regelmäßige Bekämpfung wird vor allem für Spulwürmer empfohlen.
Da Hundewelpen bereits bei der Geburt mit Spulwürmern infiziert sein können, sollten sie ab einem Alter von zwei Wochen alle 14 Tage bis zum Absetzen entwurmt werden. Säugende Hündinnen sollten bei der ersten Welpenentwurmung ebenfalls behandelt werden. Einen sicheren Schutz vor der Weitergabe von Spulwürmern bietet nur die monatliche Entwurmung. Ein monatlicher Turnus kann laut ESCCAP bei Hunde, die viel Kontakt zu anderen Hunden haben, regelmäßig unbeaufsichtigten Auslauf haben oder engen Kontakt in Familien mit Kleinkindern haben, erwogen werden. Prinzipiell sollte aber für jedes Tier eine individuelle Risikobewertung erfolgen. Sofern dies nicht möglich ist oder wenn Infektionen nicht durch diagnostische Untersuchungen ausgeschlossen werden können, wird eine viermalige Entwurmung pro Jahr angeraten. Für besondere Ereignisse, z. B. einen Sportwettkampf oder eine Ausstellung, empfiehlt die ESCCAP einmal ca. vier Wochen vorher sowie nochmals zwei bis vier Wochen nach dem Ereignis zu entwurmen.[75] Für die Behandlung gegen Spulwürmer sind in Deutschland für Haushunde Arzneimittel auf der Basis von Emodepsid, Fenbendazol, Flubendazol, Mebendazol, Milbemycinoxim, Moxidectin, Pyrantel und Selamectin zugelassen. Diese Arzneistoffe sind Breitbandanthelminthika und entfalten eine Wirkung auch gegen die meisten anderen bei Hunden vorkommenden Fadenwürmer.[76] Für die Behandlung trächtiger Hündinnen ist derzeit kein Präparat zugelassen[75], obwohl experimentelle Untersuchungen zeigten, dass die Anwendung von Selamectin[77] oder Emodepsid[78] in der Trächtigkeit einer Infektion der ungeborenen Welpen wirksam vorbeugt.
Die Herzwurmbekämpfung spielt in Deutschland nur eine Rolle bei Hunden, die ins endemische Ausland (u. a. süd- und osteuropäische Länder) verbracht werden sollen oder von dort kommen.[75] Zur Therapie und Prophylaxe der Herzwurmerkrankung sind derzeit Moxidectin, Milbemycinoxim und Selamectin zugelassen.[76] Außerdem empfiehlt sich bei Reisen in Herzwurm-Endemiegebiete ein Schutz mit insektenabweisenden Mitteln (Repellentien) wie Permethrin oder Deltamethrin.
Um den Infektionsdruck mit Würmern generell zu minimieren, ist auch die Bekämpfung der Parasiten in der Umwelt wichtig. Kot sollte täglich eingesammelt und über den Hausmüll entsorgt werden. Spulwurmeier sind im feuchten Boden beispielsweise bis zu vier Jahre, Peitschenwurmeier über sechs Jahre infektiös. Diese Eier haben eine hohe Tenazität, sind aber gegenüber längerfristigen Temperaturen über 35 °C und Trockenheit empfindlich. Regelmäßige Reinigungs- und Desinfektionsmaßnahmen sind unbedingt empfehlenswert. Fußböden können mit einem Dampfreiniger mit über 60 °C effektiv gereinigt werden, auf eine gute anschließende Trocknung sollte geachtet werden. Das Abflammen des Zwingerbodens sorgt für eine Beseitigung oder zumindest Verminderung der infektiösen Eier und Larven. Die meisten Desinfektionsmittel sind nicht gegen Fadenwurmeier wirksam, auch Handdesinfektionsmittel nicht, weshalb beim Umgang mit Kot Handschuhe getragen werden sollten.[79]
Der Mensch ist für den Hundespulwurm Toxocara canis und den Hundehakenwurm (Ancylostoma caninum) ein Fehlwirt, das heißt, die Larven schädigen befallene Organe, aber es findet keine Entwicklung zu adulten Würmern statt. Beide sind in Mitteleuropa die wichtigsten Zoonoseerreger unter den Fadenwürmern des Hundes.

Die Infektion mit T. canis erfolgt meist über eine Schmierinfektion durch perorale Aufnahme von mit Hundekot verunreinigtem Erdreich. Landwirte, Gärtner, Kanalarbeiter, Tierärzte und Kleinkinder (Spielen im Sandkasten) sind besonders gefährdet. In Österreich wurde bei 3,7 % der Gesunden Antikörper gegen T. canis nachgewiesen (Seroprävalenz), bei Personen in exponierten Berufen bei 44 %.[80] In der Slowakei wurde bei gesunden Blutspendern aus städtischen Gebieten eine Seroprävalenz von 12 %, bei solchen aus ländlichen Gebieten von 17 % ermittelt.[81] In den USA ist 14 % der Bevölkerung seropositiv.[82] Eine ägyptische Studie ermittelte bei gesunden Erwachsenen eine Seroprävalenz von 18 %[83], eine ähnlich hohe Infektionsrate wurde bei Kindern aus ländlichen Regionen in China ermittelt.[84] In Jordanien liegt die Seroprävalenz bei 11 %[85], in Nigeria bei 30 %[86], in ländlichen Gebieten Argentiniens bei 23 %.[87] Diese Seroprävalenzen zeigen jedoch nur an, welcher Prozentsatz der Bevölkerung eine Infektion durchlebt hat. Eine solche Infektion muss aber nicht zwangsläufig in eine Krankheit münden, sondern kann vom Immunsystem auch ohne Krankheitserscheinungen abgewehrt werden. In Sandkästen europäischer Großstädte wurde eine Kontamination mit Wurmeiern in 10–100 % der Proben ermittelt.[88] Erkrankungen treten vor allem bei Kindern und Jugendlichen auf.[82] Die Larven des Hundespulwurms können als Eingeweidewanderlarven (Larva migrans visceralis) verschiedenste Organe befallen und dort schwere Gewebsschädigungen verursachen. Am häufigsten sind Augen, Lunge, Leber und Zentralnervensystem betroffen.[81]
Die Larven von A. caninum können beim Barfußlaufen über mit Hundekot verschmutzten Böden durch die Haut eindringen. Dort rufen sie als Wanderlarven (Larva migrans cutanea, „Hautmaulwurf“) stark juckende Hautrötungen hervor. Die durch die Larven gebohrten Gänge sind oft mit bloßem Auge erkennbar. Die Erkrankung heilt meist spontan aus, was allerdings Monate dauern kann. Infektionen dieser Art sind in Mitteleuropa aber selten, in tropischen und subtropischen Regionen aber eine der häufigsten Hauterkrankungen.[89] Darüber hinaus kann A. caninum auch eine Darmentzündung mit Anzeichen eines akuten Bauchs auslösen.[90][91]
Von den Filarien sind der Herzwurm (Dirofilaria immitis) und Dirofilaria repens Zoonoseerreger. D. immitis ist für den Menschen nur selten krankheitsauslösend, obwohl etwa 20 % der Bevölkerung in Endemiegebieten Antikörper aufweisen. Zumeist kommt es zu einer Abkapselung der Larven in der Lunge. Für D. repens sind mehr als 400 Fälle beschrieben, in Europa vor allem in Italien und Frankreich. Die Seroprävalenz beim Menschen liegt in Italien bei 68 %, in Frankreich bei 22 %. Die adulten Würmer wandern vor allem in die Unterhaut, können sich aber in alle möglichen Organe einnisten.[92]
Der Hund stellt für die Verbreitung der Trichinellose nur in wenigen Regionen der Welt eine Rolle. In China ist der Verzehr von Hundefleisch eine wichtige Infektionsquelle für den Menschen.[93] Für den Befall mit dem Augenwurm (Thelaziose) sind bislang vier Fälle beim Menschen in Italien und Frankreich beschrieben[94], insbesondere unter der ärmeren Bevölkerung in Asien ist die Erkrankung aber weit verbreitet.[95] Darüber hinaus können Hunde zur Verbreitung von nicht wirtsspezifischen Parasiten wie dem Riesennieren- oder Medinawurm beitragen. Die epidemiologische Bedeutung des Haushundes für Infektionen des Menschen ist für diese Parasiten allerdings bislang nicht untersucht.
Um zoonotische Wurminfektionen bei Menschen zu vermeiden, ist Hygiene eine der wichtigsten Präventionsmaßnahmen. Dazu gehört u. a. Händewaschen, Entsorgung von Hunde- und Katzenkot sowie auch Verzicht auf den Verzehr von ungewaschenem Gemüse.[75]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.