Loading AI tools
Teilgebiet der Medizin Aus Wikipedia, der freien Enzyklopädie
Die Epidemiologie (von altgriechisch νόσος ἐπιδήμιος, nósos epidēmios „Epidemie, Volkskrankheit“,[1] und -logie wörtlich „die Lehre von dem, was über das Volk kommt“) ist jene wissenschaftliche Disziplin, die sich mit der Verbreitung sowie den Ursachen und Folgen von gesundheitsbezogenen Zuständen und Ereignissen in Bevölkerungen oder Populationen beschäftigt. Das unterscheidet die Epidemiologie von der klinischen Medizin, bei der es darum geht, einem einzelnen Menschen in einem konkreten Krankheitsfall zu helfen. Auch wenn sich Mediziner bereits zuvor mit der Verbreitung und den Ursachen von Krankheiten beschäftigt haben, wird der Beginn der wissenschaftlichen Epidemiologie auf die Mitte des 19. Jahrhunderts datiert. Einen Wissenschaftler, der sich speziell mit der Epidemiologie befasst, bezeichnet man als Epidemiologen.

Kern der epidemiologischen Vorgehensweise ist die quantitative Bestimmung der Ereignishäufigkeit und der Krankheitslast in einer Bevölkerung. Die Häufigkeit des Auftretens lässt sich mittels der Beobachtungsgröße der Inzidenz bestimmen. Die Prävalenz ist das Maß für die Verbreitung von Krankheiten in der Grundgesamtheit einer örtlich und zeitlich definierten Population. Die Epidemiologie untersucht weiter die Faktoren, die zu Gesundheit und Krankheit von Individuen und Populationen beitragen, und legt damit die Basis vieler Maßnahmen, die im Interesse der Gesundheit der Bevölkerung unternommen werden. Epidemiologische Methoden bilden die Grundlage klinischer Studien. Epidemiologische Untersuchungen spielen auch in der Soziologie und Psychologie eine Rolle, z. B. bei Verhaltensstörungen, Autismus und Selbsttötungen. So können Zusammenhänge mit der Verbreitung dieser Erscheinungen erfasst und ggf. beeinflusst werden.
Der Begriff der Bevölkerung oder Population bezieht sich nicht ausschließlich auf menschliche Populationen, auch Tiere und Pflanzen bilden Populationen. Also untersucht die Veterinärepidemiologie oder Epizootiologie die Verbreitung von Krankheiten in Tierpopulationen, die botanische Epidemiologie untersucht Krankheiten auf Pflanzen.
Einerseits ist die Epidemiologie eine medizinische Wissenschaft, denn wie bei anderen ärztlichen Tätigkeiten auch sucht man Ursachen von Krankheiten und geeigneten Präventions- bzw. Therapiemaßnahmen. Andererseits ist die Epidemiologie auch eine Teildisziplin der Statistik: Um der Frage nach möglichen Ursache-Wirkungsbeziehungen auf den Grund zu gehen bedient man sich statistischer Methoden und Maßzahlen. Durch mathematisch-statistische Modelle kann die spezifizierte Ursache und die interessierende Krankheit als Wirkung modelliert werden. Analytische Epidemiologie verbindet diese statistischen Methoden mit den Erkenntnissen und Verfahren der klinischen Medizin, deskriptive Epidemiologie wird auch als Gesundheitsstatistik bezeichnet. Stellt man fest, dass eine Krankheit zunimmt oder ein gewisses Maß überschreitet, so kann man gezielt Maßnahmen ergreifen. Definierte Situationen werden damit mit definierten Aktionen bekämpft. Die Quantifizierung ermöglicht zudem eine objektive Beurteilung der Effizienz einer Intervention.
Epidemiologie arbeitet wie jede andere wissenschaftliche Fachdisziplin interdisziplinär: Außerhalb ihres eigenen Kernbestandes an Wissen, Begriffen und Methoden stützt sie sich auf die Erkenntnisse anderer Fachdisziplinen: Medizin, Tiermedizin, Statistik, Biologie, Soziologie, Psychologie und Informatik und andere.[2]
Die Epidemiologie befasst sich mit allen Arten von Krankheiten und mit den Faktoren, die Gesundheit und Krankheit beeinflussen, und nicht mehr wie in ihrer Anfangszeit nur mit Epidemien[3] als zeitlich und räumlich begrenzte Zunahme des Vorkommens v. a. von Infektionskrankheiten.[4] Die Epidemiologie leistet praktische Arbeit in der Untersuchung von Faktoren, die Gesundheit und Krankheit beeinflussen. Diese Faktoren können sowohl im Individuum, seiner Genetik, Lebensgeschichte und seinem Verhalten liegen, als auch in der physischen, biologischen und sozialen Lebenswelt, der Umwelt. Epidemiologische Erkenntnisse von Risikofaktoren sind Grundlage der Gesundheitsförderung. Epidemiologie arbeitet mit beobachtenden und experimentellen Studien. So können zum Beispiel Beziehungen zwischen möglichen Ursachen wie Ernährung, sozialem Status, Stress und Umweltchemikalien sowie Folgen wie Krankheit und Wohlbefinden quantifiziert werden.
Mathematische Modelle sind sehr wichtig, um die Wahrscheinlichkeit von zukünftigen Epidemien und deren Verlauf zu bestimmen. Ebenso helfen sie bei der Planung der Impfkampagnen. Siehe dazu auch Mathematische Modellierung der Epidemiologie.
Epidemiologische Untersuchungen sind generell in beschreibende, analytische und experimentelle Tätigkeiten unterteilt. Einige Wissenschaftler arbeiten im Bereich der öffentlichen Gesundheit, andere an wissenschaftlichen Einrichtungen, in Kliniken oder in der Entwicklungshilfe. Beim Auftreten neuer Krankheiten wie etwa SARS, Vogelgrippe H5N1 und Vogelgrippe H7N9 sind Epidemiologen unentbehrlich.
Auflistung der Arbeitsgruppen der Deutschen Gesellschaft für Epidemiologie (DGEpi): Infektionsepidemiologie, Epidemiologie allergischer und dermatologischer Erkrankungen, Epidemiologie der Arbeitswelt, Epidemiologische Methoden, Ernährungsepidemiologie, Genetische Epidemiologie, Herz-Kreislauf-Epidemiologie, Krebsepidemiologie, Statistische Methoden in der Epidemiologie, Umweltmedizin.
Weitere Teilgebiete sind unter anderem die Ausbruchsepidemiologie,[5] die Oralepidemiologie, die Neuroepidemiologie, die Pharmakoepidemiologie, die Sozialepidemiologie und die Infodemiologie[6].
Die folgenden Kennzahlen erleichtern den Überblick über die Lage der Bevölkerung oder über die Ausbreitung von bestimmten Infektionen oder Krankheiten. Über- oder unterschreitet eine Kennzahl einen definierten Zahlenwert, können gezielte Maßnahmen ergriffen oder beendet werden. Definierte Situationen werden also mit definierten Aktionen bekämpft. Dies erleichtert auch eine objektive Beurteilung der Effizienz einer Intervention.
Die Anzahl von Neuerkrankungen innerhalb einer Personengruppe und eines bestimmten Zeitraums wird Inzidenz genannt.
Die Inzidenzdichte ist die Anzahl der Neuerkrankungen dividiert durch die unter dem Risiko einer Erkrankung verbrachte Zeit je Person (Personenzeit) in einer Bevölkerung; statt Erkrankungen können auch andere definierte Ereignisse betrachtet werden.
Die Inzidenzrate ist ein Maß für das Auftreten neuer Krankheitsfälle in einer Bevölkerung. Der Kehrwert der Inzidenzrate ist die durchschnittliche Zeit für ein Individuum bis zum Auftreten der Krankheit.
Eine Infektionszahl ist die unspezifische Angabe einer Zahl, die über die Verbreitung und das Ausmaß von Testergebnissen, Infektionen oder Krankheiten informiert. Ein Risikogebiet ist ein Gebiet mit einer akut erhöhten lokalen Inzidenz von Testergebnissen, Infektionen oder Krankheiten in der Bevölkerung, im weiteren Sinn auch mit einer akut erhöhten lokalen Infektionszahl. Die Wahrscheinlichkeit, mit der eine Person aus der betrachteten Bevölkerung in der definierten Zeitspanne mindestens einmal an der betrachteten Krankheit erkrankt wird auch als kumulative Inzidenz bezeichnet.
Die Prävalenz einer Erkrankung gibt den Anteil der erkrankten Individuen in der betrachteten Population an. Nach Checkoway u. a. 1989 kann man genauer unterscheiden zwischen „Prävalenz zu einem Zeitpunkt“ bzw. Punktprävalenz (englisch point prevalence) und „Prävalenz über einen Zeitraum“ bzw. Periodenprävalenz (englisch period prevalence). Auf Grund der problematischen Interpretation der Periodenprävalenz konzentriert man sich meist auf die Punktprävalenz, was auch meist gemeint ist, wenn man nur von Prävalenz spricht.
Die Prävalenz wird meistens als Quotient dargestellt – nämlich die Anzahl der jetzigen Fälle in einer Population (z. B. Erkrankte, Verstorbene, Unterernährte usw. unabhängig von der Dauer) dividiert durch die Anzahl aller Mitglieder dieser Population. Die Prävalenz als Maß für die Häufigkeit einer Krankheit ist nicht mit der Inzidenzrate zu verwechseln – das Maß für das Auftreten neuer Krankheitsfälle in einer Bevölkerung.
Beispiel: Zum 1. Januar 2002 waren in einem bestimmten Unternehmen 1.024 Mitarbeiter an Rückenleiden erkrankt. Bei einer Belegschaft von insgesamt 15.000 Mitarbeitern liegt die Prävalenz somit bei 0,068 oder 6,8 Prozent.
Ist die Inzidenz so hoch, dass bei der herrschenden Prävalenz im Bezugszeitraum weniger Erkrankungen ausheilen oder wegen Todes (Mortalität) ausscheiden als hinzukommen, so steigt die Prävalenz, bis ein Gleichgewicht (engl. steady state) hergestellt wird.
Als Risiko wird die Wahrscheinlichkeit für das Eintreten eines Ereignisses während eines bestimmten Zeitraums bezeichnet; als Ereignisse werden dabei typischerweise Neuerkrankungen oder Todesfälle betrachtet. Ein Beispiel: Verfolgte man eine Gruppe von 1.000 Personen über einen Zeitraum von 15 Jahren und würde dabei feststellen, dass 20 Personen gestorben sind während dieser 15 Jahre, so läge das 15-Jahre-Risiko bei 20/1.000.[7]
Das Risiko für Neuerkrankungen wird auch als kumulative Inzidenz bezeichnet. Das Lebenszeitrisiko bezeichnet die Wahrscheinlichkeit, im Laufe eines Lebens (mindestens) einmal zu erkranken, und ist damit eine spezielle kumulative Inzidenz; dennoch lautet eine alternative Bezeichnung Lebenszeitprävalenz.
Zur Identifizierung von Risikofaktoren werden Populationen verglichen, die sich in möglichst nur einer untersuchten Eigenschaft unterscheiden; dann lassen sich (absolute) Risikodifferenzen und relative Risiken berechnen. Risikofaktoren liefern Hinweise auf die Ursachen von Krankheiten; es muss jedoch kein kausaler Zusammenhang bestehen, insbesondere bei Beobachtungsstudien kann der Effekt auch durch systematische Verzerrungen oder Störfaktoren zustande kommen.
Das attributable Risiko hilft abzuschätzen, wie stark ein bestimmter Faktor zu einer bestimmten Erkrankung beiträgt. Eine konkrete Fragestellung könnte lauten: Wie stark ist der Einfluss von 10 Zigaretten täglich auf das Lungenkrebsrisiko?
Die Antwort darauf lautet:
Im Prinzip werden also die Risiken von Personen, die entweder 10 oder 0 Zigaretten pro Tag rauchen, miteinander verglichen. Das Risiko der Nichtraucher ist sozusagen das „Restrisiko“, das man (oft) nicht vermeiden kann und somit keine weitere Beachtung verdient.
Die Basisreproduktionszahl R0 ist definiert als durchschnittliche Anzahl sekundärer Infektionsfälle, die eine einzelne primär infizierte Person hervorruft, falls die betroffene Bevölkerung weder geimpft noch anderweitig vor der Übertragung geschützt und jedes Individuum empfänglich (suszeptibel) ist. Die Nettoreproduktionszahl Rt berücksichtigt hingegen die entwickelte Immunität und den Einfluss von Kontrollmaßnahmen. Um eine Epidemie einzudämmen, muss die Nettoreproduktionszahl gesenkt werden auf einen Wert von höchstens 1 (R = 1 bedeutet, dass 1 typischer Infektionsfall zu 1 Folgefall führt). Je näher der Wert bei 0 liegt, desto erfolgreicher ist eine Bekämpfung der Krankheitsausbreitung.
Beispiele für Basisreproduktionszahlen:
| R0: Basisreproduktionszahl |
| Rt: Nettoreproduktionszahl (effektive Reproduktionszahl) |
| n%: Anteil der Bevölkerung, bei dem keine Übertragung stattfindet, weil entsprechende Vorkehrungen gegen die Übertragung von Mensch zu Mensch getroffen wurden oder Menschen geimpft oder anderweitig immunisiert sind (Durchimpfungsrate) |
Aus dieser Formel folgt, dass bei Malaria 99,9 %, bei Masern etwa 94 % und bei Polio (Kinderlähmung) rund 86 % der Bevölkerung immun sein müssen, damit die Krankheit im Endemie-Zustand verharrt oder sogar ausgerottet werden kann. Eine Unterschreitung der Durchimpfungsraten hat lokale Epidemien zur Folge.[8][9]
Deshalb betrifft die Frage „Soll ich mein Kind impfen?“ keineswegs nur die Gesundheit des einzelnen Kindes, sondern auch die der gesamten Bevölkerung. Ein erkranktes Kind stirbt zwar sehr selten an einer Kinderkrankheit wie Röteln oder Masern, aber es kann die Infektion weiterverbreiten.
Ein Beispiel für sehr unterschiedliche Reproduktionszahlen der gleichen Krankheit ist die Malaria: Während diese Erkrankung in Afrika verheerend auftritt, stellt sie in Indien ein beherrschbares Problem dar, wobei die Anopheles-Mücke als Zwischenüberträger eine wesentliche Rolle spielt. Anhand der unter den jeweiligen Bedingungen für typische Infektionsfälle abgeschätzten Basisreproduktionszahl R0 und der effektiven Reproduktionszahl Rt kann die Dynamik einer Epidemie sowie die Wirksamkeit von Eindämmungsmaßnahmen (Masken, Kontaktbeschränkung) eingeschätzt werden. Für den zeitlichen Verlauf der Ausbreitung ist neben der Infektionsperiode auch die Zeitspanne zwischen einer erfolgreichen Übertragung und dem Beginn der Infektiosität von Bedeutung.
Die Generationszeit T einer Infektionskrankheit ist die Zeit zwischen den Infektionsereignissen zweier Individuen, von denen einer den anderen ansteckt. Während der Infektionszeitpunkt meist verdeckt verläuft, ist das Auftreten von Symptomen klarer erkennbar. So ist das serielle Intervall einfacher zu bestimmen: Das serielle Intervall beschreibt die durchschnittliche Zeit zwischen den Symptomen einer Infektion beim Überträger und dem Zeitpunkt, an dem die von ihm infizierte Person Symptome entwickelt. Beide Parameter können sich während einer Epidemie dynamisch verändern.[10]
Der Parameter r ist ein Maß für die Rate, mit der neue Fälle auftreten. Er kann eine positive Zahl sein (die Zahl der Neuinfektionen nimmt zu) oder eine negative Zahl (die Zahl der Neuinfektionen nimmt ab).Zu Beginn einer Epidemie gibt der Zusammenhang
das dynamische Geschehen wieder, also wie schnell sich diese ausbreitet. Die Verdopplungszeit ist eine intuitive Zahl, die Zeit, die für eine Verdoppelung der Fälle benötigt wird und erleichtert daher das Verständnis während der frühen Phasen einer Epidemie. Während der stabilen Phase oder während des Umkehrpunktes ist sie weniger hilfreich. In der abklingenden Phase spricht man besser von der Halbierungszeit: In Formeln ausgedrückt ist in der frühen Phase die Verdopplungszeit[10]
Um ein einfaches Beispiel zu geben, lag die Verdopplungszeit der Fälle von Covid-19 in Großbritannien in der schnellen Wachstumsphase der Epidemie im März 2020 vor dem „Lockdown“ in der Größenordnung von 3 bis 4 Tagen. Nimmt man einen Wert von 3,5 an, ergibt dies eine r-Schätzung von 0,2 neue Fälle pro Tag (die jeder Infizierte produziert). Einen nützlichen Vergleich für das Verständnis der Auswirkungen von Reproduktionszahl R und der Generationszeit neuer Infektionen liefern HIV, das in einigen Populationen einen R0 von etwa 2 hat, und Influenza, die einen R0 von etwa 1 hat. Der wichtigste Faktor ist die der Reproduktionszahl R, aber die Zeitskala von einer Infektion zur nächsten beträgt bei Influenza Tage, bei HIV jedoch Monate oder sogar Jahre.
Für weitere mathematische Hintergründe und Modelle siehe:
Generell möchte man mit epidemiologischen Methoden und Studien den Zusammenhang zwischen Exposition gegenüber Risikofaktoren und Erkrankung ermitteln. Ein Risikofaktor kann etwa Rauchen, fettes Essen oder auch ein bestimmtes soziales Umfeld sein, welches die Erkrankungswahrscheinlichkeit erhöht. Analog zum Risikofaktor spricht man vom „protektiven Faktor“, welcher sie verringert. Regelmäßige Bewegung und Obst sind z. B. protektive Faktoren für Herz-Kreislauferkrankungen, Stillen schützt Babys vor Infektionen. Zu den allgemein erhobenen Daten gehören neben Krankheitsstatus, Grunderkrankungen, Alter und Geschlecht oft das Rauchverhalten und der Bildungsstand. Man unterscheidet zwischen Beobachtungsstudien (Querschnittsstudie, Kohortenstudie, Fall-Kontrollstudie) und Interventionsstudien.
| Anzahl Erkrankter | Anzahl Gesunder | |
|---|---|---|
| Anzahl Exponierter | a | b |
| Anzahl Nicht-Exponierter | c | d |
Bei seltenen Erkrankungen entspricht das Chancenverhältnis dem Risikoverhältnis. Fall-Kontrollstudien sind grundsätzlich retrospektiv.
| Anzahl Erkrankter | Anzahl Gesunder | |
|---|---|---|
| exponiert | a | b |
| nicht exponiert | c | d |
Des Weiteren kann grundsätzlich zwischen folgende epidemiologische Studientypen unterschieden werden:[11][12][13][14]
Im Zusammenhang mit Krebsregistern spricht man auch von:
Die Endemie ist das normale, übliche Auftreten einer bestimmten Krankheit in einer bestimmten Population. So ist ein gewisser Anteil von Grippe-Erkrankungen in der Bevölkerung üblich. Wird eine bestimmte Grenze überschritten – bei Grippe etwa 10 % –, so spricht man von einer Epidemie. Aus der Definition der Endemie folgt also, dass die Epidemie das unüblich starke und zeitlich begrenzte Auftreten einer Krankheit ist.
Die Pandemie ist ebenso wie die Epidemie ein großer Ausbruch einer Krankheit über das zu erwartende Maß, jedoch ist die Epidemie immer noch auf bestimmte Gebiete beschränkt. Pandemien sind dagegen länder- und kontinentübergreifend. Ihrer Vorbeugung und ggf. Eindämmung dient seit 1999 die Pandemieplanung der Weltgesundheitsorganisation (WHO)[15] und darauf aufbauend idealerweise jeweils je Staat ein nationaler Pandemieplan (vergl. Nationaler Pandemieplan für Deutschland).
Man beachte, dass für die Einordnung von Erkrankungen als Endemie, Epidemie oder Pandemie ausschließlich die Auftretenshäufigkeit ausschlaggebend ist und nicht der Verlauf oder die Schwere der Erkrankungen.
Die Epidemiologie betrachtet auch das soziale, geografische und ökonomische Umfeld von Erkrankungen, während sich die Medizin meistens nur auf unmittelbare Faktoren wie etwa Viren und Körperverletzungen beschränkt. In der Epidemiologie ist die alleinige Feststellung nicht ausreichend, dass der Erreger HI-Virus die Krankheit AIDS auslöst. Epidemiologen untersuchen das weitere Umfeld, in welchem jeder Zustand weitere Faktoren beeinflusst.
Zum Beispiel:
Hippokrates (zitiert nach Galenos von Pergamon) schreibt: „Epidemisch nennt man eine zu derselben Zeit in derselben Gegend besonders häufige Krankheit. Das Gegentheil davon bilden die sporadischen Krankheiten.“[16] Diese alte Definition der Epidemie bildet den historischen Ausgangspunkt. Die Geschichte der Epidemiologie beginnt mit der Suche nach den Ursachen von Seuchenzügen. Der veraltete Begriff Loimologie für Infektionsepidemiologie bzw. Seuchenlehre weist deutlich auf diesen Zusammenhang.[17]
Während der Pestepidemie 1483/84 erwies sich Konrad Schwestermüller (um 1450–1520), der Leibarzt von Johann Cicero von Brandenburg, als hervorragender Epidemiologe, der auch vom Mecklenburger Hof (unter den Herzögen Magnus und Balthasar) als Berater während der Epidemie von 1490/92 hinzugezogen wurde. Er verfasste 1484 eine auch an die gesamte Bevölkerung gerichtete, noch im 17. Jahrhundert von der städtischen Seuchenprophylaxe in Berlin berücksichtigte Pestschrift[18] zur Vorbeugung und differenzierten Behandlung der Seuche.[19]
Im frühen 18. Jahrhundert führte Giovanni Maria Lancisi (1654–1720), der in Rom als Leibarzt des Papstes wirkte, den Rückgang von diversen Erkrankungen – darunter Malaria – auf verbesserte Hygiene und die Trockenlegung von Sümpfen zurück. Dieser Rückgang der Infektionskrankheiten infolge von Hygienemaßnahmen wird auch als erster Epidemiologischer Übergang bezeichnet.
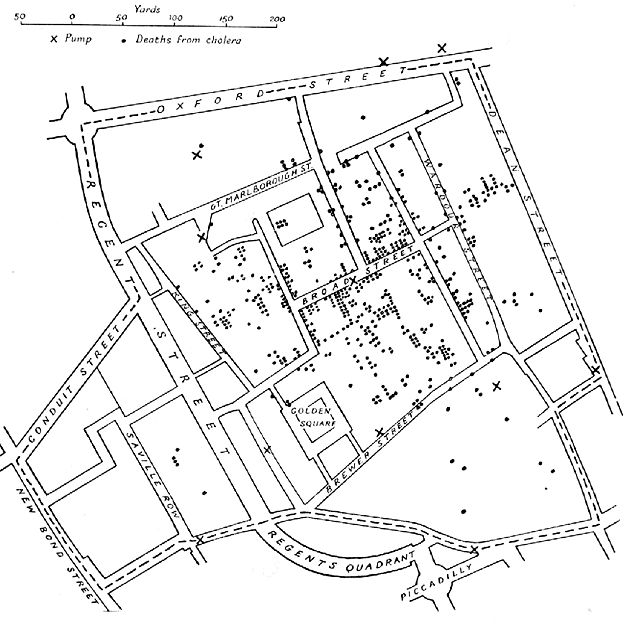
Der Beginn der modernen Epidemiologie wird auf die Mitte des 19. Jahrhunderts datiert: 1854 bekämpfte John Snow einen Cholera-Ausbruch im Londoner Soho-Bezirk erfolgreich, weil er aufgrund einer Kartierung der Erkrankungsfälle erkannte, dass eine öffentliche Wasserfassung die Infektionsquelle war. Er ließ den verschmutzten Brunnen sperren, die Zahl der Krankheitsfälle nahm danach signifikant ab.[20] Snows Erkenntnisse über die Ursache der Cholera, die er gemeinsam mit dem Arzt und Mikrobiologen Arthur Hill Hassall entwickelt hatte, wurden erst nach Snows Tod weit akzeptiert.[21] Maßgeblich beteiligt daran war unter anderem der britische Statistiker William Farr.

Zum Umfeld von William Farr gehörte auch Florence Nightingale (1820–1910), die als eine der Begründerinnen der westlichen Krankenpflege gilt.[22] Sie stellte während des Krimkrieges in Scutari, dem zentralen britischen Militärhospital während dieses Krieges in der Selimiye-Kaserne, einen rudimentären Krankenhausbetrieb sicher und fand dabei unter anderem heraus, dass die Mehrzahl der britischen Opfer des Krimkrieges nicht auf Verwundungen, sondern auf Infektionskrankheiten zurückzuführen war. Den Ruhm, den ihr ihr Krimkrieg-Einsatz einbrachte, nutzte sie, um auf zahlreiche britische Gesundheitsreformen Einfluss zu nehmen. Auf Grund einer Erkrankung, die sie sich während des Krimkrieges zugezogen hatte, war sie außerstande, sich gegebenenfalls selbst ein Bild von der Situation in einer Kaserne, einem Kranken- oder Armenhaus zu machen. Sie konzentrierte sich daher darauf, Daten zu sammeln, diese aufzubereiten und zu analysieren, um dann daraus Schlüsse zu ziehen. Ein wesentliches Arbeitsmittel waren für sie Fragebögen, daneben griff sie auf bereits vorhandene Daten zurück, wie die als Blaubücher bezeichneten offiziellen Regierungsberichte sowie Stellungnahmen britischer Behörden.[23] Sie belegte unter anderem gravierende Probleme bei der militärischen Gesundheitsfürsorge: Obwohl britische Soldaten normalerweise zwischen 20 und 35 Jahre alt waren und damit einer Altersgruppe mit geringer Sterblichkeitsrate angehörten, wiesen sie in Friedenszeiten eine fast doppelt so hohe Sterblichkeitsrate wie Zivilisten auf. In ihrem Bericht an die britische Regierung fand Nightingale dafür deutliche Worte. Wenn jährlich von 1000 Zivilisten 11 sterben würden, aber 17, 19 und 20 von 1000 Soldaten der in England stationierten Linieninfanterie, Artillerie und Garde, dann sei das ähnlich kriminell wie jährlich 1100 Mann auf die Salisbury Plain zu führen und dort zu erschießen.[24] Florence Nightingale gilt als eine der Pionierin der grafischen Datenaufbereitung solcher Daten.
Andere Pioniere waren der dänische Arzt Peter Anton Schleisner, der 1849 daran arbeitete, die Tetanus-neonatorum-Epidemie auf den Westmännerinseln durch vorbeugende Maßnahmen zu beenden, und der ungarische Arzt Ignaz Semmelweis, der 1847 als Ursache des oftmals tödlichen Kindbettfiebers die mangelnde Hygiene erkannte und durch Einführung konsequenter Hygienemaßnahmen zu bekämpfen versuchte. Die Erkenntnisse von Semmelweis wurden von der Fachwelt jedoch lange nicht akzeptiert, denn damals galt die Annahme, dass es krankmachende Kleinstlebewesen – nämlich Bakterien – gebe, als lächerlich.
Die ersten Mediziner, die die Vorgehensweise der Epidemiologie nicht nur auf Infektionskrankheiten, sondern auf Krebserkrankungen anwendeten, waren gegen Ende der 1870er Jahre Walther Hesse und Friedrich Härting.[25] Walther Hesse wurde 1877 zum Bezirksarzt des Kreises Schwarzenberg im Erzgebirge ernannt. In seinen Verantwortungsbereich fielen unter anderem 83 Dörfer, in denen vor allem Bergarbeiter lebten. Hesse war schockiert über ihren schlechten Gesundheitszustand und das geringe Lebensalter, das Bergleute typischerweise erreichten.[26] Bereits Paracelsus hatte 1567 für dieses Gebiet das Auftreten von Lungenkrankheiten beschrieben, die er als Bergsucht bezeichnete.[27] Die Ursache der Erkrankung war jedoch unbekannt. Gemeinsam mit dem Bergwerksarzt Härting begann Hesse, einzelne Krankheitsfälle zusammenzutragen, Bergleute zu interviewen, Umweltmessungen vorzunehmen und letztlich auch 20 Autopsien durchzuführen. Am Ende ihrer Untersuchung stand eindeutig fest, dass es unter den Bergleuten zu einer Häufung von Krebsfällen kam, deren Ursache in Zusammenhang mit ihrer Arbeit stand. Hesse und Härting vermuteten als Auslöser der sogenannten Schneeberger Krankheit Asbeststäube, erst spätere Wissenschaftler konnten nachweisen, dass Auslöser die aufgrund der besonderen Geologie des Ortes eng mit den BiCoNi-Erzen verwachsenen Uranerze waren. Die Arbeit, die Hesse und Härting in Schneeberg geleistet hatten, war beispielgebend für eine Reihe weiterer Wissenschaftler. Am bekanntesten darunter ist die Leistung von Ludwig Rehn, der 1895 nachweisen konnte, dass ein Zusammenhang zwischen der Arbeit in einer anilinverarbeitenden Industrie und dem Auftreten von Blasenkrebs bestand.[25]
Ein wichtiger Meilenstein in der Geschichte der Epidemiologie (und auch der Parasitologie) ist die 1880 während des Baus des Gotthard-Eisenbahntunnels erfolgte Entdeckung des Hakenwurms, Ancylostoma duodenale, als Ursache der damals so bezeichneten Sankt-Gotthard-Krankheit – einer parasitären Anämie. Auf der Grundlage der epidemiologischen Erkenntnisse wurden dann die Arbeitsbedingungen und die hygienischen Verhältnisse verbessert.
Die Desinfektion wurde in der Medizin erst dann breit angewandt, als der britische Chirurg Joseph Lister antiseptische Mittel entdeckte, basierend auf Arbeiten von Louis Pasteur.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.