Soli (hemijski spojevi)
From Wikipedia, the free encyclopedia
Remove ads
Pojmom soli označavaju se hemijski spojevi, koji su građeni iz pozitivno (kation) i negativno naelektrisanih iona (anion).[1] Između tih iona stvaraju se ionske veze.[2] Kod neorganskih soli kationi se najčešće grade od metala, dok se anioni grade od nemetala ili njihovih oksida. Kao čvrsta supstanca, oni zajedno grade ionsku rešetku. Pojam organskih soli označava sve spojeve kod kojih je najmanje jedan anion ili kation neki organski spoj.


Remove ads
Neorganske soli
U najužem smislu, pod pojmom so misli se na natrij-hlorid (NaCl, odnosno kuhinjska so). U mnogo širem smislu, soli su svi oni spojevi, koji su poput NaCl načinjeni od aniona i kationa. Kao primjer takvih soli je kalcij-hlorid (CaCl2). Natrij-hlorid sastavljen je iz kationa Na+ i aniona Cl−. Slično tome, kalcij-hlorid se izgrađen iz iona Ca2+ i Cl− Formule NaCl i CaCl2 su sadržajne (sumarne) formule spojeva (omjer Na:Cl=1:1, odnosno Ca:Cl=1:2). Ioni mogu biti jednovalentni ili polivalentni, tj. nositi jedno ili više pozitivnih odnosno negativnih naelektrisanja. Sumarna formula neke soli određena je brojem naelektrisanja iona, jer se pozitivna i negativna naelektrisanja moraju međusobno kompenzirati (poništiti). Sumarne formule soli su u jasnoj suprotnosti s formulama spojeva poput vode (H2O) ili metana (CH4), koji su molekularni spojevi.
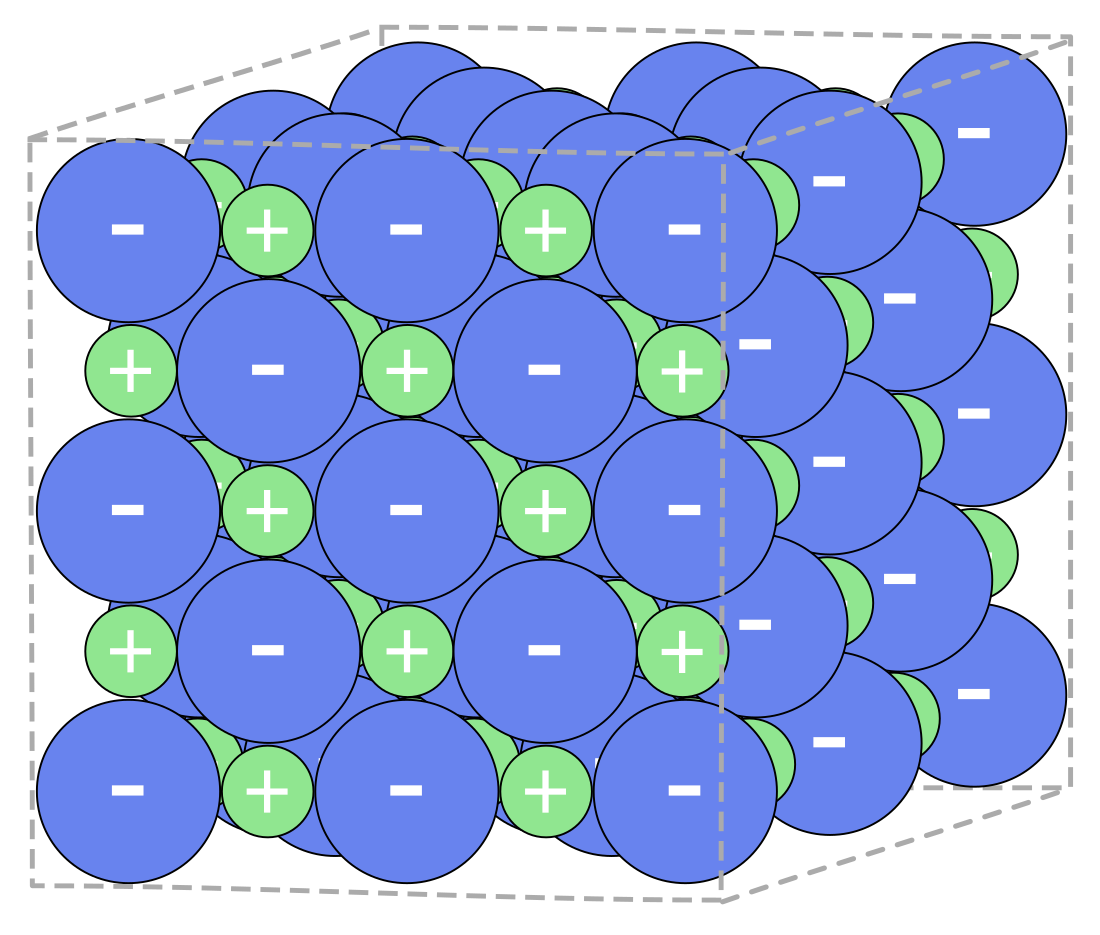
Kod neorganskih soli između iona djeluju ionske veze. Slijedeći omjer sumarne formule, veliki broj iona gradi ionsku rešetku određene kristalne strukture. Prva slika desno prikazuje mali isječak građe kristalne rešetke natrij-hlorida. Pošto postoji veliki broj različitih kationa i aniona, poznato je i veoma veliki broj različitih soli. U donjoj tabeli prikazani su neki od iona. U solima, ioni se mogu sastojati i iz više od jednog atoma. Takvi ioni se nazivaju kompleksi ioni. Primjeri kompleksnih aniona su nitratni (NO3−) i sulfatni anion (SO42−). Kod takvih kompleksa, jedan atom predstavlja centralni, na koji su spojevi drugi atomi (i atomske grupe), jednim imenom nazvani ligandi. U ovim primjerima, atomi N odnosno S su centralni atomi, dok su u oba slučaja ligandi atomi kisika (oksokompleksi). Centralni atomi i njihovi ligandi su povezani jedan s drugim kovalentnom vezom. Ionske veze nalaze se samo između aniona i kationa. Među nitratima poznate soli su, naprimjer, natrij-nitrat (NaNO3), a među sulfatima natrij-sulfat (Na2SO4).
Katione uglavnom grade metali a njihove soli nazivaju se soli metala ("metalne soli"). Od nemetala sastoji se kompleksni kation amonij (NH4+) sa dušikom kao centralnim ionim i vodikom kao ligandom. Amonij ioni grade so poput amonij-sulfata ((NH4)2SO4). Pored amonijevih spojeva, postoje i njihovi analogi organski spojevi (kvartarni amonijevi spojevi).
Kod viševalentnih oksokompleksa mogu se javiti i OH-grupe kao ligandi, kao što je npr. kod soli natrij-hidrogensulfata (NaHSO4). Analoge soli su poznate i među fosfatima: pored natrij-fosfata postoje i soli dinatrij-hidrogenfosfat i natrij-dihidrogenfosfat. Iz uobičajenog formalnog načina pisanja (formulskih jedinica) za ove spojeve ne mogu se odmah prepoznati OH-grupe kao ligandi. Formulske jedinice takvih soli se izvode iz tradicionalnog načina pisanja za kiseline poput sumporne (H2SO4) i fosfatne kiseline (H3PO4).

Prelazni metali ne grade samo katione, nego i anione u vidu oksokompleksa. Tako naprimjer hrom može graditi hromate ([CrO4]2−), koji je anion u kalij-hromatu K2[CrO4]), a mangan permanganate ([MnO4]−), koji je anion u kalij-permanganatu (K[MnO4]).
Kompleksni anioni mogu imati i metale kao centralni atom. Kod kalijheksacijanoferata(II) (K4[Fe(CN)6]), ion željeza Fe2+ gradi stabilni anion sa četiri negativna naboja zajedno sa šest cijanidnih grupa (CN−). U solima, ionske veze se nalaze između kationa kalija i aniona heksacijanoferata(II). Slično tome, ion željeza Fe3+ gradi kalijheksacijanoferat(III) (K3[Fe(CN)6]), također jednu kompleksnu so. Kod K3[Fe(CN)6], ion željeza Fe3+ gradi stabilni anion sa tri negativna naboja zajedno sa šest cijanidnih grupa (CN−).
Primjeri kationa i aniona
|
| |||||||||||||||||||||||||||||||||||||||
Osobine soli

- Mnoge soli su na sobnoj temperaturi u čvrstom stanju sa relativno visokom tačkom topljenja. Nagrizajuće soli su vrlo tvrde i krte te imaju glatke ivice pri lomu tokom mehaničke obrade. Ove osobine su uglavnom tipične za čvrste supstance, koje su izgrađene u vidu ionske rešetke te stoga grade kristale. Međutim, svaka kristalna supstance nije ujedno i so. Tako naprimjer šećer (saharoza) također gradi kristale, ali nema ionsku rešetku i ne ubraja se u soli.
- Brojne soli su rastvorljive u vodi a nisu rastvorljive u većini organskih otapala. Kod soli rastvorljivih u vodi, voda prevazilazi energiju ionske rešetke pomoću hidratacije. Ako je energija hidratacije približno velika ili veća od energije rešetke, so je relativno dobro ili vrlo dobro rastvorljiva. U rastvorima su pojedinačni ioni vrlo čvrsto i intenzivno okruženi molekulama vode. U vidu reakcije, ovo se u hemiji predstavlja na sljedeći način:
Slovo (s) označava čvrstu supstancu dok (aq) označava, da se ion nalazi u hidratiziranom stanju. - Suhi kristali soli su električni izolatori. Istopljene soli i vodene otopine provode električnu struju zbog svojih slobodno pokretnih iona kao nosilaca električnog naboja. Stoga su oni elektroliti.
- Rastvaranje soli u vodi može promijeniti pH vrijednost tog rastvora. Ako se rastvaranjem određene soli ne promijeni ta vrijednost, onda se kaže da je ta so neutralna. Među neutralne soli se ubraja i natrij-hlorid. Osim ovih, postoje i bazične i kisele soli. Iz sastava soli vrlo teško se može procijeniti kako će određena so reagirati. Međutim, vrijedi opće pravilo: anioni (kiselinski ostaci) jakih kiselina uglavnom reagiraju neutralno. Kiselinski ostaci slabih kiselina uglavnom reagiraju bazično. Primjer osobina soli, nastalih od višeprotonskih kiselina, jeste ponašanje fosfata. Rastvaranje soli u vodenim otopinama organskih molekula, kao npr. biomolekula, može dovesti do denaturiziranja tih biomolekula ali i djelovati na taloženje makromolekula. Ovakvo djelovanje soli karakterizirano je takozvanom Hofmeisterovom serijom.
Drugi kationi i anioni
- Metalni oksidi u velikom postotku čine Zemljinu koru, ali se oni mogu posmatrati i kao soli. Anion O2− (oksidni ion) se javlja kao takav samo u čvrstom ili istopljenom stanju, dok u vodenim rastvorima on nije poznat. Kisik u oksidnom ionu ima oksidacijski broj −2. Stoga, oksidacijski broj metala određuje sumarnu formulu određene soli odnosno spoja: MI2O, MIIO, MIII2O3. Ako je oksid rastvorljiv u vodi, dešava se specifična hemijska reakcija, naprimjer:
Natrij-oksid reagira s vodom dajući hidroksidne ione i sodu (ione natrija).
Slično reagira i kalcij-oksid (CaO), poznat i kao živi kreč, dajući ugašeni kreč odnosno kalcij-hidroksid (Ca(OH)2). Međutim, postoji veliki broj oksida koji ne reagiraju s vodom. Naprimjer, spoj željezo(III)-oksid (Fe2O3) nije rastvorljiv u vodi.
- Sulfidi: minerali se u prirodi često mogu naći u obliku sulfida (S2−), naprimjer pirit i halkozin. I sulfidi se mogu smatrati solima. Natrij-sulfid (Na2S) je rastvorljiva so, koja je u vodi gotovo nerastvorljiva, slično kao i većina sulfida poput cink-sulfida (ZnS) i bakar(II) sulfida (CuS). U analitičkoj hemiji se različita (slaba) rastvorljivost raznih metalnih sulfida koristi za razdvajanje sličnih hemijskih elemenata (u fazi razdvajanja sumporovodične funkcionalne grupe)
Kristalna voda
Mnoge soli, pored iona, sadržavaju i određene količine molekula vode, takozvanu kristalnu vodu.[3] Ona se obično navodi u sumarnoj formuli, kao naprimjer u natrij-sulfat dekahidratu: Na2SO4 · 10 H2O.
Dvostruke soli
Pored soli sa samo jednom vrstom kationa (M) poznate su i soli sa dva različita kationa. Takve soli nazivaju se dvostruke soli, kao što su alauni sa općenitom sumarnom formulom MIMIII(SO4)2. Primjer takve soli je aluminijkalijsulfat-dodekahidrat (KAl(SO4)2 · 12 H2O).
Obuhvat pojma soli
- Supstance su soli, samo ako su hemijske veze između njihovih dijelova ionske. Da je zaista u nekom spoju prisutna ova vrsta veze, nije lahko zaključiti. Dok je kod kalcij-oksida (CaO) prisutna ionska veza, dok hrom(IV) oksida (CrO3) radi se o kovalentnoj vezi između atoma hroma i kisika, pa ovaj spoj nije so. U ovakvim slučajevima je zbog toga bolje govoriti o metalnim oksidima umjesto solima.
- Historijski, soli su po pravilu obuhvatali hemijske spojeve, koji imaju definirani sastav od različitih hemijskih elemenata. Međutim, poznati su i miješani kristali sastavljeni iz dvije soli, a koji nisu stehiometrijski građeni: tako naprimjer kalij-permanganat (K[MnO4]) sa barij-sulfatom sačinjava miješane kristale u gotovo proizvoljnim odnosima smjese (čak i kada se stavi i određena najveća količina barij-sulfata), tako da komponente u miješanim kristalima i dalje zadržavaju slične kristalne strukture i udaljenosti unutar mreže. Za dobijanje miješanih kristala nije neophodna hemijska sličnost uključenih spojeva niti njihova identična valencija.
Remove ads
Organske soli
Osim gore opisanih neorganskih soli, također postoje i brojne soli organskih spojeva. Anioni ovih soli nastali su od organskih kiselina. Među ostalim, jedne od važnijih su soli karboksilnih kiselina, kao što je acetatna kiselina od koje nastaju brojne soli, poznati kao acetati (CH3COO−). Tako naprimjer acetatna kiselina sa Na+ daje so natrij-acetat dok sa Cu2+ gradi bakar-acetat. Sirćetna kiselina je monougljična kiselina (ima samo jednu -COOH grupu) pa daje samo jednovalentne anione. Limunska kiselina (citratna kiselina) je trougljična kiselina (ima tri -COOH grupe) i može davati trovalentne anione; njene soli nazivaju se citrati. Među poznatijim solima citratima su natrij-citrat i kalcij-citrat. Mnogi acetati i citrati grade kristale, ali to nije pravi razlog za njihovo uvrštavanje u soli. Jedini pravi razlog i osnova leži u postojanju ionskih veza između aniona i kationa. Unutar iona organskih spojeva nalaze se kovalentne veze.
Praktični značaj imaju soli karboksilnih kiselina, koje se ubrajaju u masne kiseline. Natrijeve i kalijeve soli masnih kiselina nazivaju se sapuni. U komercijalnim sapunima nalazi se mješavina različitih soli masnih kiselina. Praktičan značaj imaju pri proizvodnji raznih tvrdih (natrijevih) i mehkih (kalijevih) sapuna. Konkretni primjer čine soli palmitinske kiseline koji se nazivaju palmitati. Soli, koji se zasnivaju na tako velikim organskim molekulama, po pravilu nisu kristalizirane.
Analogno neorganskim sulfatima (SO42−) postoje i organski sulfati (R-O-SO3−), poput natrij-laurilsulfata, koji su svoju upotrebnu vrijednost pronašli kao tenzidi u komercijalnim šamponima i gelovima za tuširanje. Poznati su čak i soli alkohola koji se nazivaju alkoholati.[4] Alkoholi su izrazito slabe kiseline, ali se gotovo nikad ne nazivaju tako. Pod agresivnim uslovima reakcije mogu se dobiti spojevi oblika R-O−M+ (gdje je M = metal). Po analogiji sa brojnim neorganskim oksidima (MO) alkoholati reagiraju pri kontaktu s vodom (hidroliza) dajući odgovarajuće alkohole.
Među organskim kationima, spojevi analogni amonij-kationima (NH4+) imaju veliki značaj. Općenito se nazivaju kvartarni amonijski spojevi. Kod ovih spojeva, atom dušika obično nosi četiri alkil grupe (R-) i pozitivno naelektrisanje. Alkilamonijski spoj cetiltrimetilamonijbromid, naprimjer, je organski spoj amonija, kod kojeg se atom broma nalazi kao anion. Praktični značaj imaju spojevi amonija sa tri kratke i jednom dugom alkil grupom, jer takvi kationi u vodenim rastvorima pokazuju osobine tenzida. Spojevi ove vrste također igraju veoma važnu ulogu u metabolizmu živih bića, kao što je npr. holin.
U principu, gotovo svaki organski amin putem primanja jednog protona (H+) može preći u kation. Slično kao i reakcija sa amonijakom (NH3) koji prelazi u amonij ion (NH4+), reagira naprimjer i primarni amin (R-NH2; gdje je R = organski ostatak) prelazeći u kation R-NH3+. Pošto su takvi spojevi uglavnom polarni i zbog toga lahko rastvorljivi u vodi, oni su i početne supstance koje prevode neke lijekove na bazi dušika putem njihovog razlaganja sa hlorovodičnom kiselinom u soli, takozvane hidrohloride. Ovaj postupak olakšava njihovu apsorpciju u organizmu. Nasuprot amina, hidrohloridi se mogu mnogo lakše čistiti pomoći prekristalizacije. Sa bromovodikom amini grade hidrobromide a sa fluorovodikom hidrofluoride. Osim molekula, koji mogu nositi neko pozitivno ili negativno naelektrisanje, postoje također i molekule, koje posjeduju negativno i pozitivno naelektrisanje. One se nazivaju unutrašnje soli ili cviterioni. Grupa spojeva betaina se ubraja u takve soli, među kojima je najjednostavniji spoj betain.
Aminokiseline posjeduju jednu karboksilnu (-COOH) i jedno amino grupu (-NH2) pa zbog toga mogu reagirati i kiselo i bazno. Pri unutrašnjoj neutralizaciji stvaraju se anionske (-COO−) i kationske (-NH3+) odnosno jedan cviterion. Jedna od najjednostavnijih aminokiselina je glicin, koji je vrlo dobro rastvorljiv u vodi. Nasuprot drugih iona koji su dobro rastvorljivi u vodi, cviterioni pokazuju vrlo slabu (gotovo nikakvu) električnu provodljivost (amfoliti).
Primjeri organskih kationa i aniona
Remove ads
Dobijanje neorganskih soli
Reakcije kiselina i baza
Soli nastaju pri reakciji kiselina sa bazama (grč. basis; prema Arrheniusu: baze su osnovice ("baze") za soli). Pri tome se stvaraju oksonij-ioni kiselina koji sa ionima hidroksida iz baza daju vodu (neutraliziraju se). Neke soli su vrlo teško rastvorljive u vodi te odmah pri nastanku stvaraju čvrsti talog. Obično se soli nalaze otopljene u rastvoru te se kristaliziraju (prelaze u čvrsto stanje) isparavanjem vode.
Iz drugih soli
Neke soli se mogu dobiti iz druge dvije soli. Ako se pomiješaju vodeni rastvori dviju soli, iz rastvora se može izdvojiti treća so u čvrstom obliku. Ovo vrijedi samo ako je treća so, nasuprot druge dvije, mnogo teže rastvorljiva.
Reakcije oksida
Kako je gore opisano, mnogi oksidi metala imaju afinitet da sa vodom grade hidrokside. U kiselim uslovima, također reagiraju i mnogi oksidi metala, a koji su u čistoj vodi nerastvorljivi (stabilni). Na ovaj način mogu se dobiti mnoge soli, kao što je naprimjer bakar-sulfat.
Druge reakcije
Oni ioni koji ne nastaju u gore opisanim reakcijama, postoje već i prije nastanka nekih novih soli. Ako se pri reakcijama dobijanja neke novi soli ne nalaze nikako ioni sa potrebnom valencijom ili se ne nalaze svi potrebni, onda se odvijaju redoks reakcije. Tako se naprimjer iz elementarnih metala i nemetale dobijaju soli.
Remove ads
Reference
Literatura
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


 ,
,  ...
...









 ,
,  ...
... ,
,  ...
... ...
...