Proteinogena aminokiselina
From Wikipedia, the free encyclopedia
Remove ads
Remove ads
Proteinogene aminokiseline su aminokiseline koje su prekursori proteina i koje su u proteine uklučene kontranslacijski – to jest, za vrijeme prevođenja genetičkog koda.[1][2] Kod prokariota postoje 22 proteinogene aminokiseline, ali je kod eukariota samo 21 kodirana iz jedarnih gena.

Od 22, pirolizin (O/Pyl) je uključen u proteine različitih posttranslacijskih modifikacija biosintetičkih mehanizama; preostala 21 su direktno kodirane izvornim genetičkim kodom, uključujući i selenocistein (U/Sek), koji koristi poseban oblik ubacivanja u translacijskoj inkorporaciji, ali to se ne smatra posttranslacijskom modifikacijom. Od svih preostalih (20), ljudi mogu sintetizirati 11, koje nastaju od drugih ili iz drugih molekula, posrednika metabolizma. Ostalih devet mora biti konzumirano (obično kao njihovi derivati u proteinima), pa se nazivaju esencijalne aminokiseline. Esencijalne aminokiseline su histidin, izoleucin, leucin, lizin, metionin, fenilalanin, treonin, triptofan i valin (tj. skraćeno: H I L K M F T).
Riječ "proteinogene" znači "protein gradeće". Proteinogene aminokiseline mogu se kondenzirati u polipeptid (podjedinice proteina) u procesu koji se zove translacija (druga faza biosinteze proteina, dio ukupnog procesa ekspresije gena).[3][4][5][6]
Nasuprot tome, neonproteinogene amino kiseline ili nisu uključene u proteine (poput GABA, L-DOPA, ili trijodtironina) ili se ne proizvode izravno u izolaciji i standardnim ćelijskim procesima (poput hidroksiprolina i selenometionina). Potonji često nastaje iz posttranslacijske modofikacije proteina. Za proteinogene aminokiseline je tvrđeno je da su se u vezi sa aminokiselinama koje se mogu prepoznati po ribozimima autoaminoacilacijskog sistema. Stoga, nonproteinogene aminokiseline bi bili isključeni iz kontingenta evolucijski uspješnih nukleotida, na bazi postojećih oblika života. Drugi razlozi koji mogu objasniti zašto neke specifične nonproteinogene aminokiseline nisu generalno uključene u proteine su naprimjer, za ornitin i homoserin da cikliziraju protiv okosnice peptida i fragmentiranja proteina s relativno kratkim poluraspadom, a drugi su otrovni jer oni mogu biti pogrešno ugrađeni u proteine, kao što je argininu analogni kanavanin.
Neproteinogene aminokiseline su uključene u neribosomni peptidi, koji se ne proizvode u ribozomima tokom translacije.
Remove ads
Struktura
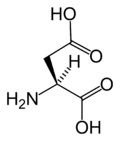
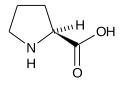
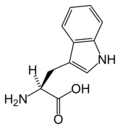
Slijede ilustruje struktura i skraćenice 21 aminokiseline koje su direktno kodirane za sintezu proteina u genetičkom kodu eukariota. Strukture koje su date u nastavku su standardne hemijske strukture, a ne tipični bipolni oblici koji postoje u vodenim otopinama.

IUPAC/IUBMB sada također preporučuju standardne skraćenice za slijedeće dvije aminokiseline:
Remove ads
Nespecifične skraćenice
Ponekad se specifičnost identiteta aminokiseline ne može odrediti jednoznačno. Određene tehnike proteinskog sekvenciranja ne prave razliku među pojedinim parovima. Zato se koriste ovi kodovi:
- Asx (B) je "asparagin ili asparaginska kiselina"
- Glx (Z) je "glutaminska kiselina ili glutamin"
- Xle (J) je "leucin ili izoleucin"
Dodatno, simbol X je upotrebljen za oznaku aminokiseline koja je kompletno neidentificirana.
Remove ads
Hemijske osobenosti
U nastavku je tabela sa jednoslovnim i troslovnim simbolima i hemijskim svojstvima bočnih lanaca standardnih aminokiselina. Navedene mase su bazirane na ponderiranom prosjeku elementarnih izotopa njihovie prirodne abundancije. Formiranje peptidne veze rezultira u eliminaciji molekula vode, tako da je jedinice mase aminokiselina u proteinskim lancima smanjena za 18,01524 Da.
Opće hemijske osobenosti
Osobenosti bočnog lanca
Napomena: pKa vrijednosti aminokiselina su obično malo drugačije kada su unutar proteina. U ovoj situaciji, proteinski pKa proračuni se ponekad koriste za izračunavanje promjena u pKa vrijednosti aminokiselina.
Genska ekspresija i biohemija
* UAG je normalno amber stop kodon, ali i kodiranje pirrolizina ako je prisutan PYLIS element].
** UGA je normalno opal (ili amber) stop kodon, ali kodira i selenocistein, je prisutan SECIS element.
†Stop kodon nije aminokiselina, ali je uključen za kompletiranje šifre.
†† UAG i UGA ne djeluju uvijek kao stop kodoni (vidi gore).
‡ Esencijalna aminokiselina se ne miže sintetizirati kod ljudi, pa se mora konzumirati. Uvjetne esencijalne aminokisaeline se obično ne zahtijevaju u ishrani, ali moraju biti egzogeno dodvane u specifičnim skpinama koje ne sintetiziraju u dovoljne količine.
Masena spektofotometrija
U masenoj spektrofotometriji peptida i proteina, korisno je poznavanje mase ostataka . Masa peptida ili proteina je zbir mase ostatka plus masa vode.[7]
Stehiometrija i metabolička potrošnja u ćeliji
Naredna tabela navodi obilje aminokiselina u ćeliji Escherichia coli i metabolički utrošak ATP za sintezu aminokiselina. Negativni brojevi ukazuju na metaboličke procese koji su energetski povoljni i ne troše neto ATP ćelije. Skup raspoloživih aminokiselina sadrži one u obliku i u polimeriziranom obliku (proteini).
Napomene
Katabolizam

- Glucogene, sa produktima koji imaju sposobnost formiranja glukoze putem glukogeneze.
- Ketogene, sa produktima koji nemaju sposobnost formiranja glukoze: ovi produkti se mogu upotrebiti za ketogenezu ili sintezu lipida.
- Aminokiseline katabolizirane i glukogenim i and ketogenim produktima.
Remove ads
Život na bazi alternativnih proteinogenih garnitura
Prema dosadašnjim saznanjima, čini se da su proteinogene garniture koje koriste poznati oblici života na Zemlji, proizvoljno odabrane evolucijom , od više stotina mogućih alfa-tipova aminokiselina. Ksenobiološke studije hipotetskih oblika života koji bi mogli biti izgrađeni korištenjem alternativnih skupova proširivanjem genetičkoih kodova. Stanley Millerov tip eksperimenta na umjetnom samozačeću pokazuje da alfa-tipovi aminokiselina dominiraju u osnovnoj vodi 'primordijalne supe', ali beta-tip aminokiselina dominira kada je prisutno manje vode. Oba, i alfa- i beta-bazirani setovi mogli su biti osnova za alternativne konstrukcije proteina i oblike života.
Remove ads
Također pogledajte
Reference
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads