Genotoksičnost
From Wikipedia, the free encyclopedia
Remove ads
U genetici, genotoksičnost opisuje svojstvo hemijskih agenasa koji oštećuju genetičke informacije unutar ćelije uzrokujući mutacije, što može dovesti do kancera. Dok se genotoksičnost često miješa sa mutagenosti, svi mutageni su genotoksični, dok nisu sve genotoksične tvari mutagene. Promjena može imati direktne ili indirektne efekte na DNK: indukciju mutacija, aktivaciju pogrešnog događaja i direktno oštećenje DNK koje dovodi do mutacija. Trajne, nasljedne promjene mogu uticati ili na somatske ćelije organizma ili germinativne ćelije da se prenesu na buduće generacije.[1] Ćelije sprečavaju ekspresiju genotoksične mutacije bilo popravkom DNK ili apoptozom; međutim, oštećenje se ne može uvijek popraviti što dovodi do mutageneze.
Za esej genotoksičnih molekula, iispituje se oštećenje DNK u ćelijama izloženim toksičnim supstratima. Ovo oštećenje DNK može biti u obliku jedno- i dvolančanih prekida, gubitka ekscizijskog popravka, umrežavanja, alkalno labilnih mjesta, tačkastih mutacija i strukturnih i numeričkih hromosomskih aberacija.[2] Poznato je da narušeni integritet genetičkog materijala uzrokuje rak. Kao posljedica toga, razvijene su mnoge sofisticirane tehnike, uključujući Amesov test, in vitro i in vivo genotoksikološke testove i Komet esej, kako bi se procijenio potencijal hemikalija da izazovu oštećenje DNK koje može dovesti do raka.
Remove ads
Mehanizam

Genotoksične supstance indukuju oštećenje genetičkog materijala u ćelijama, interakcijom sa sekvencom i strukturom DNK. Naprimjer, prelazni metal hrom stupa u interakciju sa DNK u njenom visokovalentnom oksidacionom stanju tako da izazovu lezije DNK koje dovode do karcinogeneze. Metastabilno oksidaciono stanje Cr(V) postiže se reduktivnom aktivacijom. Istraživanja su uključila eksperiment za proučavanje interakcije između DNK i kancerogenog hroma koristeći Cr(V)-Salenov kompleks u specifičnom oksidacionom stanju.[3] Interakcija je bila specifična za guaninski nukleotid u genetičkoj sekvenci. Kako bi suzili interakciju između Cr(V)-Salen kompleksa i guaninske baze, modifikovane su baze u 8-okso-G, kako bi imali specifičnu oksidaciju. Reakcija između dvije molekule izazvala je DNK lezije; dvije lezije uočene na modificiranom baznom mjestu bile su guanidinohidantoin i spiroiminodihidantoin. Da bi se dalje analiziralo mjesto lezije, uočeno je da se polimeraza zaustavila na tom mjestu i da je adenin neprikladno ugrađen u sekvencu DNK suprotno od 8-okso-G baze. Stoga, ove lezije pretežno sadrže transverzije G → T. Smatra se da visokovalentni hrom djeluje kao kancerogen jer je otkriveno da su "mehanizam oštećenja i proizvodi oksidacije baza za interakciju između visokovalentnog hroma i DNK... relevantni za in vivo formiranje oštećenja DNK, što dovodi do raka kod ljudi izloženih hromatu".[3] Posljedično, pokazuje kako visokovalentni hrom može djelovati kao kancerogen sa 8-okso-G formiranjem ksenobiotika.[3]
Drugi primjer genotoksične supstance koja uzrokuje oštećenje DNK su pirolizidinski alkaloidi (PA). Ove tvari se uglavnom nalaze u biljnim vrstama i otrovne su za životinje, uključujući ljude; otprilike polovina njih je identificirana kao genotoksične, a mnogi i kao tumorigeni. Zaključeno je da, kada se metabolički aktiviraju, PA proizvode DNK adukte, umrežavanje DNK, prekide DNK, razmjenu sestrinskih hromatida, mikronukleuse, hromosomske i genske mutacije i mutacije hromosoma i in vivo i in vitro.[4] Najčešća mutacija unutar gena su transverzije G:C → T:A i tandemske bazne supstitucije. Pirolizidinski alkaloidi su mutageni in vivo i in vitro i stoga su odgovorni za kancerogenezu u jetri.[4] Gavez je primjer biljne vrste koje sadrže četrnaest različitih PA. Aktivni metaboliti u interakciji s DNK uzrokuju oštećenje DNK, indukciju mutacija i razvoj raka u jetrenim endotelnim ćelijama i hepatocitima. Na kraju, otkriveno je da je "gavez mutagen u jetri, a čini se da je PA sadržan u gavezu odgovoran za toksičnost uzrokovanu gavezom i indukciju tumora".[5]
Remove ads
Tehnike testiranja
Svrha ispitivanja genotoksičnosti je utvrditi hoće li supstrat utjecati na genetski materijal ili može uzrokovati rak. Mogu se izvoditi u ćelijama bakterija, kvasca i sisara.[2] Sa znanjem iz testova može se kontrolisati rani razvoj organizama osjetljivih na genotoksične tvari.[1]
Test bakterijske reverzne mutacije
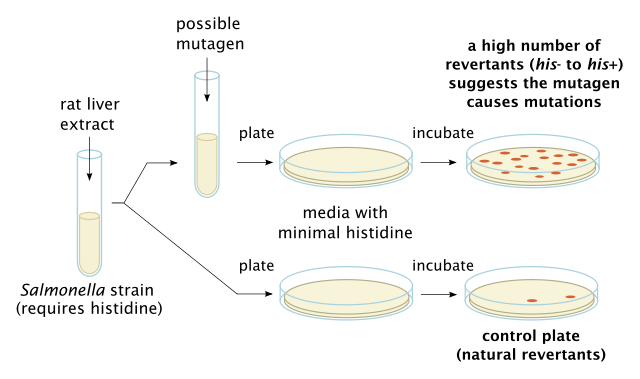
Bakterijski test reverzne mutacije, takođe poznat kao Amesov test, koristi se u laboratorijama za testiranje genskih mutacija. Tehnika koristi mnogo različitih bakterijskih sojeva, kako bi se uporedile različite promjene u genetičkom materijalu. Rezultat testa otkriva većinu genotoksičnih karcinogena i genetičkih promjena; tipovi otkrivenih mutacija su pomaci okvira i bazne supstitucije.[6]
Remove ads
Toksikološko ispitivanje in vitro
Svrha in vitro testiranja je da se utvrdi da li supstrat, proizvod ili faktor okoline izaziva genetičko oštećenje. Jedna tehnika uključuje citogenetičke testove koristeći različite ćelije sisara.[6] Tipovi aberacija otkriveni u ćelijama na koje utiče genotoksična supstanca su hromatidne i hromosomski praznine, lomovi hromosoma, hromatidnw delecije, fragmentacija, translokacija, složena preuređivanja i još mnogo toga. Klastogeni ili aneugeni efekti od genotoksičnog oštećenja će uzrokovati povećanje učestalosti strukturnih ili numeričkih aberacija genetičkog materijala.[6] Ovo je slično mikronukleus testu i testu hromosomskih aberacija, koji otkrivaju strukturne i numeričke hromosomske aberacije u ćelijama sisara.[7]
U specifičnom tkivu sisara, može se izvršiti test limfoma TK+/– na mišu da se testiraju promjene u genetičkom materijalu.[6] Genske mutacije su obično tačkaste, koje mijenjaju samo jednu baza unutar genetićke sekvence za promjenu transkripta i sekvence aminokiselina; ove mutacije uključuju zamjene baza, delecije, pomake okvira i preuređenje. Također, integritet hromosoma može biti promenjen njegovim gubitkom i klastogenim lezijama koje izazivaju višestruke delecije gena i multilokusa. Specifični tip oštećenja određen je veličinom kolonija, praveći razliku između genskih mutacija (mutagena) i hromosomskih aberacija (klastogena).[6]
SOS/umu test test procenjuje sposobnost supstance da izazove oštećenje DNK; temelji se na promjenama u indukciji SOS odgovora zbog oštećenja DNK. Prednosti ove tehnike su što je brz i jednostavan metod i pogodan za brojne supstance. Ove tehnike se izvode na vodi i otpadnim vodama u okolišu.[8]

Testiranje in vivo
Svrha testiranja in vivo je da se utvrdi potencijalna oštećenja DNK koja mogu uticati na hromosomsku strukturu ili poremetiti mitotski aparat koji menja broj hromosoma; faktori koji mogu uticati na genotoksičnost su ADME i popravak DNK. Također može otkriti genotoksične agense propuštene u testovima in vitro. Pozitivan rezultat induciranog hromosomskog oštećenja je povećanje učestalosti [mikronukleus|[mikronukeliranih]] PCE.[6] A mikronukleus je mala struktura odvojena od jedra koja sadrži jedarnu DNK nastala iz DNK fragmenata ili cijelih hromosoma koji nisu bili ugrađeni u ćeliju ćerku tokom mitoze. Uzroci ove strukture su mitotski gubitak acentričnih hromosomskih fragmenata (klastogenost), mehanički problemi zbog lomljenja i izmjene hromosoma, mitotski gubitak hromosoma (aneugenost) i apoptoza. Mikronukleus test in vivo sličan je onom in vitro jer se njime testiraju strukturne i numeričke hromosomske aberacije u ćelijama sisara, posebno u krvnim ćelijama pacova.
Komet test
Komet testovi su jedan od najčešćih testova genotoksičnosti. Tehnika uključuje lizu ćelija pomoću deterdženata i soli. Oslobođena DNK iz lizirane ćelije se elektroforezuje u agaroznom gelu pod neutralnim pH uslovima. Ćelije koje sadrže DNK sa povećanim brojem dvolančanih prekida brže će migrirati na anodu. Ova tehnika ima prednost po tome što detektuje niske nivoe oštećenja DNK, zahtijeva samo veoma mali broj ćelija, jeftinija je od mnogih tehnika, lahka je za izvođenje i brzo prikazuje rezultate. Međutim, ne identifikuje mehanizam koji leži u osnovi genotoksičnog efekta ili tačnu hemijsku ili hemijsku komponentu koja uzrokuje lomove.[9]
Remove ads
Kancer
Genotoksični efekti kao što su delecije, lomovi i/ili preuređivanje mogu dovesti do raka ako oštećenje ne dovede odmah do ćelijske smrti. Regije osjetljive na lomove, koje se nazivaju lomljiva mjesta, mogu biti rezultat genotoksičnih agenasa (kao što su pesticidi). Neke hemikalije imaju sposobnost da izazovu lomljiva mesta u dijelovima hromosoma gdje su prisutni onkogeni, što može dovesti do kancerogenih efekata. U skladu s ovim nalazom, profesionalna izloženost nekim mješavinama pesticida je u pozitivnoj korelaciji s povećanim genotoksičnim oštećenjima kod izloženih osoba. Oštećenje DNK nije ujednačeno po svojoj ozbiljnosti među populacijama jer se izloženi razlikuju u svojoj sposobnosti da aktiviraju ili detoksikuju genotoksične supstance, što dovodi do varijabilnosti u učestalosti raka među osobama. Razlika u sposobnosti detoksikacije određenih spojeva je posljedica naslijeđenih polimorfizama gena uključenih u metabolizam date hemikalije. Razlike se takođe mogu pripisati individualnim varijacijama u efikasnosti mehanizama popravka DNK.[10]
Metabolizam nekih hemikalija rezultira proizvodnjom reaktivnih vrsta kiseika, što je mogući mehanizam genotoksičnosti. To se vidi u metabolizmu arsena, koji proizvodi hidroksilne radikale, za koje se zna da izazivaju genotoksične efekte.[11] Slično, ROS su uključeni u genotoksičnost uzrokovanu česticama i vlaknima. Genotoksičnost nevlaknastih i fibroznih čestica karakteriše visoka proizvodnja ROS iz upalnih ćelija.[12]
Genotoksična hemoterapija
Genotoksična hemoterapija je liječenje raka upotrebom jednog ili više genotoksičnih lijekova. Liječenje je uobičajeni dio standardizovanih režima. Korišćenjem destruktivnih svojstava genotoksina, cilj tretmana je da izazove oštećenje DNK u ćelijama raka. Svako oštećenje naneseno raku prenosi se na potomke ćelije raka kako se nastavlja proliferacija. Ako je ovo oštećenje dovoljno ozbiljno, ono će podstaći ćelije da se podvrgnu apoptozama.[13]
Rizici
Nedostatak liječenja je taj što su mnogi genotoksični lijekovi djelotvorni i na kancerogene i na normalne ćelije. Selektivnost djelovanja određenog lijeka temelji se na osjetljivosti samih ćelija. Dakle, dok su ćelije raka koje se brzo dijele posebno osjetljive na mnoge lijekove, često su pogođene i normalno funkcionirajuće ćelije.[13]
Drugi rizik liječenja je da, osim što su genotoksični, mnogi lijekovi su također mutageni i citotoksični. Dakle, efekti ovih lijekova nisu ograničeni samo na oštećenje DNK. Osim toga, neki od ovih lijekova koji su namijenjeni za liječenje raka su i sami kancerogeni, što povećava rizik od sekundarnih karcinoma, kao što je leukemija.[13]
Različiti tretmani
Ova tabela prikazuje različite tretmane raka zasnovane na genotoksičnosti zajedno s primjerima.
Remove ads
Također pogledajte
- Kancer
- Kancerogenost
- Kancerogeneza
- Genotoksikologija
- Mutagen
- Mutageneza
Reference
Dopunska literatura
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads