From Wikipedia, the free encyclopedia
Adenomska polipoza coli (APC), znana i kao delecija u polipozi 2.5 (DP2.5) je protein koji je kod ljudi kodiran genom APC.[4] APC protein je negativni regulator koji kontrolira koncentracije beta-katenina i stupa u interakciju s E-kadherinom, koji su uključeni u ćelijsko prianjanje. Mutacije u genu APC mogu rezultirati kolorektumskim karcinomom.[5]
APC je klasificiran kao tumor supresorski gen. Geni za suzbijanje tumora sprječavaju nekontrolirani rast ćelija, što može rezultirati kancerogenim tumorima. Protein kojeg proizvodi gen APC ima kritičnu ulogu u nekoliko ćelijskih procesa koji određuju može li se ćelija razviti u tumor. APC protein pomaže kontrolu koliko često se ćelija dijeli, kako se veže za druge ćelije u tkivu i kako se ćelija polarizira. Kontrolira i morfogeneze 3D struktura,[6] ili da li se ćelija kreće unutar tkiva ili dalje od njega. Ovaj protein također pomaže u osiguravanju ispravnog broja hromosoma u ćelijama proizvedenim ćelijskom diobom. APC protein ove aktivnosti izvršava uglavnom povezivanjem s drugim proteinima, posebno onima koji su uključeni u međućelijske veze i signalizaciju. Aktivnost jednog proteina, posebno beta-katenina, kontrolira APC protein. Regulacija beta-katenina sprečava prečesto uključivanje gena koji podstiču diobu ćelija i sprečava njihov rast.
Ljudski gen APC nalazi se na dugom (q) kraku hromosoma 5 u pojasu q22.2 (5q22.2). Pokazalo se da gen sadrži unutrašnje mjesto ulaska ribosoma. APC ortolozi [7] su također identificirani kod svih sisara za koje su dostupni potpuni podaci o genomu.
Dužina polipeptidnog lanca je 2.843 aminokiseline, а molekulska težina 311.646 Da.[8].
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MAAASYDQLL | KQVEALKMEN | SNLRQELEDN | SNHLTKLETE | ASNMKEVLKQ | ||||
| LQGSIEDEAM | ASSGQIDLLE | RLKELNLDSS | NFPGVKLRSK | MSLRSYGSRE | ||||
| GSVSSRSGEC | SPVPMGSFPR | RGFVNGSRES | TGYLEELEKE | RSLLLADLDK | ||||
| EEKEKDWYYA | QLQNLTKRID | SLPLTENFSL | QTDMTRRQLE | YEARQIRVAM | ||||
| EEQLGTCQDM | EKRAQRRIAR | IQQIEKDILR | IRQLLQSQAT | EAERSSQNKH | ||||
| ETGSHDAERQ | NEGQGVGEIN | MATSGNGQGS | TTRMDHETAS | VLSSSSTHSA | ||||
| PRRLTSHLGT | KVEMVYSLLS | MLGTHDKDDM | SRTLLAMSSS | QDSCISMRQS | ||||
| GCLPLLIQLL | HGNDKDSVLL | GNSRGSKEAR | ARASAALHNI | IHSQPDDKRG | ||||
| RREIRVLHLL | EQIRAYCETC | WEWQEAHEPG | MDQDKNPMPA | PVEHQICPAV | ||||
| CVLMKLSFDE | EHRHAMNELG | GLQAIAELLQ | VDCEMYGLTN | DHYSITLRRY | ||||
| AGMALTNLTF | GDVANKATLC | SMKGCMRALV | AQLKSESEDL | QQVIASVLRN | ||||
| LSWRADVNSK | KTLREVGSVK | ALMECALEVK | KESTLKSVLS | ALWNLSAHCT | ||||
| ENKADICAVD | GALAFLVGTL | TYRSQTNTLA | IIESGGGILR | NVSSLIATNE | ||||
| DHRQILRENN | CLQTLLQHLK | SHSLTIVSNA | CGTLWNLSAR | NPKDQEALWD | ||||
| MGAVSMLKNL | IHSKHKMIAM | GSAAALRNLM | ANRPAKYKDA | NIMSPGSSLP | ||||
| SLHVRKQKAL | EAELDAQHLS | ETFDNIDNLS | PKASHRSKQR | HKQSLYGDYV | ||||
| FDTNRHDDNR | SDNFNTGNMT | VLSPYLNTTV | LPSSSSSRGS | LDSSRSEKDR | ||||
| SLERERGIGL | GNYHPATENP | GTSSKRGLQI | STTAAQIAKV | MEEVSAIHTS | ||||
| QEDRSSGSTT | ELHCVTDERN | ALRRSSAAHT | HSNTYNFTKS | ENSNRTCSMP | ||||
| YAKLEYKRSS | NDSLNSVSSS | DGYGKRGQMK | PSIESYSEDD | ESKFCSYGQY | ||||
| PADLAHKIHS | ANHMDDNDGE | LDTPINYSLK | YSDEQLNSGR | QSPSQNERWA | ||||
| RPKHIIEDEI | KQSEQRQSRN | QSTTYPVYTE | STDDKHLKFQ | PHFGQQECVS | ||||
| PYRSRGANGS | ETNRVGSNHG | INQNVSQSLC | QEDDYEDDKP | TNYSERYSEE | ||||
| EQHEEEERPT | NYSIKYNEEK | RHVDQPIDYS | LKYATDIPSS | QKQSFSFSKS | ||||
| SSGQSSKTEH | MSSSSENTST | PSSNAKRQNQ | LHPSSAQSRS | GQPQKAATCK | ||||
| VSSINQETIQ | TYCVEDTPIC | FSRCSSLSSL | SSAEDEIGCN | QTTQEADSAN | ||||
| TLQIAEIKEK | IGTRSAEDPV | SEVPAVSQHP | RTKSSRLQGS | SLSSESARHK | ||||
| AVEFSSGAKS | PSKSGAQTPK | SPPEHYVQET | PLMFSRCTSV | SSLDSFESRS | ||||
| IASSVQSEPC | SGMVSGIISP | SDLPDSPGQT | MPPSRSKTPP | PPPQTAQTKR | ||||
| EVPKNKAPTA | EKRESGPKQA | AVNAAVQRVQ | VLPDADTLLH | FATESTPDGF | ||||
| SCSSSLSALS | LDEPFIQKDV | ELRIMPPVQE | NDNGNETESE | QPKESNENQE | ||||
| KEAEKTIDSE | KDLLDDSDDD | DIEILEECII | SAMPTKSSRK | AKKPAQTASK | ||||
| LPPPVARKPS | QLPVYKLLPS | QNRLQPQKHV | SFTPGDDMPR | VYCVEGTPIN | ||||
| FSTATSLSDL | TIESPPNELA | AGEGVRGGAQ | SGEFEKRDTI | PTEGRSTDEA | ||||
| QGGKTSSVTI | PELDDNKAEE | GDILAECINS | AMPKGKSHKP | FRVKKIMDQV | ||||
| QQASASSSAP | NKNQLDGKKK | KPTSPVKPIP | QNTEYRTRVR | KNADSKNNLN | ||||
| AERVFSDNKD | SKKQNLKNNS | KVFNDKLPNN | EDRVRGSFAF | DSPHHYTPIE | ||||
| GTPYCFSRND | SLSSLDFDDD | DVDLSREKAE | LRKAKENKES | EAKVTSHTEL | ||||
| TSNQQSANKT | QAIAKQPINR | GQPKPILQKQ | STFPQSSKDI | PDRGAATDEK | ||||
| LQNFAIENTP | VCFSHNSSLS | SLSDIDQENN | NKENEPIKET | EPPDSQGEPS | ||||
| KPQASGYAPK | SFHVEDTPVC | FSRNSSLSSL | SIDSEDDLLQ | ECISSAMPKK | ||||
| KKPSRLKGDN | EKHSPRNMGG | ILGEDLTLDL | KDIQRPDSEH | GLSPDSENFD | ||||
| WKAIQEGANS | IVSSLHQAAA | AACLSRQASS | DSDSILSLKS | GISLGSPFHL | ||||
| TPDQEEKPFT | SNKGPRILKP | GEKSTLETKK | IESESKGIKG | GKKVYKSLIT | ||||
| GKVRSNSEIS | GQMKQPLQAN | MPSISRGRTM | IHIPGVRNSS | SSTSPVSKKG | ||||
| PPLKTPASKS | PSEGQTATTS | PRGAKPSVKS | ELSPVARQTS | QIGGSSKAPS | ||||
| RSGSRDSTPS | RPAQQPLSRP | IQSPGRNSIS | PGRNGISPPN | KLSQLPRTSS | ||||
| PSTASTKSSG | SGKMSYTSPG | RQMSQQNLTK | QTGLSKNASS | IPRSESASKG | ||||
| LNQMNNGNGA | NKKVELSRMS | STKSSGSESD | RSERPVLVRQ | STFIKEAPSP | ||||
| TLRRKLEESA | SFESLSPSSR | PASPTRSQAQ | TPVLSPSLPD | MSLSTHSSVQ | ||||
| AGGWRKLPPN | LSPTIEYNDG | RPAKRHDIAR | SHSESPSRLP | INRSGTWKRE | ||||
| HSKHSSSLPR | VSTWRRTGSS | SSILSASSES | SEKAKSEDEK | HVNSISGTKQ | ||||
| SKENQVSAKG | TWRKIKENEF | SPTNSTSQTV | SSGATNGAES | KTLIYQMAPA | ||||
| VSKTEDVWVR | IEDCPINNPR | SGRSPTGNTP | PVIDSVSEKA | NPNIKDSKDN | ||||
| QAKQNVGNGS | VPMRTVGLEN | RLNSFIQVDA | PDQKGTEIKP | GQNNPVPVSE | ||||
| TNESSIVERT | PFSSSSSSKH | SSPSGTVAAR | VTPFNYNPSP | RKSSADSTSA | ||||
| RPSQIPTPVN | NNTKKRDSKT | DSTESSGTQS | PKRHSGSYLV | TSV |
Ljudski protein pune dužine sadrži 2.843 aminokiseline sa (predviđenom) molekulnom masom od 311.646 Da. Nekoliko N-terminalnih domena strukturno je razjašnjeno u jedinstvenim atomskim kompleksnim strukturama visoke rezolucije. Predviđa se da je većina proteina unutar poremećena. Nije poznato da li ovo veliko predviđeno nestrukturirano područje od aminokiselina 800 do 2.843 opstaje in vivo ili bi formiralo stabilizirane komplekse – vjerovatno s još uvijek neidentificiranim međudjelujućim proteinima.[9] Nedavno je u uvjetima in vitro eksperimentalno potvrđeno da je regija klastera mutacija oko središta APC-a unutra suštinski neuređena.[10]
Najčešća mutacija u raku debelog crijeva je inaktivacija APC-a. U nedostatku mutacija koje inaktiviraju APC, karcinomi debelog crijeva obično nose aktivirajuće mutacije u β-kateninu ili inaktivirajuće mutacije u RNF43.[11] Mutacije u APC se mogu naslijediti , ili se javljaju sporadično u somatskim ćelijama, često kao posljedica mutacija u drugim genima, koje rezultiraju nemogućnošću popravljanja mutacija u DNK. Da bi se rak razvio, oba alela (kopije gena APC) moraju biti mutirane. Mutacije u APC-u ili β-kateninu moraju biti praćene drugim mutacijama da postanu kancerogene; međutim, kod nositelja APC inaktivirajućih mutacija, rizik od kolorektumskog karcinoma do 40. godine života je gotovo 100%.[5]
Porodična adenomatozna polipoza (FAP) je uzrokovana nasljednom, inaktivirajućom mutacijom u APC genu.[12] Više od 800 mutacija s u APC genu identifikovano je u porodicama sa klasičnim i oslabljenim tipovima porodične adenomske polipoze. Većina ovih mutacija uzrokuje proizvodnju APC proteina koji je abnormalno kratak i vjerojatno nefunkcionalan. Ovaj kratki protein ne može suzbiti ćelijski rast koji dovodi do stvaranja polipa koji mogu postati karcinom. Najčešća mutacija u porodičnoj adenomatoznoj polipozi je delecija pet baza u APC genu. Ova mutacija mijenja redoslijed aminokiselina u rezultirajućem APC proteinu, počevši od pozicije 1.309.
Još jednu mutaciju nosi približno 6% ljudi kod Aškenazija (istočne i srednje Evrope) jevrejskog naslijeđa. Ova mutacija rezultira zamjenom aminokiseline lizina za izoleucin na poziciji 1.307 u APC proteinu (također napisanom kao I1307K ili Ile1307Lys). U početku se smatralo da je ova promjena bezopasna, ali je nedavno nađeno da je povezana s 10 do 20 posto povećanim rizikom od raka debelog crijeva.
APC protein (adenomatozna polipoza coli) obično gradi "kompleks uništenja" s glikogen-sintaza kinazom 3-alfa i ili beta (GSK-3α/β) i aksinom u interakciji sa 20 ponavljanja AA i SAMP.[13][14][15] Ovaj kompleks tada može vezati β-katenine u citoplazmi, koji su se odvojili od adhezivnih kontakata između ćelija. Uz pomoć kazein-kinaze 1 (CK1), koja vrši početnu fosforilaciju β-katenina, GSK-3β može fosforilirati β-katenin drugi put. Ovo cilja β-katenin za ubikvitinaciju i razgradnju ćelijskim proteasomima. Ovo ga sprječava da se translocira u jedro, gdje djeluje kao faktor transkripcije za gene za proliferaciju.[16] Također se vjeruje da je APC usmjeren na mikrotubule, putem PDZ veznog domena, stabilizirajući ih.[17] Deaktiviranje proteina APC može se dogoditi nakon pokretanja određenih lančanih reakcija u citoplazmi, npr. preko Wnt signala koji uništavaju konformaciju kompleksa. U jedru se kompleksira sa BCL9, TCF i PYGO2.
Sposobnost APC-a da veže β-katenin klasično se smatra integralnim dijelom mehaničke funkcije proteina u kompleksu uništavanja, zajedno sa vezanjem za aksin putem SAMP ponavljanja.[18] Ovi modeli potkrijepljeni su opažanjima da uobičajeni APC gubitak funkcionalnih mutacija u regiji mutacijskog klastera često uklanja nekoliko veznih mjesta β-katenina i SAMP ponavljanja. Međutim, nedavni dokazi Yamulle et al. izravno su testirali te modele i ukazuju na to da osnovne mehaničke funkcije APC-a možda neće zahtijevati izravno vezivanje za β-katenin, ali zahtijevaju interakciju s aksinom.[19] Pretpostavlja se da mnoga APC-ovo mjesta vezanja β-katenina povećavaji učinkovitost proteina u uništavanju β-katenina, ali ipak nije apsolutno neophodno za mehaničku funkciju proteina. Jasno je da su potrebna daljnja istraživanja kako bi se razjasnila precizna mehanička funkcija APC -a u kompleksu uništenja.
Rosenberg et al. otkrili su da APC usmjerava skupljanje holinergijske sinapse između neurona, nalaz koji ima implikacije na autonomne neuropatije, Alzheimerovu bolest, na gubitak sluha povezan sa godinama te na neke oblike epilepsije i shizofrenije.[20] (29)
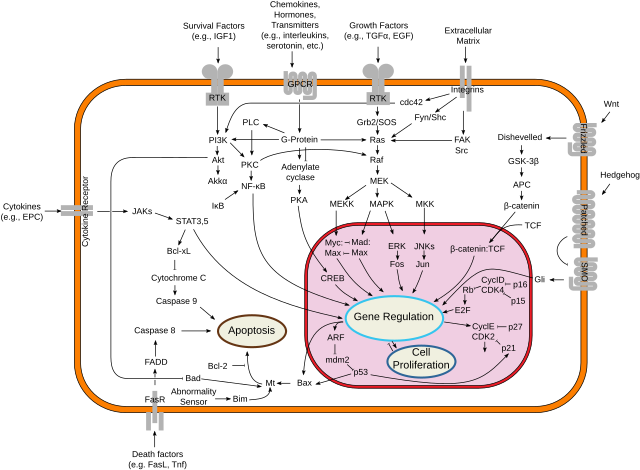

Mutacije u APC-u često se javljaju u ranim fazama kod nekih karcinoma, kao što je rak debelog crijeva.[9] Pacijenti sa porodičnom adenomatoznom polipozom (FAP) imaju mutacije zametne linije, pri čemu je 95% nonsens mutacija s pomakom okvira, što dovodi do prijevremenog stop kodona. Oko 33% mutacija događa se između aminokiselina 1061 i 1309. U somatskim mutacijama, više od 60% javlja se unutar regije mutacijskog klastera (1286–1513), uzrokujući gubitak mjesta vezanja aksina u svim osim u jednom od 20 ponavljanja 20AA. Mutacije u APC dovode do gubitka regulacije β-katenina, promijenjene ćelijskih migracije i nestabilnosti hromosoma.[11]
Za gen APCje pokazano da ima interakcije sa:
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.