From Wikipedia, the free encyclopedia
Mokraćna kiselina ili urinska kiselina je heterociklični spoj ugljika, dušika, kisika i vodika, sa formulom C5H4N4O3. Tvori ione i soli poznate kao urati i kiselinski urati, kao što je urat amonijeve kiseline. Mokraćna kiselina je proizvod metaboličkog raspada purinskih nukleotida i normalna je komponenta urina. Visoke koncentracije mokraćne kiseline u krvi mogu dovesti do gihta i povezane su s drugim medicinskim stanjima, uključujući dijabetes i stvaranje urata amonijeve kiseline bubrežnih kamenaca.
| Mokraćna kiselina | |
|---|---|
   | |
| Općenito | |
| Hemijski spoj | Mokraćna kiselina |
| Druga imena | 2,6,8-Trioksipurin; 2,6,8-Trihidroksipurin; 2,6,8-Trioksopurin; 1H-Purin-2,6,8-triol, Urinska kiselina IUPAC-ime:7,9-Dihidro-1H-purin-2,6,8(3H)-trion |
| Molekularna formula | C5H4N4O3 |
| CAS registarski broj | 69-93-2 |
| SMILES | O=C1Nc2nc(=O)nc2C(=O)N1
Laktamski oblik |
| InChI | 1S/C5H4N4O3/c10-3-1-2(7-4(11)6-1)8-5(12)9-3/h5,12H,(H,9,10)(H,7,8,11) |
| Osobine1 | |
| Tačka topljenja | 300 |
| Rastvorljivost | 6 mg/100 mL (na 20 °C) |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Mokraćna kiselina je diprotonska kiselina sa pKa1=5,4 i pKa2=10,3[1]. Zato u jakim alkalijama na visokim pH-vrijednostima formira dvojno naelektrisani uratni ion, dok na biološkom pH ili u prisustvu ugljične kiseline ili karbonatnog iona, formira jednostruko naelektrisani vodikov uratni ion, pošto je njegov pKa2 veći od pKa1 ugljične kiseline. Budući da je njena ionizacija tako slaba, uratne soli su sklone povratnoj hidrolizi u vodikove uratne soli i slobodnu bazu na pH vrijednostima oko neutralne. Ova kiseline je aromatska, jer je izvedenica purina.
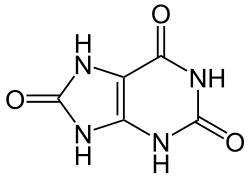
Kao biciklično-heterociklični purinski derivat, mokra ćnakiselina se ne protonira na isti način kao karboksilne kiseline. X–difrakcijske studije unatražnog stvaranja vodikovih iona u kristalima amonijum vodik-urata, formiranih in vivo, kao što je kod gihtnih depozita, pokazuju da keto-kisik na poziciji 2 tautomera purinske strukture postoji kao hidroksilna grupa i da dva susjedna atoma dušika na pozicijama 1 i 3 dijele ionsko naelektrisanje u šestočlanom pi-rezonancom-stabiliziranom prstenu.[2][3]
Dok se većina organskih kiselina deprotonira ionizacijom polarne veze vodik–kisik , što je obično praćeno nekom vrstom rezonantne stabilizacije (rezultirajući stvaranjem karboksilatnog iona), ova kiselina se deprotonira na atomu dušika i koristi tautomernu keto/hidroksilnu grupu kao elektron-deletirajuću grupu da uveća vrijednost pKa1. Petočlani prsten također ima keto-grupu (na poziciji 8), flankiranu sa dvije sekundare amino grupe ( na pozicijama 7 i 9) i deprotonacija jedne od njih pri visokom pH može objasniti pKa2 i ponašanje poput diprotonske kiseline. Slično tautomersko preuređivanje i pi-rezonantna stabilizacija bi proizveli ion sa određenim stepenom stabilnosti. (U strukturi prikazanoj u gore lijevo, NH u gornjem lijevom uglu na šestočlanom prstenu je "1", numerirajući u smjeru kazaljki na satu, oko šestočlanog prstena, do "6" za keto ugljik na vrhu tog prstena. Gornji NH u petočlanom prstenu je "7", idući u smjeru kazaljki na satu oko ovog prstena do donjeg NH, koji je "9".)
 | 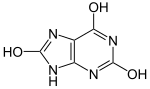 | pKa1 | 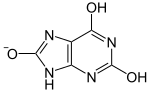 | |
| Laktamski oblik | Laktimski oblik | Uratni ion |
Rastvorljivost mokraćne kiseline, njenih alkalnih i zemnoalkalnih soli u vodi je veoma niska. U toploj vodi je nešto veća, što omogućava rekristalizaciju. Rastvorljivost ove kiseline i njenih soli u etanolu je veoma niska ili zanemarljiva. U mješavinama etanol-voda, rastvorljivosti su negdje između krajnjih vrijednosti za čist etanol i čistu vodu.
| Spoj | Hladna voda | Ključala voda |
|---|---|---|
| Mokraćna kiselina | 15.000 | 2.000 |
| Ammonij-vodikov urat | — | 1.600 |
| Litij-vodikov urat | 370 | 39 |
| Natrij-vodikov urat | 1.175 | 124 |
| Kalij-vodikov urat | 790 | 75 |
| Magnezij-divodikov diurat | 3.750 | 160 |
| Kalcij-divodikov diurat | 603 | 276 |
| Dinatrij-urat | 77 | — |
| Dikalij-urat | 44 | 35 |
| Kalcij-urat | 1,500 | 1,440 |
| Stroncij-urat | 4.300 | 1.790 |
| Barij-urat | 7.900 | 2.700 |
Numeričke vrednosti u gornjoj tabeli ukazuju na količinu vodene mase koja je neophodna da bi se rastvorila jedinica mase jedinjenja; što je ova vrijednost manja, to je supstanca u datom rastvaraču rastvorljivija.[1][4][5]
Mokraćnu kiselinu katalizira enzim ksantin-oksidaza iz ksantina i hipoksantina, dok se ti supstrati formiraju iz purina. Ova kiselina toksičnija je za tkiva nego i ksantin i hipoksantin.[6] Mokraćna kiselina se oslobađa u hipoksijskim uslovima.
Ksantin-oksidaza je enzim koji katalizira nastajanje mokraćne kiseline iz ksantina i hipoksantina, koje se pak proizvode iz drugih purina. Ksantin oksidaza je veliki enzim čije se aktivno mjesto sastoji od metala molibdena, vezanog za sumpor i kisika. Unutar ćelija, ksantin oksidaza može postojati kao ksantin-dehidrogenaza i ksantin-oksireduktaza, koja je takođe pročišćena iz goveđeg mlijeka i ekstrakta slezene.[7] Mokraćna kiselina oslobađa se u hipoksijskim uslovima (niska zasićenost kisikom).[8]
Jedan dio ljudske populacije ima mutacije u proteinima koji su odgovorni za izlučivanje mokraćne kiseline putem bubrega. U vezi s tim, identificirano je devet kodirajućih gena: SLC2A9, ABCG2, SLC17A1, SLC22A11, SLC22A12, SLC16A9, GCKR, LRRC16A i PDZK1.[9][10] Za SLC2A9 se zna da transportuje urinsku kiselinu i fruktozu.[11]
Primati: Kod ljudi i viših primata, mokraćna kiselina (zapravo ion vodik-urata) je konačni oksidacijskii (raspadni) proizvod metabolizma purina i izlučuje se urinom, dok se u većini kod ostalih sisara, enzim urikaza dalje oksidira mokraćnu kiselinu u alantoin.[12] Gubitak urikaze kod viših primata paralelan je sličnom gubitku sposobnosti sinteze askorbinske kiseline, što dovodi do sugestije da urati kod takvih vrsta mogu djelomično zamijeniti askorbat.[13][14]
Ljudi: Normalni raspon koncentracije mokraćne kiseline (ili iona vodik-urata) u ljudskoj krvi je 25 do 80 mg/L za muškarce i 15 do 60 mg/L za žene.[15] Osoba može imati vrijednosti u serum čak i 96 mg/L, a ne imati giht.[16][17] Normalno izlučivanje mokraćne kiseline mokraćom iznosi 250 do 750 mg dnevno (koncentracija od 250 do 750 mg/L ako se dnevno proizvede jedan litar urina - veća je od topljivosti mokraćne kiseline, jer je u obliku rastvoreni kiselinski urati).
Kod ljudi, oko 70% dnevnog izlučivanja mokraćne kiseline obavlja se putem bubrega. Kod 5-25% ljudi umanjena bubrežna ekskrecija dovodi do hiperuricemije.[18]
Psi: Psi pasmine dalmatiner imaju genetički defekt u usvajanju mokraćne kiseline u jetri i bubrezima, što rezultira smanjenom konverzijom u alantoin, pa ova pasmina u urinu izlučuje mokraćnu kiselinu, a ne alantoin .[19]
Ptice i gmizavci i neki pustinjski sisari (npr. kengurski pacov), izlučuju mokraćnu kiselinu kao krajnji proizvod metabolizma purina, ali se izlučuje izmetom kao suha masa. To je omogućeno kompleksnim metaboličkim putem koji je energetski neefikasan u poređenju sa probavom drugog dušičnog otpada kao što su ureja (iz ciklusa ureje) ili amonijak, ali ima prednost umanjenja gubitka vode.[20]
Beskičmenjaci: Platynereis dumerilii, crv iz grupe Polychaeta, upotrebljava mokraćnu kiselinu kao spolni feromon. Ženka ove vrste ispušta mokraćnu kiselinu u vodu tokom parenja, da bi podstaknula mužjake da ispuštaju spermu.[21]
U ljudskoj krvnoj plazmi referentni rasponi za krvne testove mokraćne kiseline je obično 3,4–7,2 mg na 100 ml (200–430 µmol/l) za muškarce, a 2,4–6,1 mg na 100 ml za žene (140–360 µmol/l).[22] Koncentracije mokraćne kiseline u krvnoj plazmi iznad i ispod normalnog raspona poznate su kao hiperuricemija i hipuricemija. Isto tako, koncentracije mokraćne kiseline u urinu iznad i ispod normalne vrijednosti poznate su pod nazivom hiperurikozurija i hipurikozurija. Razine mokraćne kiseline u slini mogu biti povezane s razinama mokraćne kiseline u krvi.[23]
Hiperurikemija (visoki nivoi mokraćne kiseline), koja indukuje giht, ima različito potencijalno porijeklo:
Višak mokraćne kiseline u krvi može izazvati giht, ,[29] bolno stanje koje je rezultat iglastih kristala mokraćne kiseline koji se talože u zglobovima, kapilarima, koži i drugim tkivima.[30] Giht se može javiti tamo gdje su razine mokraćne kiseline u serumu najniže 6 mg/ 100 ml (357 µmol/L), ali neke osobe mogu imati i serumske razine do 9,6 mg/ 100 ml (565 µmol/L) a nemaju giht.[16]
U ljudi se purini metaboliziraju u mokraćnu kiselinu, koja se zatim izlučuje mokraćom. Konzumacija nekih vrsta hrane bogate purinima, posebno mesa i plodova mora, povećava rizik od gihta.[31] Giht može nastati redovnom konzumacijom mesa, kao što je jetra, bubreg i slatkog hljeba, te određenih vrsta morskih plodova, uključujući inćune, haringe, srdele, dagnje, kapice, pastrmke, vahnje, skuše i tune.[32] Moderate intake of purine-rich vegetables, however, is not associated with an increased risk of gout.[31]
Jedan od načina liječenja gihta u 19. stoljeću bilo je davanje litijskih soli;[33] a litij-urat je topljiviji. Danas se upala tokom napada češće liječi s NSAID-om, kolhicinom ili kortikosteroidima, a razine urata upravljaju se s alopurinolom.[34] Alopurinol, koji slabo inhibira ksantin-oksidazu, analog je hipoksantina koji se hidroksilira pomoću ksantin oksidoreduktaza na položaju 2 dajući oksipurinol.[35]
Burežni kamencia mogu nastati stvaranjem naslaga mikrokristala natrij-urata.[36][37]
Razine zasićenja mokraćne kiseline u krvi mogu rezultirati jednim od oblika bubrežnih kamenaca, kada u bubregu kristaliziraju urati. Ovi kamenci u mokraćnoj kiselini su radiolucentni i tako se ne pojavljuju na trbušnoj ravnini rendgenske slike.[38] Kristali mokraćne kiseline mogu takođe pospješiti stvaranje kalcij-oksalatnog kamenca, djelujući kao "sjemenski kristali".[39]
Niska razina mokraćne kiseline (hipuricemija) može imati brojne uzroke. Niski unosi cinka u ishrani uzrokuju niži nivo mokraćne kiseline. Ovaj efekt može biti još izraženiji kod žena koje uzimaju oralne kontracepcijske lijekove.[40] Sevelamer, lijek indiciran za prevenciju hiperfosfatemije kod ljudi sa hroničnim zatajenjem bubrega, može značajno smanjiti razinu mokraćne kiseline u serumu.[41]
Ispravljanje niskih ili nedostatnih nivoa cinka može pomoći u povišenju razine serumske mokraćne kiseline.[42]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.