Loading AI tools
化合物 来自维基百科,自由的百科全书
六氟化鉑,又稱氟化鉑(VI),化學式為PtF6。它是一個深紅色的揮發性固體,氣態時則變成紅棕色。該化合物中鉑的氧化態為+6,只有四個d電子,呈順磁性,基態時為三線態。PtF6是很強的氧化劑和氟化劑,甚至可以氧化氙,造就第一個惰性氣體化合物六氟合鉑酸氙的發現。
| 六氟化鉑 | |
|---|---|
| |
| IUPAC名 Platinum hexafluoride | |
| 別名 | 氟化鉑(VI) |
| 識別 | |
| CAS編號 | 13693-05-5 |
| PubChem | 22238670 |
| ChemSpider | 2283064 |
| SMILES |
|
| InChI |
|
| EINECS | 237-214-0 |
| 性質 | |
| 化學式 | PtF6 |
| 莫耳質量 | 309.1 g·mol⁻¹ |
| 外觀 | 暗紅色易揮發性的固體[1] 蒸氣為類似溴的紅棕色[2] |
| 密度 | 5.21 g/cm3(計算)[3] 3.826 g/cm3(液態,64.3 °C)[2] |
| 熔點 | 61.3 °C[1] |
| 沸點 | 69.1 °C[1] |
| 溶解性(水) | 水解[2] |
| 結構[3] | |
| 晶體結構 | 正交晶系 |
| 空間群 | Pnma (No. 62) |
| 晶格常數 | a = 937.4 pm, b = 852.7 pm, c = 493.3 pm |
| 危險性 | |
| 主要危害 | 氧化性 |
| 相關物質 | |
| 相關化學品 | 六氟合鉑酸氙 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
PtF6首次由金屬鉑與氟氣化合製備,[4]此反應至今仍是首選方法。[3]
此外,六氟化鉑也可由PtF5在130 °C下歧化得到,[5]而反應物PtF5可由氟化PtCl2製得。[6]
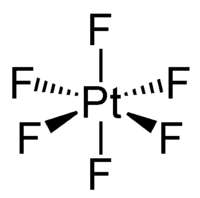
六氟化鉑是暗紅色晶體,[1]蒸汽則呈紅棕色,在200 °C下仍然穩定。[5]固態和氣態六氟化鉑都為八面體構型,Pt-F鍵長為185 pm。[3]
PtF6是強氧化劑,甚至可以和氙反應,生成六氟合鉑酸氙(XePtF6)。1962年發現的此反應證明了惰性氣體也能形成化合物。[7]此外,PtF6也可以氧化氧氣,生成含有二氧基(O2+)的化合物六氟合鉑酸氧(O2PtF6)。[8]它劇烈水解,生成[PtF6]2-,並放出氧氣。[9]
PtF6能和三氟化溴、四氟化錼、四氟化鈽反應,分別生成五氟化溴、六氟化錼、六氟化鈽。[2]它還能和亞硝醯氟、硝醯氟、四氧化二氮反應,分別生成NOPtF6、NO2PtF6、N2O3PtF6。[10]PtF6也會和一氧化氮反應,產生NOPtF6,但無法和一氧化二氮反應。[10]
它和氯醯氟[11]或五氟化氯[12]反應,生成六氟合氯(VII)鎓鹽。它和氟化銫在氟化氫里反應,生成CsPtF6,並放出氟氣。[13]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.