分子生物學
学科 来自维基百科,自由的百科全书
分子生物學(英語:molecular biology)屬於生物學的一個分支,是從分子水平上研究生物大分子(蛋白質、核酸等)的結構和功能、生命現象基本過程、分子間相互作用及基因表現調控機制等,以揭示各種生命現象本質的學科。
分子生物學,廣義上,是從分子的面向對生物現象的研究;狹義上,是從基因結構和功能的分子層面研究。這是一門從遺傳學和生物化學衍生而來的學科。
分子生物學主要致力於開發對細胞中不同系統之間相互作用的研究技術,包括DNA,RNA,蛋白質和蛋白質生物合成之間的關係以及了解它們之間是如何被調控的。
與其他「分子尺度」生物科學的關系
分子生物學的研究者們不僅應用分子生物學特有的技術(參見本條目中「技術」一節),而且越來越多地從遺傳學、生物化學和生物物理學的技術和思路中獲得啟迪,綜合利用。因此,這些學科間越來越多地相互融合,不再有明確的分界線。
- 「生物化學」主要研究化學物質在生物體關鍵的生命進程中的作用。生物化學很大程度上專注於生物分子的角色,功能,和結構。生物過程背後的化學性質研究和生物活性分子的合成是生物化學的例子。
- 「遺傳學」主要研究生物體間遺傳差異的影響。這些影響常常可以通過研究正常遺傳組分(如基因)的缺失來推斷,如研究缺少了一個或多個正常功能性遺傳組分的突變體與正常表現型(又稱為「野生型」)之間的關係。遺傳相互作用(如異位顯性)經常會使像基因剔除這類研究的結果難以解釋。
- 「分子生物學」則主要研究遺傳物質的複製、轉錄和轉譯進程中的分子基礎。分子生物學的中心法則認為「DNA轉錄mRNA,mRNA轉譯蛋白質,蛋白質反過來協助前兩項流程,並協助DNA自我複製」;隨著研究的深入,發現RNA也可以反轉錄成DNA。
在分子生物學中大量工作是定量的,而且最近的許多研究工作是在結合生物資訊學和計算生物學的基礎之上完成的。從本世紀(二十一世紀)開始,研究基因結構和功能的分子遺傳學已經成為發展最快的領域之一。
越來越多的學科已經將目光集中到分子水平的研究中,一方面直接研究相關分子間相互作用,如細胞生物學和發育生物學;另一方面利用分子生物學技術來研究並推測群體和物種的歷史貢獻(非直接,遺傳水平),如進化生物學領域中的群體遺傳學和系統發生學。此外,生物物理學除了研究大尺度器官構造之外,一直都有從頭研究生物分子的傳統。
分子生物學的技術

從1950年代晚期和1960年代早期開始,分子生物學家已經開始學習鑑定、提純和處理細胞和生物體的分子組分。這些組分包括:DNA,遺傳資訊的攜帶者;RNA,作為DNA的「近親」,既可以是DNA的臨時「工作拷貝」,又可以發揮結構分子和酶功能,同時還是蛋白質轉譯的結構和功能元件;蛋白質,細胞中的主要的結構分子和酶分子。

分子生物學中最基本的技術是蛋白質的表現和純化。首先是編碼目的蛋白的DNA序列被克隆(用PCR技術和限制性內切酶)到作為表現載體的質體中。隨後構建好的質體被引入到宿主細胞。編碼序列在質體上的特殊的啟動子元件的驅動下,被宿主細胞的表現系統所表現。質體上通常還帶有抗生素抗性標籤以便於質體篩選。[1]
質體可以被插入到細菌或動物細胞。外源DNA被引入細菌被稱為轉化(transformation),可以通過電穿孔法、微注射法、正吸收和融合來實現;外源DNA被引入真核細胞,如動物細胞,被稱為轉染(transfection),轉染技術包括磷酸鈣法、脂質體法和一些有專利權的商用轉染試劑。DNA也可以以病毒或病原菌為載體被帶入宿主細胞;應用這種病毒或病菌的轉染技術於細胞時,用術語來說就是「對細胞進行轉導(transduce)」。
多聚酶連鎖反應(PCR)是一項用於體外複製DNA的極為通用的技術。簡而言之,PCR技術可以使單鏈DNA被複製數百萬次,也允許用事先確定好的方式對被複製的DNA序列進行改動。例如,PCR技術可以用於引入限制性酶切位點,或者對特定的DNA鹼基進行突變(改變)。PCR技術還可以用於從cDNA文庫獲得特定的DNA片段,或者從另一個角度,用於判斷一個cDNA文庫中是否含有特定的DNA片段。
凝膠電泳是分子生物學最主要的一項技術。其基本原理是:DNA、RNA和蛋白質可以用電場來進行分離。在瓊脂糖凝膠電泳中,DNA和RNA可以被瓊脂糖凝膠按其分子大小進行分離。同樣,蛋白質可以被SDS-聚丙烯醯胺凝膠電泳(SDS-PAGE)按分子量大小分離;此外,蛋白質還可以由於所帶電荷的不同被等電聚焦電泳分離。
此方法的命名源自其發明者生物學家Edwin Southern。南方墨點法是探測一個DNA樣品中含有特定DNA序列的方法。首先,DNA樣品為凝膠電泳所分離;然後,分離的樣品通過毛細現象被轉移到一張膜上,這一過程被稱為「墨點」(blotting)。帶有樣品的膜就可以用與目標序列互補的標記的DNA標記探針來探測。最初的操作手冊大都採用放射性標記,但現在非放射性標記已開始被採用。自從PCR技術被用於檢測特定DNA序列後,南方墨點法在實驗室中的應用大為減少。但此方法依然有著其他一些應用,如用於測量基因轉移鼠的基因轉移拷貝數,以及用於構建基因剔除的胚胎幹細胞系。
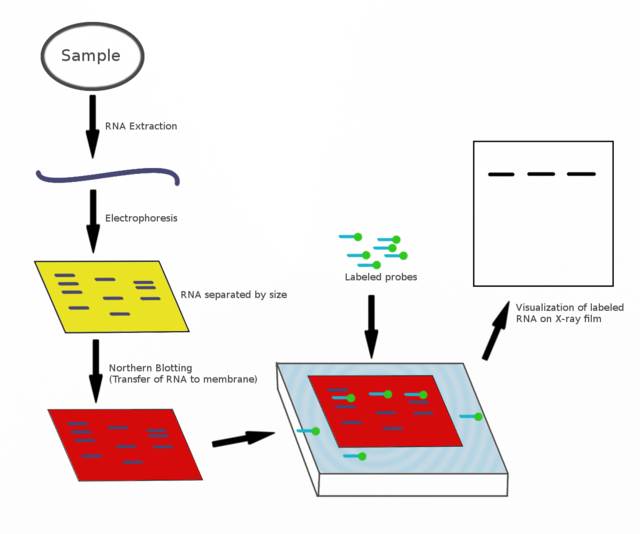
北方墨點法被用於研究特定類別的RNA分子的表現模式(豐度和大小)。與南方墨點法相似,RNA樣品為凝膠電泳按大小分離;然後轉移到膜上,並用與目標序列互補的標記的探針來探測。實驗結果可以根據所用探針的不同以多種方式來觀察,但大多數都顯示的是樣品中被探測的RNA條帶的相對位置,也就是分子大小;而條帶的強度則與樣品中目標RNA的含量相關。這一方法可以測量目標RNA在不同樣品中的情況,因此已經被普遍用於研究特定基因在生物體中表現的時刻和表現量,也是這類研究中最基本的手段。
大多數蛋白的抗體可以通過將少量的蛋白注入動物(如鼠、兔、羊)以獲得對應注入蛋白的抗體(多株抗體)或進一步通過細胞培養獲得抗體(單株抗體)。這些抗體就可為許多分析和製備技術所使用。在西方墨點法中,蛋白質首先根據分子大小用SDS-PAGE分離。然後將膠中的蛋白質轉移到膜(如PDVF膜、尼龍膜或其他可用的膜)上。然後將膜用含有抗體的溶液浸泡,由於抗體可以特異性地結合到目標蛋白上,因此就可以探測膜中的目標蛋白。同樣觀察結果的方法有很多,包括顯色產物、化學發光(chemiluminescence)或放射自顯影。一些與西方墨點法相似的方法可以用於直接對細胞和組織中的特定蛋白質進行染色,然而這些被稱為「免疫染色」的方法更多的是應用於細胞生物學而非分子生物學。
此外,還有並不常用的「東方墨點法」(對雙向電泳後蛋白質分子的墨點分析)、「西南方墨點法」(研究蛋白質和DNA相互作用)和「遠端西方墨點法」(Far Western blotting,研究蛋白質-蛋白質相互作用)。
值得一提的是除了南方墨點法的命名是來自於發明者的姓名,其他墨點法的命名則都是源於發明者的幽默:因為南方(Southern)既是墨點法的發明者Edwin Southern的姓,同時其英文含義為「南方」;於是隨後發明不同墨點法的研究者們紛紛將這些方法以方位命名,如Northern(「北方」),Western(「西方」)印等等。[2]

DNA陣列是附著於固體支持物的斑點的集合,例如顯微鏡載玻片,其中每個斑點包含一個或多個單鏈DNA寡核苷酸片段。陣列使得在一個載玻片上能夠放下大量的非常小的(100微米直徑)的斑點。每個斑點具有一個DNA片段分子互補的單個DNA序列(類似於南方墨點法)。該技術的變化允許生物在發育的特定階段的基因表現是合格的(表現譜)。在該技術中,組織中的RNA被分離並轉化為標記的互補去氧核醣核酸(cDNA)。 然後將該cDNA與陣列上的片段雜交,並且可以進行雜交的可視化。由於可以用完全相同的片段位置製備多個陣列,因此它們特別可用於比較兩種不同組織(例如健康和癌性組織)的基因表現。此外,人們可以測量什麼基因被表現和如何表現隨時間或與其他因素的變化而變化。 例如,常見的麵包酵母釀酒酵母含有約7000個基因; 使用微陣列,可以定量測量每種基因如何被表現,以及該表現如何變化,例如該表現如何隨著溫度的變化而變化。有許多不同的方法來製造微陣列; 最常見的是矽晶片,具有~100微米直徑的斑點的顯微鏡載片,定製陣列和在多孔膜(宏陣列)上具有較大斑點的陣列。給定陣列上可以有從100個斑點到超過10,000個斑點。

隨著新技術和新方法的不斷出現,舊的技術很快就被拋棄。一個很典型的例子就是DNA分子大小的測量:在(瓊脂糖/聚丙烯醯胺)凝膠電泳出現之前,DNA分子大小是用蔗糖梯度沉降法來測量的,這一方法費時費力而且花費昂貴;而在梯度沉降法出現之前,黏度法被使用。儘管已經不再為人們所關注,但了解這些過時的技術可能會對解決一些特別的問題有幫助。
歷史
在1930年代,由於許多生物化學家發現細胞內的許多分子參與了各種複雜的化學反應,分子生物學由此逐步建立。但直到1938年「分子生物學」一詞才由瓦倫·韋弗(Warren Weaver)提出(也有人認為「分子生物學」一詞最早於1945年威廉·阿斯特伯里(William Astbury)首先在Harvey Lecture上應用的[3])。瓦倫是當時洛克斐勒基金會自然科學方面的主持人,他相信由於在X射線晶體學等方面的發展,生物學正在進入一個大的轉變期,他也因此將基金會的資金用於資助生物領域的研究。
知名的分子生物學家
參見
參考文獻
延伸閱讀
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
