此条目需要补充更多来源。 (2016年10月1日) |
氩已知的同位素共有14种,包括氩-33至氩-46。地球大气大部分氩是氩-40(由地壳中的钾-40衰变而来)。氩-36是最易由超新星核聚变产生的产物,是宇宙最常见的氩同位素。
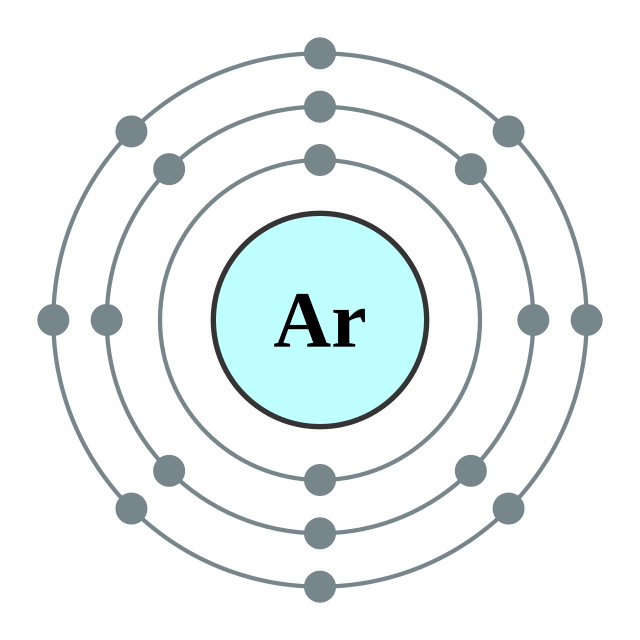
“argon”这名源自于希腊语的 ἀργόν,意思是“懒惰”、“不活跃”,如此命名是因为它几乎不参与化学反应。氩在原子外部壳层完整的八隅体(8个电子)让它变得更加稳定,也不易与其它元素产生键结。它的三相点以国际实用温标定义为83.8058K。
氩元素在工业制程是借由液态空气分馏而得。氩常常作为遮气体,应用在焊接或是其他可以增加物质反应能力的高温工业制程。例如,在石墨电炉中加入氩气以防止石墨燃烧。氩气也用于白炽灯、萤光灯、其他气体放电管和萤光辉光启动器。氩在激发后可放出青色的气体镭射。
历史
氩(来自希腊语ἀργόν,带有懒惰或无效的意思),命名是参考它的化学活性。这个第一个被发现的惰性气体的化学性质令命名者印象深刻。[5][6]1785年,亨利·卡文迪什怀疑惰性气体是组成大气的一部分气体。1894年,在伦敦大学学院, 约翰·斯特拉特,第三代瑞利男爵和威廉·拉姆齐透过移除了氧气、二氧化碳、水以及氮的干净空气样本,使氩第一次从空气里被隔绝出来。[7][8][9] 他们已经确认从化学化合物生成的氮比大气中的氮还要轻0.5%,差异细微,但已足够重要吸引他们的注意力好几个月。他们做出了结论:空气中还有另一种气体与氮气混和在一起。[10]氩气在1882年也被H. F. Newall和沃尔特·诺尔·赫特利的研究偶然发现。他们发现新的发射光谱,并没有符合在当时已经知道的元素。 直到1957年,氩的化学符号一直是"A",之后被改为"Ar"到现在。[11]
特性
氩,是一种惰性气体。无论是气态还是液态,都是无色、无味而且无毒。它在水中的溶解度比氮多出了2.5倍。虽然氩在一般的情况下都很稳定,不会与其它化合物或元素化合,但是科学家还是有办法在极端的条件下形成一些氩化合物,像是2000年8月由芬兰化学家马库·拉萨能(Markku Räsänen)领导的小组发现的氟氩化氢()。这个氟、氢和氩的化合物在−265°C才能保持稳定。[12]此外,氩还可以作为客体分子,与水形成包合物。[13]除了以上基态的物质外,目前已经发现含氩的离子和激发态配合物(像ArH+和ArF),而根据理论计算显示氩应该可以形成在室温下稳定的化合物,虽然目前还没有发现它们存在的线索。[14]
氩气常被注入灯泡内,因为氩即使在高温下也不会与灯丝发生化学作用,从而延长灯丝的寿命。[15]在不锈钢、锰、铝、钛和其它特种金属电弧焊接时、钢铁生产时,氩也用作保护气体。[来源请求]
氩的发现
氩曾经在1785年由亨利·卡文迪什制备出来,但却没发现这是一种新的元素;直到1894年,约翰·斯特拉斯和苏格兰的化学家威廉·拉姆齐才通过实验确定氩是一种新元素。[16][17]他们主要是先从空气样本中去除氧、二氧化碳、水汽等后得到的氮气与从氨分解出的氮气比较,结果发现从氨里分解出的氮气比从空气中得到的氮气轻1.5%。虽然这个差异很小,但是已经大到误差的范围之外。所以他们认为空气中应该含以一种不为人知的新气体,而那个新气体就是氩气。[来源请求]
另外1882年H.F. 纽厄尔和W.N.哈特莱从两个独立的实验中观测空气的颜色光谱时,发现光谱中存在已知元素光谱无法解释的谱线,但并没有意识到那就是氩气。由于在自然界中含量很多,氩是最早被发现的惰性气体,目前它的符号为(在1957年以前,它的符号为)。[18]
天然含量
氩在地球大气中的含量以体积计算为0.934%,而以质量计算为1.29%,在地壳中,由于氩在自然情况下不与其他化合物反应,而无法形成固态物质,但可以被“困在”放射性岩石中。鉴于空气中的氩更易得,工业用的氩大多就直接从空气中提取。主要是用分馏法提取,而像是氮、氧、氖、氪、氙等气体也都是这样从空气中提取的。 [19] 而在火星的大气中,氩-40以体积计算的话占有1.6%,而氩-36的浓度为5ppm;另外1973年水手号计划的太空探测器飞过水星时,发现它稀薄的大气中占有70%氩气,科学家相信这些氩气是从水星岩石本身的放射性同位素衰变而成的。卡西尼-惠更斯号在土星最大的卫星,也就是泰坦上,也发现少量的氩。[20]
同位素
氩稳定的同位素有氩-40()天然含量99.6%、 氩-36()天然含量0.34%和氩-38()天然含量0.06%。一般来说稳定的氩-40是由地壳中的钾-40()经由电子俘获或正子发射衰变来的。11.2%的钾-40以这两种方式衰变成氩-40,另外还有88.8%通过β衰变成为钙-40()。这个特性可以被用来测定岩石的年龄。[21]
在地球大气中,不稳定的氩-39()可经由宇宙射线轰击氩-40而生成,另外也可以经由钾-39()的中子俘获而来。至于氩-37,则可以从()核试验中形成的钙的人造同位素衰变而来,氩-37的寿命非常短,半衰期只有35天。[21]
化合物
由于氩气拥有的八个价电子,占满了其原子轨道的最外层,因此不容易与其他的原子结合,化学性质非常不活泼。在1962年以前,一般认为氩和其他的惰性气体是完全无法与其他物质产生化学反应,但不久之后比氩重的氙和氪的化合物就陆续被合成,因此也激励了科学家发现新的惰性气体化合物。1982年在星际空间探测到氩氢离子,是氩的一种多原子离子。[22]在2000年8月,第一个氩的化合物在芬兰的赫尔辛基大学由马库·拉萨能领导的小组首先被制备出来,他们利用紫外线照射含有微量氟化氢的氩气冰块,形成了氟氩化氢,分子式为HArF,这种化合物可以在40K(−233℃)的低温下保持稳定。[23]另外在2003年发现了一种新氩化合物存在的踪迹,二氟化氩(ArF2)[来源请求],但目前还没有任何可靠的证据可以证实。
制备

目前在工业上得到氩的方法就是把空气蒸馏。用冷凝器可以先把沸点90.2K的氧液化,移除液氧之后继续冷却就可以液化沸点为87.3K的氩气,最后留下沸点77.35K的氮气。目前以这种方法制造的氩气在全世界高达七十万吨/年。[24]
另外用钾-40的衰变也可以制造氩气,但这种制备法的效率并不高,因为钾-40的半衰期长达1.26×109年,所以并不常用。如果要制造氩的放射性同位素的话,就必须要靠回旋加速器和重离子加速器来将其他元素转换成氩的同位素。[来源请求]
用途


因为氩气具有惰性、低传热率等性质,因此它被广泛地运用在许多方面。[25]
氩气最主要的用处就是它的惰性,可以保护一些容易与周遭物质发生反应的东西。[25]虽然其他的惰性气体也有这些特性,但是氩气在空气中的含量最多,也是最容易取得,因此相对就比较便宜,具有经济效益。另外氩气便宜的原因还有它是制造液氧和液氮的副产品,而由于它们两个都是工业上重要的原料,生产很多,所以每年都有很多的液氩副产品。[来源请求]
以氩惰性的用途主要有:
- 电灯泡里的填充气体,由于氩气不会与灯芯产生化学反应,而又能保持气压减缓钨丝升华,可延长灯丝使用寿命。
- 氩可当作焊接时所用的保护气体,其中包括MIG焊接、GTA焊接与GMA焊接等,在这时氩通常会和二氧化碳混合在一起使用。[26]
- 可用于灭火,用氩气灭火的好处是几乎不会破坏任何火场的物品,通常使在火场有特殊仪器时才使用。
- 是用于感应耦合等离子体的气体之一。[27]
- 用于保护加工中的钛和其他容易发生反应的金属:例如铷 和铯 。
- 保护成长中的硅晶体和锗晶体,这晶体主要用于半导体学。
- 在博物馆里,会在一些重要文物的玻璃专柜里填充氩气,避免氧化。[28]
- 在啤酒罐中的填充物,虽然也可以用氮气代替。
- 在酿酒的过程中,啤酒桶里的填充物,它可以把氧气置换,以避免啤酒桶里的原料被氧化成乙酸。
- 在药学里,氩可以用于保护一些静脉内的治疗的药物,举个例子,像是对乙酰氨基酚。一样的,这也是防止药物受到氧气的破坏。
- 用于冷却AIM-9响尾蛇导弹的追踪器,氩当时都是以高压储存,然后当释放气体后就可以带走一些热量。[29]
- 为石墨电熔炉中的保护气体,以免它被氧化。
- 广告用的霓虹灯里,有时也会加入氩气,加了氩气的霓虹灯管,白天看起来是无色透明的,一旦通电后,氩气受到电的刺激,会放出青色的光芒。
- 氩气的低传热率也是它的特性之一,像它可以作为隔热窗户中两层玻璃之间的填充物。[30]
- 因为氩的低传热率和惰性,氩气在水肺潜水可以用来作为膨胀潜水衣的气体。氩气还可以在水肺中代替氮气(吸收纯氧对身体不好,因此水肺中要添加其他气体),因为氮气在高压下会溶进血液里而造成氮麻醉,氩气则可以减轻这种症状(虽然一般来说,惰性气体也会造成这种症状)。[31]
使用特定的方法可以使氩气离子化并且发光,这种功能可用于等离子体灯和粒子物理学中的能量器。以氩作成的氩镭射会发出蓝光,它在医学外科中可用于连接动脉、去除肿瘤和治疗眼睛的缺陷等。[32]氩气还可以用于溅镀。另外氩-39有269年的半衰期,可以用于测定地下水和冰层的年龄,而钾-氩年代测定法适用钾-40衰变成氩-40的过程来用于测定火成岩的年龄。[33]
危害
一般来说,氩气是对身体毫无危害的,但是如果长期暴露在高浓度的氩气中会因为缺氧而窒息,液态氩则可能造成爆炸及冻伤。[34]
- 元素氩在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 氩(英文)
- 元素氩在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素氩在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 氩(英文)
参见
延伸阅读
- (英文) Emsley, J., Nature’s Building Blocks; Oxford University Press: Oxford, NY, 2001; pp. 35–39.
- (英文) Brown, T. L.; Bursten, B. E.; LeMay, H. E., In Chemistry: The Central Science, 10th ed.; Challice, J.; Draper, P.; Folchetti, N. et al.; Eds.; Pearson Education, Inc.: Upper Saddle River, NJ, 2006; pp. 276 and 289.
- (英文) Triple point temperature: 83.8058 K - Preston-Thomas, H. The International Temperature Scale of 1990 (ITS-90). Metrologia. 1990, 27: 3–10 [2008-05-05]. (原始内容存档于2011-04-20).
- (英文) Triple point pressure: 69 kPa - Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, triple, and critical temperatures of the elements. CRC Handbook of Chemistry and Physics 85th. Boca Raton, Florida: CRC Press. 2005.
参考资料
外部链接
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.