醇
有機物機團之一 来自维基百科,自由的百科全书
醇(英语:Alcohol)是有机化合物的一大类,是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物。在化学中,任何有机化合物,其羟基官能团(-OH)被绑定到一个饱和碳原子,就叫醇。通常意义上泛指的醇,是指羟基与一个脂肪族烃基相连而成的化合物;羟基与苯环相连,则由于化学性质与普通的醇有所不同而分类为酚;羟基与sp2混合的双键碳原子相连,属烯醇类,该类化合物由于会互变异构体为醛(只有乙烯醇能变乙醛)或酮,因此大多无法稳定存在。

结构与分类
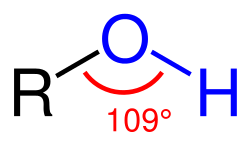
醇的通式为R-OH。以甲醇CH3OH为例,其中氧原子为sp3杂化,外层的6个电子分布在4个sp3轨道,其中2个电子分别与C、H分别成键;余下两对孤对电子占据另外2个sp3轨道。羟基与甲基的3个C-H键成交叉式优势构象。
根据羟基所连烃基的不同,可将醇分为饱和醇、不饱和醇、脂环醇和芳香醇。根据羟基所连碳原子的类型,醇可分为:伯醇(1°醇)、仲醇(2°醇)、叔醇(3°醇)。根据所含羟基数目的不同,可将醇分为:一元醇、二元醇、三元醇等。含两个以上羟基的醇称为多元醇。
简单的醇

最常用的醇类是乙醇,化学式C
2H
5OH:其具有乙基的骨架。人类制造并且消费乙醇已经有超过千年的历史,最初的制备手段来自于酒精饮料的发酵与蒸馏。乙醇是一种透明可燃的液体,其沸点为78.4°C,可用于工业溶剂,汽车燃料及工业原料。在世界各国,由于对于酒精消费的法律和税收限制,因其他用途而添加的乙醇已经进行了管制。
自然界中最简单的醇是甲醇,化学式CH
3OH。甲醇最早通过蒸馏木材得到,因此也称作“木醇”。它是一种澄清透明的液体,其气味和特性类似于乙醇,具有略低的沸点(64.7°C),同时也是一种常用溶剂、燃料、或工业原料。不同于乙醇,甲醇具有高度的毒性:一吸管(约10mL)的甲醇就可通过损坏光学神经而导致永久失明,30ml甲醇则会导致死亡。[1]
丙醇及丁醇同样被广泛使用(虽然不及甲醇与乙醇),它们和乙醇一样也可通过发酵来制备,其发酵过程使用了一种不消耗糖类而只消耗纤维素的丙酮丁醇梭杆菌。
命名法
在英文的IUPAC系统当中,烷烃链去掉末尾的“e”,加入“ol”,如:“methanol”和“ethanol”。[2]
在中文中,醇的系统命名法其原则为:
- 选择含有羟基最长的碳链作为主链称某醇,从离羟基最近的一端开始编号,在醇名前用阿拉伯数字表明羟基的位置,侧链或其他取代基的位置、数目、名称则依次写在羟基位置之前;
- 当有必要的时写在IUPAC名称之前,如:1-丙醇。CH3CH2CH2OH,异丙醇CH3CH(OH)CH3。
- 当存在更高优先级的官能团如醛、酮或羧酸时,就有必要使用前缀羟基[2],如:1-羟基-2-丙酮(CH3COCH2OH)。[3]
- 脂环醇可按脂环烃基的名称后加“醇”来命名;
- 不饱和一元醇的命名应选择包含有羟基和不饱和键在内的最长的碳链为主链,在编号时应从靠近羟基的一端开始编号,在不饱和键和羟基前表明其位置;
- 多元醇的主链应尽可能选择包含多个羟基在内的最长的碳链,按羟基数而称某二醇、某三醇等,并在醇名前再表明羟基的位置。一些天然醇习惯用俗名如,山梨醇和甘露醇。

IUPAC命名法在科学期刊中被广泛使用,而其精确的定义各种物质的名称对于化学研究非常重要。在其他一些非正式的表达中,醇被使用烷基官能团加上“醇”字来命名,也称“俗名”。如甲基醇、乙基醇;丙醇还是异丙醇取决于羟基处于主链的一级碳上还是在二级碳上。
醇还可基于其直接连接的碳原子的取代情况而被定义为伯、仲、叔(也称为一级,二级和三级)。它们通常被写成通式:伯醇RCH2OH;仲醇RR'CHOH,叔醇RR'R"COH(这里的R, R',R"都定义为烷基)。乙醇和正丙醇都是伯醇,异丙醇为仲醇。前缀仲(sec- 或者s-)和叔(tert- 或者t-)通常为斜体,写在烷基基团前面,以区别是一级、二级或三级醇。如异丙醇有时也被写为:仲丙醇或二级丙醇,而叔丁醇(CH3)3COH)则在IUPAC中命名为:2-甲基-2-丙醇。
| 化学式 | IUPAC命名 | 俗名 |
|---|---|---|
| 单羟基醇 | ||
| CH3OH | 甲醇 | 木醇 |
| C2H5OH | 乙醇 | 酒精 |
| C3H7OH | 异丙醇 | 外用酒精 |
| C5H11OH | 戊醇 | Amyl alcohol |
| C16H33OH | 1-十六醇 | 鲸蜡醇 |
| 多元醇 | ||
| C2H4(OH)2 | 1,2-乙二醇 | 甘醇 |
| C3H5(OH)3 | 1,2,3-丙三醇 | 甘油 |
| C4H6(OH)4 | 1,2,3,4-丁四醇 | 赤藓醇 |
| C5H7(OH)5 | 1,2,3,4,5-戊五醇 | 戊五醇,木糖醇 |
| C6H8(OH)6 | 1,2,3,4,5,6-己六醇 | 甘露醇,山梨糖醇 |
| C7H9(OH)7 | 1,2,3,4,5,6,7-庚七醇 | 庚七醇 |
| 不饱和脂肪醇类 | ||
| C3H5OH | 丙-2-烯-1-醇 | 烯丙醇 |
| C10H17OH | 3,7-二甲基庚-2,6-二烯-1-醇 | 香叶醇 |
| C3H3OH | 2-丙炔-1-醇 | 炔丙醇 |
| 脂环醇类 | ||
| C6H6(OH)6 | 环己烷-1,2,3,4,5,6-六醇 | 肌醇 |
| C10H19OH | 2-(2-丙基)-5-甲基-环己烷-1-醇 | 薄荷醇 |
物理和化学性质
醇类通常在呼吸道内会产生“刺痛”和“绞痛”感。
羟基通常会使分子产生极性。羟基基团会通过氢键和其他同类分子连接(一些大型分子的羟基由于空间位阻而被相邻的基团保护而无法形成氢键),[4]具有氢键就意味着该有机物可用作质子性溶剂。醇分子中有两个相对应的溶解趋势:羟基的极性促使分子易溶于水,而碳链则使分子不溶于水。所以甲醇、乙醇、丙醇易溶于水是由于羟基的亲水效应超过了相对短小的烷基链的憎水效应。具四个碳原子的丁醇稍溶于水则是因为这种平衡恰好间于两者之间。大于等于五个碳原子的醇由于烷基链的憎水效应更强则几乎不溶于水,如戊醇。所有简单的醇类都易溶于有机溶剂。
由于氢键的影响,醇类相对于烃与醚类具有更高的沸点。乙醇沸点为78.29°C,而正己烷(汽油当中主要成分)沸点为69°C,乙醚沸点为34.6°C。
醇类类似于水,在醇羟基(O-H)上可同时展现其酸性和碱性,其pKa在16-19之间,因此酸性比水分子更弱,但醇类仍然可与更强的碱性物质,如氢化钠或活泼金属如钠反应,生成的盐称为醇盐,具有通式:RO-M+。
醇类化合物的氧原子具有孤电子对,即没有成对的电子。与强酸性物质下,如硫酸反应中可表现出一定的弱碱性,如:甲醇如图:
醇还可进行氧化反应以制备醛、酮或酸,它们还可脱水制备烯烃。醇类可与羧酸发生酯化反应以制备酯类化合物,(若先进行活化))还可以进行亲核加成反应。醇羟基氧原子的孤对电子还可让醇分子成为亲核试剂。更多的信息参见醇的反应章节。
当一个醇分子骨架由伯醇替换成仲醇或者叔醇,则会由于氢键的长度变化而使得其沸点和酸性下降。
检验
由于一级、仲醇都可被氧化剂氧化,所以可用酸化重铬酸钾来检验。溶液会由橙色变为绿色(因重铬酸离子被还原至绿色的三价铬离子)。
叔醇不会跟氧化剂反应。
应用
醇可用作于饮料(仅指乙醇)、燃料及科研、医疗或工业原料。乙醇作为饮料的形式从史前以来就开始被人类消费。50%体积浓度的乙二醇水溶液则广泛的应用于抗冻剂领域。
醇类在工业和科学上通常可作为化学试剂,或溶剂。乙醇由于低毒性和对于非极性物质的良好溶解性而广泛的应用于各种药物溶剂,如香水;植物的提取液,如:香草。在有机合成当中,醇类还能充当各种类型的中间体。
乙醇可溶解碘配成:碘酒,在注射前充当杀菌剂和消毒剂。基于乙醇制作的一些肥皂由于它的良好的挥发性而广泛使用。醇类还可以充当一些标本的保存剂。
醇凝胶现在还可以做成洗手液。
实验室合成
下列是实验室范围内,几种广泛应用的醇的合成方法。
一级卤代烃与NaOH水溶液或KOH水溶液反应,可通过亲核取代反应制备伯醇。二级或三级卤代烃由于会发生副反应:消除反应而得不到相应的仲醇或叔醇,只能获得消除产物:烯烃。格氏试剂与羰基化合物发生亲核加成反应,可制备二级或者三级醇。其他的相关反应如:Barbier反应和Nozaki–Hiyama–Kishi反应。
醇可通过羰基化合物(如:醛或酮)与氢化物(如:硼氢化钠或四氢锂铝)还原后,经酸后处理获得。还有一种还原反应可通过异丙烯醇铝还原醛酮以制备醇,即Meerwein–Ponndorf–Verley还原反应。Noyori不对称氢化则是针对β-酮酯以制备不对称的醇分子。
烯烃在浓硫酸催化剂条件下发生水解反应,可制备相应的二级或三级醇。烯烃还可发生硼氢化-氧化反应或羟基汞-还原,这些方法在醇类的有机合成中应用广泛。烯烃、NBS与水反应可发生卤代醇合成反应。胺则能够转化为重氮盐,然后继续发生水解反应制备醇类。通过还原法和水解法制备二级醇如图:
化学反应
醇可视为一种弱酸发生去质子化,以制备醇盐。该过程可通过一种如:氢化钠或正丁基锂的强碱,也可以是和一种金属比如钠或者钾。
- 2 R-OH + 2Na → 2R-O−Na + H2
- E.g. 2 CH3CH2-OH + 2 Na → 2 CH3CH2-O−Na + H2
水与许多醇一样,都具有pKa的属性,因此可与氢氧化钠在上述的反应中形成以下的化学平衡:
- R-OH + NaOH <=> R-O-Na+ + H2O(平衡向左移动)
这里需要指出的是:制备醇盐的碱同样是一种很强的碱(强碱制备弱碱原理),它们与醇盐化合物都是高度对水及氧敏感试剂,即在水汽或空气中很容易变质。
醇羟基的酸性同样还影响烷氧负离子的稳定性,若烷基基团上连有吸电子基团则能够稳定这种形成的醇盐负离子,则该醇会具有更强的酸性。相同原理,若带有给电子基团的醇,其形成的负离子相对更不稳定,则会导致一个不稳定的烷氧负离子具有捕捉质子而回到醇类分子的趋势。
羟基在亲核取代反应中不是一个良好的离去基团,因此中性的醇分子无法参加该类反应。然而若氧原子首先质子化形成R−OH2+,离去基团(水分子)由于更容易脱离而使亲核取代能够顺利进行,如:三级醇和盐酸反应形成三级卤代烃时,醇的羟基通过单分子亲核取代反应被氯取代。若一级或者二级醇与盐酸反应,则必须要添加类似于氯化锌的路易斯酸催化剂,或通过氯化亚砜直接进行这类转化。
- 3 R-OH + PBr3 → 3 RBr + H3PO3
在Barton–McCombie去氧反应中,醇分子与三丁基锡化氢或三甲基硼烷-水络合物通过自由基反应脱氧形成烷烃。
醇分子本身具亲核性,因此R−OH2+能够与ROH进行脱水反应制得醚和水,但这类反应除合成乙醚之外基本上在合成化学中无更多价值。
比起上述一些反应,E1反应消除反应更具实用性,它通过醇来制备烯烃。该类反应通常遵循查依采夫规则,即:总是形成相对稳定的烯烃(这里通常指取代基更多的烯烃)。另一个规律即:三级醇即可发生消除反应,而一级醇则需要更高的温度才可反应。下图是一个酸催化下,醇消除形成乙烯的过程:
醇可与羧酸发生脱水反应合成酯,即常见的Fischer酯化反应,其反应条件为:浓硫酸催化条件下加热回流。
- R-OH + R'-COOH → R'-COOR + H2O
为了使上述反应平衡能够向右移动以得到高收率的酯,必须要移除体系产生的水。有两种常用方法:一种是使用过量的硫酸,第二种是使用迪安-斯塔克装置。酯还可通过醇在吡啶做碱的条件下,和盐酸反应来制备。
伯醇(伯醇)(R-CH2-OH)可发生氧化反应,以制备醛(R-CHO)或羧酸(R-CO2H),而仲醇(R1R2CH-OH)发生氧化反应则通常形成酮(R1R2C=O)。叔醇(R1R2R3C-OH)在一般的条件下通常难发生氧化反应。
直接的氧化伯醇到羧酸通常还需经过相应的醛过程,即:通过一种醛水合物(R-CH(OH)2)的过程,而该中间体可更易于被氧化形成羧酸。

使醇发生氧化反应,以制备醛的试剂很多,其中大多与氧化成酮的氧化剂相似。如:柯林斯试剂或Dess-Martin试剂。若要直接氧化成酸可使用高锰酸钾,或Jones试剂。
毒性

人体能“合理”承受的酒精浓度大约是7%以下,所以纯度高的酒精是不可直接饮用的。大量喝下乙醇(酒精)会导致醉酒(中毒),严重可引起急性呼吸衰竭或死亡。其他醇毒性比乙醇大幅度增加,部分原因是他们需要更长的时间被代谢,部分是因为他们的代谢产生的物质是有毒的。例如甲醇(木醇),被氧化成甲醛和甲酸然后有毒的酸在肝积累醇脱氢酶及甲醛脱氢酶甲酸,可导致失明或死亡。同样,由于会中毒的其他醇类如乙二醇或二甘醇是由于它们的代谢物是也产生乙醇脱氢酶。吸收甲醇的有效治疗是喝下大量酒精,因为酒精中有乙醇,可作竞争性酶抑制剂抑制甲醇与酶产生反应。甲醇本身有毒,镇静作用比乙醇弱。一些较长链醇,如正丙醇,异丙醇,正丁醇,丁醇有较强的镇静作用,但比乙醇有较高的毒性。这些长链醇作为污染物被发现在一些含酒精饮料,被称为杂醇油,许多长链醇用于工业的溶剂和酗酒,导致了一系列不良的健康影响。
在自然当中的形态
醇还被发现于太阳系之外存在,醇同样被发现存在于低密度星系一级行星系统区域中。[6]
参见
参考文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

