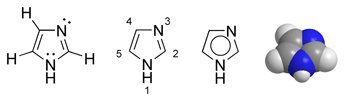
咪唑[註 1](英語:Imidazole),即1,3-二氮唑,是一個五元雜環芳香性有機化合物,化學式C
3H
4N
2。它也是一個生物鹼。白色或淺黃色固體結晶,可溶於水、氯仿、醇、醚,具有鹼性。氫原子在兩個氮原子之間移動,因此存在兩個互變異構體。
| 咪唑 | |
|---|---|
| |

| |
| IUPAC名 1,3-diazole 1,3-二唑 | |
| 英文名 | Imidazole |
| 別名 | 間二氮茂、咁噁啉 |
| 識別 | |
| CAS編號 | 288-32-4 |
| PubChem | 795 |
| ChemSpider | 773 |
| SMILES |
|
| InChI |
|
| InChIKey | RAXXELZNTBOGNW-UHFFFAOYAS |
| EINECS | 206-019-2 |
| ChEBI | 16069 |
| RTECS | N13325 1985-86 |
| KEGG | C01589 |
| 性質 | |
| 化學式 | C3H4N2 |
| 摩爾質量 | 68.08 g·mol⁻¹ |
| 外觀 | 白色或淺黃色固體 |
| 密度 | 1.23 g/cm3 |
| 熔點 | 89-91 ℃ (362-364 K) |
| 沸點 | 256 ℃ (529 K) |
| 溶解性(水) | 易溶 |
| pKa | 14.5 |
| pKb | 6.95 |
| 結構 | |
| 晶體結構 | 單斜 |
| 分子構型 | 平面五元環 |
| 危險性 | |
| NFPA 704 | |
| 閃點 | 146 ℃ |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
咪唑環結構在生物分子中廣泛存在,例如組氨酸和對應的荷爾蒙組胺。很多藥物也包含有咪唑環,例如硝基咪唑和咪唑類抗真菌藥物。[1][2][3][4][5]
發現
早在1840年代,多種咪唑的衍生物就已經被發現。1858年,Heinrich Debus首次合成了咪唑。他合成咪唑的方法是用乙二醛和甲醛在氨中進行反應,所以此法又稱狄博斯法。[6] 這一合成方法雖然效率很低,但目前仍用於合成C取代的咪唑,也是目前工業上合成咪唑的常用方法之一。

在一個微波改性反應中1,2-二苯基乙二酮、苯甲醛和氨在冰醋酸中生成2,4,5-三苯基咪唑(又稱洛粉鹼)。[7]
結構與性質
咪唑為平面五元環狀化合物,易溶於水(以無限比例)和其它極性溶劑。咪唑的兩個氮原子間存在永久偶極,極性很強,偶極矩為3.61D,並且分子間存在氫鍵締合,導致了咪唑具有反常高的沸點(256℃)。分子中存在一個6電子共軛大π鍵,故具有典型的芳香性。與氫以σ鍵相連的氮原子提供一對電子,環內其餘四個原子各提供一個電子成鍵。
1N上有氫的咪唑環中,氫原子可以在兩個氮原子間遷移,存在兩個互變異構體,C-4和C-5是等同的。這兩個互變異構體無法分離,當有取代基時,常以「4(5)-取代咪唑」(如4(5)-甲基咪唑)來命名。
咪唑具有兩性,即同時表現出酸性與鹼性。作為一種酸,咪唑的pKa是14.5,它的酸性比羧酸、酚類與酰亞胺弱,但稍微比醇強。可離解質子在N-1上。作為鹼,咪唑的共軛酸的pKa(上文提到的為pKBH+以避免混淆)大約是7,使咪唑鹼性比吡啶強約六十倍以上,可以和無機酸生成穩定且易溶於水的鹽。體現鹼性的原子為N-3。
咪唑的一些共振結構如下所示:

咪唑比其他1,3-二唑更容易發生親電芳香取代反應,並且反應主要在C-4和C-5上進行。這是因為親電試劑進攻C-2時,有特別不穩定的極限式,生成的中間體將正電荷分佈在氮原子上。例如,咪唑與發煙硝酸/濃硫酸作用,可以很快生成產率很高的4(5)-硝基咪唑;而4,5-二甲基咪唑在劇烈條件下硝化,仍然不能發生反應。

咪唑N-3上的電子雲密度較大,所以烷基化反應一般都先在這個氮原子上發生。一烷基化的產物通過互變異構,又可以產生一個類似於吡啶中的氮原子,因此可以進一步反應,生成二烷基化的產物咪唑鎓鹽。
咪唑的酰基化反應一般也在N-3上發生,但由於酰基是吸電子基,故反應能控制在一元酰基化階段,產物是N-酰基咪唑。
咪唑的活潑氫可以分解格氏試劑,生成咪唑的N-鎂鹽,經異構化後得到C-2取代的咪唑。後者用碘甲烷處理,可以生成1,2-二甲基咪唑。
咪唑可與親雙烯體發生加成,先生成3-鎓鹽兩性離子,然後與另一分子親雙烯體親核加成,生成C-2環化的產物。例如1-甲基-2-乙基咪唑與兩分子丁炔二酸二甲酯反應後,得到8a-乙基-1-甲基-1,8a-二氫咪唑並[1,2-a]吡啶-5,6,7,8-四羧酸四甲酯。
咪唑鹽
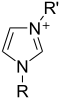
咪唑環上的氮原子被質子化或取代時可以形成咪唑鎓鹽(如氯化咪唑)。這些鹽是咪唑離子液體和很多穩定卡賓的前體。
咪唑也可形成陰離子與金屬成鹽,如咪唑鈉、咪唑鉀,以及不溶性的咪唑銀鹽。咪唑鉀可由咪唑與氫氧化鉀反應得到,它與鹵代烴反應,生成N-烷基咪唑,後者在加熱時可以異構化生成2-烷基咪唑。
製備
除了狄博斯法外,咪唑還可用多種方法合成。如果在反應中引入其它官能基,這些方法也可以應用於咪唑衍生物的合成。在文獻中,這些方法通常按照合成咪唑環時新形成的化學鍵數分類。例如,狄博斯方法在合成咪唑環時形成了(1,2)、(3,4)和(1,5)三個鍵,所以這種方法是一個三鍵合成。以下列出幾個有代表性的合成路線:
- 單鍵合成反應
咪唑環的(1,5)或(3,4)鍵可在α-氨基二乙縮醛與亞氨酸酯作用生成脒再進一步生成咪唑的反應中生成。

- 雙鍵合成反應
高溫加熱1,2-脂肪二胺與乙醇、乙醛或羧酸混合物可生成咪唑環的(1,2)和(2,3)鍵。此反應需要脫氫催化劑如鉑或氧化鋁的催化。

工業上用鄰苯二胺與甲酸反應生成苯並咪唑,用雙氧水處理,開環轉化為咪唑-4,5-二羧酸,最後與氧化銅混合加熱,發生脫羧生成咪唑。或者也可用酒石酸與發煙硝酸和濃硫酸混合攪拌後,得到酒石酸二硝酸酯,然後與氨水、甲醛反應,生成的二羰基丁二酸未經分離便轉化為咪唑-4,5-二羧酸,最後脫羧生成咪唑。
加熱N-取代α-氨基酮與甲酰胺可形成咪唑環的(1,2)和(3,4)鍵。產物是一個1,4-取代咪唑,如果R1 = R = H,則產物是咪唑。

此外,咪唑還可由鏈中含有氮原子的1,4-二羰基化合物,在與銨鹽加熱時環化得到。原料二酮可通過α-鹵代酮發生氨解得到α-氨基酮,然後再與酸酐或酰氯反應製得。

- 四鍵合成反應
這是一個常見的生成取代咪唑的方法,由狄博斯法改良而來,產率一般較高。原料為取代乙二醛、醛、胺和氨或銨鹽。[8]

- 由其他雜環化合物生成
咪唑可由1-乙烯基四唑的光解反應合成。如果1-乙烯基四唑可以大量地由有機錫化合物(如2-三丁基錫基四氮唑)製得,反應收率較高。

生物學意義和應用
在許多重要的生物分子中含有咪唑官能基。最常見的是含有咪唑側鏈的組氨酸。組氨酸出現在許多蛋白質和酶中,也是血紅蛋白的重要結構組成,對其配位能力具有重要意義。蛋白質中的His殘基可以扮演酸鹼兩性基團,因此常是酶中發生酸鹼催化機理的部分(如碳酸酐酶)。組氨酸可發生脫羧生成組胺,這也是一種常見的生物分子,具有降低血壓,收縮子宮等功能。細胞釋放的組胺常是導致蕁麻疹的原因之一。組氨酸生成組胺的反應如下所示:

咪唑一個用途是在金屬螯合親和層析(IMAC)中用於His標籤蛋白的純化。標籤蛋白與層析柱表面珠孔內的鎳離子介質發生結合,過量的咪唑通過層析柱,將與鎳配位的標籤蛋白洗脫下來,得到高純度的目標蛋白。
咪唑是許多藥品的重要組成部分。許多殺菌劑和抗真菌、抗原蟲和抗高血壓的藥物中含有合成咪唑。咪唑是茶葉和咖啡豆中含有的茶鹼分子的組成部分,具有刺激中樞神經系統的作用。通過干擾DNA的活動抑制白血病的抗癌藥物巰嘌呤中也含有咪唑。
工業應用
許多工業上的重要化合物含有咪唑衍生物。耐高溫的聚苯並咪唑材料(PBI)含有苯並咪唑(咪唑與苯環稠合)和另一個苯環相連的結構,PBI可用作阻燃劑。咪唑的各種化合物也常見於攝影和電子產品中。
參見
註釋
參考文獻
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.

