Loading AI tools
病毒 来自维基百科,自由的百科全书
嚴重急性呼吸綜合症冠狀病毒2型[3](英語:severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)[6],是一種具有包膜的正鏈單股RNA病毒,屬於冠狀病毒科乙型冠狀病毒屬嚴重急性呼吸道綜合症相關冠狀病毒種[10]。它的基因序列和SARS病毒及MERS病毒屬於同一譜系但不同進化枝,是已知的第七種可感染人類的冠狀病毒。病毒的宿主包括哺乳動物和禽類動物,它造成了於2019年底爆發的2019冠狀病毒病(COVID-19)[11]。該病毒可通過人類上呼吸道入侵人體,以多種細胞表面表達的ACE2為受體達到感染;主要感染器官包括肺部、心臟、腎臟等多個主要器官[12][13]。
| 嚴重急性呼吸綜合症冠狀病毒2型 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||
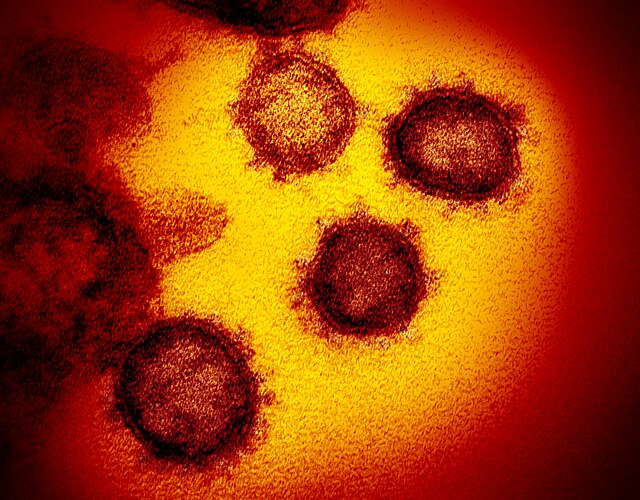
| SARS-CoV-2的穿透式電子顯微鏡影像,病毒表面的棘蛋白結構清晰可見。 | |||||||||||

| |||||||||||
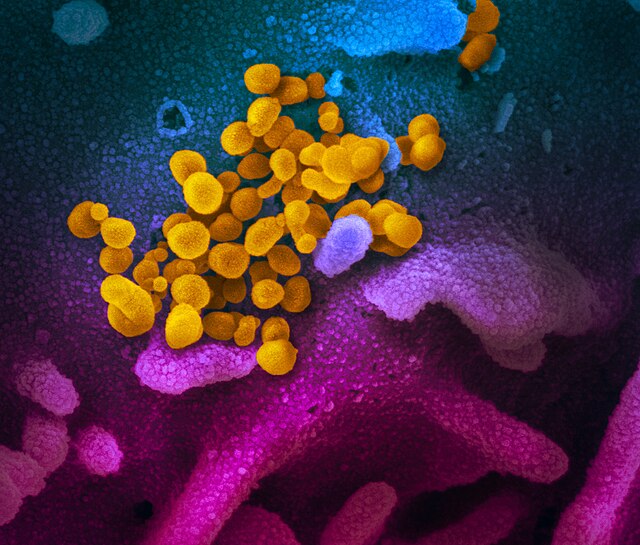
SARS-CoV-2的外部結構模型,當中的球狀物為原子。[1]
| |||||||||||
| 病毒分類 | |||||||||||
| (未分級): | 病毒 Virus | ||||||||||
| 域: | 核糖病毒域 Riboviria | ||||||||||
| 界: | 正核糖病毒界 Orthornavirae | ||||||||||
| 門: | 小核糖病毒門 Pisuviricota | ||||||||||
| 綱: | 小南嵌套病毒綱 Pisoniviricetes | ||||||||||
| 目: | 套式病毒目 Nidovirales | ||||||||||
| 科: | 冠狀病毒科 Coronaviridae | ||||||||||
| 屬: | 乙型冠狀病毒屬 Betacoronavirus | ||||||||||
| 種: | 嚴重急性呼吸綜合症冠狀病毒2型
Severe acute respiratory syndrome-related coronavirus | ||||||||||
| 毒株: | 嚴重急性呼吸綜合症冠狀病毒2型
Severe acute respiratory syndrome coronavirus 2 | ||||||||||
| 中華人民共和國湖北省武漢市是疫情最初被發現並爆發的地點 | |||||||||||
| 異名 | |||||||||||
| |||||||||||
2019年12月,這一病毒所導致的2019冠狀病毒病在中華人民共和國湖北省武漢市首次被報告,2020年1月中旬在疫情爆發期間,從一位陽性患者樣本的核酸檢測以及基因組測序發現此病毒[14][15][16],目前野外來源與中間宿主尚不明確,人類受病毒感染的患者目前沒有獨特的臨床徵狀,最常見徵狀為發燒或寒顫、咽痛,常伴隨肌肉酸痛及胳膊或腿沉重,頭痛,新發和持續咳嗽,嚴重疲勞,新發嗅覺或味覺改變,胸悶和胸痛,部分伴隨食慾下降等腸胃不適以及睡眠障礙[17][18]。在現有的臨床治療過程中,有多種病毒抑制藥物被採納[19]。
截至2023年12月6日,全球已累計報告772,138,818名確診病例,其中逾6,985,964人死亡[20]。
在過往會將新發現的冠狀病毒暫時稱為新型冠狀病毒,包括在2012年發現引發中東呼吸綜合症(MERS)的冠狀病毒及其病症都曾被稱為「新型冠狀病毒」及「新型肺炎」[21][22]。2015年5月,世衛組織發佈新型人類傳染病命名最佳實踐,以期減少在對新興病原體進行命名時對某些群體或經濟部門造成污名化[23]。該病毒被發現後,世界衛生組織暫時將其命名為Novel Coronavirus(即「新型冠狀病毒」),縮寫為2019-nCoV[24][25]。2020年2月11日,國際病毒分類委員會的冠狀病毒科研究小組確認該病毒與SARS-CoV形成姊妹支,正式將該病毒依據分類學和已有慣例命名為「SARS-CoV-2」(全稱:Severe Acute Respiratory Syndrome Coronavirus 2)[6],中國大陸一些民間組織將其全名轉譯為「嚴重急性呼吸系統綜合征冠狀病毒2」[26],世界衛生組織中文官網則轉譯為「嚴重急性呼吸綜合征冠狀病毒2」[5]。台灣則譯作「嚴重急性呼吸道症候群冠狀病毒2型」。
ICTV的CSG小組對命名進行了解釋,指出對病毒的命名是基於唯一可確定的特徵,即病毒的基因組序列。病毒保守蛋白的變異表明,它和SARS冠狀病毒種屬於同一簇,但與SARS和MERS具有顯著不同。由於遺傳學上有關聯,ICTV將病毒歸類於SARS相關冠狀病毒種,並產生出SARS-CoV-2這一名字。ICTV指出,儘管命名相似,對SARS-CoV和SARS-CoV-2病毒引發的疾病需要區別看待。[6]2020年4月30日,ICTV發表一種新設計的病毒學分類標準,SARS-CoV-2與其他多種冠狀病毒沿用部分舊有的雙名分類系統,與伊波拉病毒一同劃歸於最高等級核糖病毒(Riboviria)。[27]
石正麗等病毒學家於2020年2月19日對ICTV的命名提出異議,認為從生物學、流行病學及臨床數據上SARS-CoV和SARS-CoV-2有顯著區別,需要另行命名。[28]
國際病毒分類委員會冠狀病毒科研究組(CSG)建議全球研究者對分離病毒株統一以「SARS-CoV-2/Host(宿主)/Location(分離地點)/Isolate/Date(日期)」之格式命名以便於交流[6]。
另外,也有研究文獻使用「human coronavirus 2019」(人類冠狀病毒2019,HCoV-19或hCoV-19)[29][30][31][32]。
嚴重急性呼吸綜合症冠狀病毒2型是一種具有包膜的、不分節段的正鏈單股RNA病毒,顆粒呈圓形或橢圓形,直徑約80~120nm,屬於網巢病毒目冠狀病毒科乙型冠狀病毒屬。[17][33][34][35][36]病毒粒子被宿主細胞提供的脂質雙層所包裹,其中含有核酸及核衣殼蛋白,有三種主要蛋白:包膜蛋白(E蛋白)、膜蛋白(M蛋白)和棘蛋白(S蛋白)。[33]此病毒每組基因組長度約三萬個核苷酸左右,[16][37][38]基因序列顯示嚴重急性呼吸綜合症冠狀病毒2型 屬於乙型冠狀病毒屬譜系β(Betacoronavirus Lineage β, Sarbecovirus)進化樹中分支較長的一種病毒,[39]與中華菊頭蝠中發現的冠狀病毒相似,例如MERS-CoV或SARS-CoV。[16]對病毒的生物遺傳學分析顯示,同屬人類冠狀病毒的SARS病毒分離株AY274119[40]相比MERS病毒分離株KC164505[41]、JX869059[42]等在親緣關係上距離嚴重急性呼吸綜合症冠狀病毒2型 病毒更近。[43]
2020年1月27日,中國疾病預防控制中心分離出第一株嚴重急性呼吸綜合症冠狀病毒2型 。[44][註 1]在生物體外培養的狀況下培養期約需6天。[17][註 2]由中國疾病預防控制中心領銜的一項基因研究顯示,新型冠狀病毒與已有的類SARS病毒變種(序列:bat-SL-CoVZC45, MG772933.1)有86%的相似性。[45]其他研究則進一步對比了其餘同屬的病毒基因,認為新型冠狀病毒和SARS及類SARS病毒變種共享源頭為HKU9-1。[46][47]基於Nankai CDS編碼區的一項初步研究也顯示,SARS-CoV-2病毒傾向於和SARS同源於中華菊頭蝠。[48]另一項研究指出,SARS-CoV-2病毒和類SARS的CoVZC45及CoVZXC21可以達到89%的序列同一性,後兩者的基因都採集自浙江舟山,無除中華菊頭蝠外的來源。[49][50]通過觀察,13個SARS-CoV-2病毒樣本中有9種基因分型,集中存在可變轉譯。[48]對SARS-CoV-2S蛋白的介導受體結合區和膜融合區分別進行基因測序後發現,與CoVZC45和CoVZXC21的膜融合區相比有93%的同源性,介導受體結合區則只有68%的同源性。在同源建模分析中,SARS-CoV-2和SARS-CoV都在RBD中留有50個保守氨基酸,兩者RBD的外部子結構十分相似。[49]
有研究利用了SARS-CoV-2病毒WIV04的基因序列與另一類SARS變種蝙蝠冠狀病毒RaTG13(Bat-CoV RaTG13)進行對比,發現兩者相似度有96%。作者利用Bat-CoV RaTG13和SL-CoV ZC45為對照組,基本確認新型冠狀病毒同SARS一樣利用自己RBD(受體結合域:receptor binding domain)的S1蛋白與人體血管緊張素轉化酶2(hACE2)進行結合。[12]在對其他冠狀病毒的對比中,新型冠狀病毒的RBD被認為介於無法和hACE2受體結合的HKU3-4和自由結合能最強的rSHC014之間,但弱於SARS-CoV。[50]針對新型冠狀病毒和RaTG13的深入對比發現,由於兩者的ORF1a、ORF1b以及接近一半的RBD域有極高的同一性,NCoV和RaTG13在β屬CoV中可以獨立再被分類為一譜系。另外的研究對2019年採集的來自中華人民共和國雲南的蝙蝠冠狀病毒RmYN02進行了對比,指出儘管基因組整體上與SARS-CoV-2的同一性不如RaTG13,但是在1ab基因的對比中同源性高達97%,推測了蝙蝠冠狀病毒轉化到人類冠狀病毒的過程中重組的可能性。[51]


多項研究指出,儘管RaTG13或RmYN02的變異難以造成2019年爆發的疫情,但支持新型冠狀病毒來源於蝙蝠的說法,且非嵌入產物。[52][51][53]另有研究表示,由於現有同一性最高的蝙蝠冠狀病毒與新型冠狀病毒也無超過90%的序列重合度,因此現今所認知的任何單一蝙蝠冠狀病毒都不是SARS-CoV-2病毒的直接祖先,而是多種病毒在自然選擇和多重重組的進化下產生的結果。[49][51][52]
SARS-CoV-2從蛋白組成上類似SARS-CoV和MERS-CoV,基因組都由結構蛋白、非結構蛋白和輔助蛋白編碼。[54]據電鏡觀察,每個病毒顆粒平均可達到三十多個核蛋白(RNP)。[55]其中結構蛋白包括含有受體結合域的S蛋白,而非結構蛋白則包括了3-胰凝乳蛋白酶樣蛋白酶(3CLpro)、木瓜蛋白酶樣蛋白酶(PLpro)、解旋酶(helicase)、和RNA依賴性RNA聚合酶(RdRp)。[54][56][57]3CLpro和PLpro在病毒的1ab基因的多個位點上運行,主要功能是幫助病毒RNA轉譯。[58]有研究對SARS-CoV-2的3CLpro晶體結構進行解析,指出這是可以抑制病毒複製的靶標之一。[54]由於SARS-CoV-2病毒含有的蛋白種類及與人體蛋白的PPI較多,現有研究無法完整分析所有不同蛋白的作用。[59]對病毒蛋白的細胞生物學分析顯示,不同功能對應的蛋白如下:DNA複製(Nsp1)、表觀遺傳和基因表達調控(E蛋白、Nsp5、8、13)、囊泡運輸(E蛋白、Nsp6、7、10、13、15)、脂質修飾(S蛋白)、RNA加工和調控(N蛋白、Nsp8)、泛素化調控(ORF10)、信號轉導(N蛋白、Nsp8、13)、核轉運機制(Nsp9、15)、細胞骨架(Nsp1、13)、線粒體(Nsp4、8)和細胞外基質(Nsp9)。[59]
對乙型冠狀病毒屬譜系α中的OC43和HKU1的一項研究表明,儘管進化枝和其有限的宿主導性相符,在多重進化下,人類冠狀病毒的血球凝集素酯酶蛋白中的凝集素域幾乎全部被刪除,相反在動物冠狀病毒中這一蛋白域得到保留。[60]在如丙型流感中,血球凝集素酯酶蛋白有受體結合的作用,但它在冠狀病毒中為受體破壞酶。[61]因此,凝集素作用的缺失會增強病毒對人體結合的親和力,也被認為是適應人類呼吸道唾液醣蛋白並成功在呼吸道上皮細胞內進行複製的進化機制。[60]有研究對新型冠狀病毒的基因突變進行追蹤,發現從來自中國大陸外的樣本中發現成簇的氨基酸突變。[62]對已知的感染者體內的病毒的基因突變分析得知,在人群傳播期間,病毒未經歷劇烈的適應性變化。研究猜測,這可能說明病毒已經進入適應性進化的遲緩期。[62]對多名被感染患者體內的病毒樣本進行分析後,有研究發現了一個在位點27848-28229中存在的382nt缺失突變。由於這一部分覆蓋了病毒的ORF8基因,刪除了ORF8的轉錄調控序列(TRS),猜測認為因ORF8基因對病毒在人群中傳播的作用,這一突變可能暗示了病毒已經適應人體。[63]
SARS-CoV-2病毒的棘蛋白(S蛋白)屬於三聚體I類融合蛋白,其中分S1和S2兩個亞基以及一個跨膜錨,表面刺突長度約23nm,寬7nm,S1解離時會造成S2的構象變化。[64][33][65]在包膜刺突的表面具有宿主衍生出來的聚糖,而每一個三聚體都具有66個糖基化位點,SARS-CoV-2的糖基化已被發現可以促進其免疫逃避。[65][66][67]在現有研究中發現,病毒可通過出芽的方式進入ER-高爾基體中間腔室(ERGIC)內腔。而在病毒衍生材料上複雜的聚糖中,醣蛋白會受到高爾基體駐留的加工酶的作用。[65]

對SARS-CoV-2的受體結合域(RBD)與ACE2複合物的晶體結構進行測定後知,該晶體含C、N、O、S等元素,屬於四方P[68]的P41212空間群。[33][69]RBD本身含有由反平行肽鏈組成的β1、β2、β3和β6四個β摺疊層。在這一段蛋白核心中,於β3和β6中間有一段額外的插入,包括β4、β5的肽鏈以及α4和α5螺旋,形成了RBM,它主要含有負責與hACE2結合中的接觸單元蛋白。[70]在表面等離子共振實驗中,hACE2對RBD的結合親和力為15.2nM;對S蛋白整體則為14.7nM。[70][64]在對潛在中間宿主的穿山甲中分離的冠狀病毒Pangolin-CoV-GD基因組比較後,新型冠狀病毒的RBM中的5個關鍵氨基酸與Pangolin-CoV完全一致,而RaTG13則只共享有1個關鍵氨基酸。[71]有學者指出,RaTG13和新型冠狀病毒的RBM之間的區別被限制於其第二環,這可能反映出從動物宿主傳播到人類中間的基因重組事件。[72]有其他研究有同樣的疑問,指出儘管RaTG13與SARS-CoV-2最為同源,但是RBD本身與穿山甲最同源,懷疑RaTG13與Pangolin-CoV之間可能有重組事件。[71][73]

現有認知中,病毒的RBD突變是導致SARS-CoV-2與hACE2的親和力更高的原因。[52][74]有研究構建了SARS-CoV-2的RBD的進化樹,結果顯示它可以和多種冠狀病毒如RaTG13、SZ16[75]、ZS-C[76]、Sino1-11[77]等形成一簇,其他冠狀病毒如Rm1[78]、ZC45和ZXC21可以形成另一簇。研究後利用了病毒RBD中N481至N501這一段與hACE2結合的氨基酸殘留物進行的進化樹分析,並構建出了一樣的結果。[79]
對相近的SARS病毒進行對比發現,SARS-CoV-2病毒在S蛋白內的23619-23632位點中有四個獨特的氨基酸插入:681-PRRA-684。[73]在其他冠狀病毒中,類似的插入位於S1和S2結構域之間的結構邊界,但PRRA插入是獨有的,在成對鹼性氨基酸蛋白(弗林蛋白)中創建了潛在裂解位點序列RXXR。[73]有研究利用RmYN02進行分析,發現RmYN02的S蛋白與SARS-CoV-2的同一性只有72%,但是RmYN02在S1和S2剪切位點有自然氨基酸插入。[73]儘管RmYN02沒有復刻SARS-CoV-2中存在的這種多元裂解,它證實了SARS-CoV-2原先在其譜系中獨有的這一結構來源於某種自然演化的結果。[51][80]另有研究發現,SARS-CoV的RBD基因組中有六個氨基酸與hACE2的結合能力相關,分別是Y442、L472、N479、D480、T487和Y491,它們與SARS-CoV-2的L455、F486、Q493、S494、N501和Y505相對應。[81]其中Q493和P499經過其他研究分析,認為和病毒與hACE2的結合過程中的界面穩定相關。[79]結合其他對穿山甲冠狀病毒和RaTG13的研究後,有研究者發現,廣東分離的穿山甲冠狀病毒Pangolin-CoV-GD在這六個關鍵氨基酸殘基上和SARS-CoV-2相同,RmYN01、RmYN02則和RaTG13一樣,只存在一個相同的關鍵氨基酸殘基。[51]其他研究認為,這六個氨基酸中五個與RaTG13相比有了突變,導致了包括人類在內的多種擁有相同受體的動物都會與SARS-CoV-2有更高的受體親和力,但是與類SARS病毒相關的如齧齒類動物、麝貓等動物會具有更低的受體親和力。[74][82][83]
2020年4月,有實驗室成功合成SARS-CoV-2,這類病毒樣本可以被用於相關的動物模型、宿主分析、疫苗研發等多種研究。[84][85]
SARS-CoV-2病毒現有的參考病毒基因為NC045512,[86]病毒的基因組在2019-20年的疫情早期被發現約120個位點上出現了突變,均勻分佈於十個編碼區內。[87]多個研究認為,SARS-CoV-2的變異速度相比於SARS-CoV較慢。[46][88]目前的病毒樣本顯示,不同毒株中展示的反覆突變主要由免疫系統的宿主RNA編輯誘導。[89]

在對SARS-CoV-2的進化分析中顯示,RmYN02和RaTG13是在親緣關係上最相近的。對RBD單獨組建的進化樹則顯示,SARS-CoV-2在接觸人群前,經歷過多次S蛋白重組事件,MP789、RaTG13等穿山甲及蝙蝠病毒與SARS-CoV-2在這方面具有最密切的相關程度。[51][90]由於RNA依賴的RdRp基因系統分析幾種不同的病毒形成了不同的亞群,研究者尚未確定不同病毒的進化路徑和重組過程。[51]
在2020年的疫情中,對來自不同地區的SARS-CoV-2病毒毒株分析顯示出少量的同義及非同義突變。其中病毒的ORF8、ORF1a和ORF9的非同義突變率最高,包括S蛋白在內的其他基因則相對保守。[88]在印度地區傳播的病毒樣本顯示,部分突變位點屬於病毒的RBD。一項研究認為,在SARS-CoV-2的R408位點的突變使得它從親水轉變為疏水,懷疑對病毒與hACE2的親和力有影響。[88]但對來自不同進化枝的毒株進行的臨床分析顯示,SARS-CoV-2本身的變異沒有對宿主的臨床徵狀有顯著的影響。[91]有研究者對內源性脫氨酶介導的病毒RNA編輯進行了分析。對病毒轉錄組的SNVs分析表示,ADARs介導的A-I可能導致了A-G/T-C轉換,而APOBECs介導的C-U可能導致了C-T/G-A轉換。SARS-CoV-2所有基因中,ORF6基因被觀察具有最高的編輯率。[92]
有研究針對病毒的部分位點突變,進行了分型,分為L型和S型[93][94]。這一分型研究針對SARS-CoV-2病毒在ORF8基因28144位點上的C-T非同義突變進行了分析,將對應氨基酸為白氨酸的列為L型,絲氨酸則為S型。[94]但是有其他研究者指出,這一分型在分析方法和結論上均有顯著差錯。[95]批評認為,單位點的非同義突變在沒有證明為功能性突變時,單依靠這一個突變無足夠的證據對病毒進行分型,且無法成為分型的理由。[95]對研究中利用的基因進行突變分析發現,沒有任何突變對病毒的致病性和傳播率有顯著影響。[95][96]還有其他多位學者,也對分型的研究持懷疑態度,指出包括對病毒進化關係的推理、樣本選擇等多個方面的錯誤。[95][97]
在2020年初,一株致病性較弱的SARS-CoV-2曾流行於新加坡、澳洲、西班牙等地。這一分支的病毒的ORF8蛋白較標準樣本缺失382個核苷酸,影響了病毒的轉錄效率。這一特點造成患者在病毒載量沒有顯著區別的情況下,呈現較輕的臨床體徵,相關的細胞因子水平也較低。[98]這株病毒最初被發現時僅被用於確定病毒對人群的適應性,後期研究經由臨床數據整合以Δ382指代具有這一特點的病毒株。[63][98][99]8月,香港出現全球首例二度確診的病例,該病例在香港首次確診後康復出院,在四個月後到西班牙旅遊返回時再度確診,比對兩次感染的病毒基因,發現有24個核苷酸不同,9種蛋白氨基酸數量也不一樣;研究團隊還發現,雖然新冠肺炎康復者的血清中有抗體,但部分人體內抗體會在數個月後逐漸下降。[100]
2020年12月31日,世衛組織通報嚴重急性呼吸綜合症冠狀病毒2型自出現以來已出現四種變體,其中三種傳播力增強[101];截至2023年2月10日,已發現傳播力增強的變異病毒有Alpha、Beta、Gamma、Delta與Omicron等。[102][103]

根據現有認知,病毒具有熱敏感性,暴露在紫外線下或處於56℃高溫環境下30分鐘可達到滅活效果。[19]對病毒的實驗顯示,它在室溫環境中可存活長達9天,將病毒置於92℃的環境中15分鐘比起60℃環境中60分鐘有更好的滅活效果。[104]同時,利用乙醚、75%乙醇、含氯消毒劑、過氧乙酸和氯仿等脂溶劑均可有效滅活病毒,氯己定不能有效滅活病毒。[17]據研究表明,病毒粒子可在空氣及物體表面長時間存活,病毒在不同材質組成的表面可保持感染性長達2小時至9天。[105][106]
現在對SARS-CoV-2理化特性的認識多來自對SARS-CoV和MERS-CoV的研究。這一病毒能以動物為中介傳染給人類,且具有人傳人的能力。[107]新型冠狀病毒雖然被證明和SARS-CoV的基因只有79%的相似度,但它也可以藉由hACE2作為受體結合,通過呼吸道上皮細胞進入肺部進行複製過程為主,[108][109][110]但腸上皮細胞也較為易感。[111]其主要作用對象被發現也是與SARS相同的T淋巴細胞。[112]在SARS-CoV-2感染宿主時,hACE2的表達被認為主要局限於II型肺細胞、吸收性腸上皮細胞和鼻黏膜分泌細胞。[113]而人類的結膜及角膜組織中也被發現有較高表達的hACE2和TMPRSS2,是除呼吸道外的病毒主要感染門戶。[114]在接觸宿主細胞時,病毒的S蛋白會經歷特定的構象變化,使之RBD區域暴露後與hACE2相結合,接着通過促進S2蛋白介導與細胞的膜融合完成感染的全過程。[64][115][116]有研究發現,SARS-CoV-2和RaTG13、MP789、GX/P5L在RBD的外子域中擁有保守的二硫鍵,另一種病毒RmYN02的RBD內則有氨基酸缺失,形成更短的環,可能會造成構象變化。這一特徵被懷疑和病毒與hACE2受體結合的能力相關。[51]其他研究指出,新型冠狀病毒的RBD中有可變的關鍵性氨基酸殘基,對hACE2受體的作用過程與SARS可能有一定差異。[49][73]

現已知SARS等冠狀病毒S蛋白進入標的細胞取決於與hACE2受體的結合作用以及細胞蛋白酶對S蛋白的啟動作用,SARS的S蛋白與其受體hACE2結合是靠細胞絲氨酸蛋白酶TMPRSS2來引發的,與它有76%氨基酸同一性的新型冠狀病毒被發現有相似的機能。[82][117][118][119]在現有認知中,新型冠狀病毒與SARS在序列及傳播途徑的相似無法確切證實兩者之間有相似的生物學特性。一項初步研究對比了包括SARS、MERS以及新型冠狀病毒在內的多種同屬病毒,發現了在新型冠狀病毒RBD中的RBM,懷疑其中負責和hACE2結合的序列與SARS相同,且在其餘無法通過hACE2結合的Bat-CoV中未發現同樣的序列。研究表示,在實驗新型冠狀病毒進入Caco-2細胞時,使用針對TMPRSS2的絲氨酸蛋白酶抑制因子卡莫司他後,有效阻止了病毒的入侵;相反的,針對CatB/L的抑制因子E64d在293T細胞上無效果。這一實驗結果初步表明新型冠狀病毒的S蛋白也是由TMPRSS2引發的,並可在呼吸道上皮細胞上進行膜融合。[82][120]
儘管SARS-CoV-2和hACE2的結合親和力相比較SARS-CoV高10-20倍,但還沒有研究確認SARS-CoV-2的膜融合能力。[121]有研究發現,TMPRSS2和TMPRSS4都可以增強其膜融合活性。[122]SARS-CoV在S1上的RBD與標的細胞中的hACE2結合後,S2中的七肽重複域HR1和HR2會互相作用,形成一個6-HB核心,促進病毒的膜融合。[123]因此有研究指出,可以透過辨識SARS-CoV-2的6-HB核心來確立膜融合的結構基礎。[124]有其他研究發現,SARS-CoV-2病毒可以經由弗林蛋白介導,通過蛋白酶裂解來觸發膜融合。在SARS病毒中引入RXXR裂解位點後,會增加病毒的膜融合活性。[73]
在對冠狀病毒和hACE2受體進行結合的研究中,發現hACE2以二聚體形式存在,儘管同時有開放和關閉兩種構象,對與病毒的互相識別無影響。[125]研究發現,hACE2通過PD結構域與病毒的S蛋白進行結合。[125]有研究者指出在病毒感染人體的過程中hACE2起到了雙重作用。[126]曾在多項研究中,胃腸道被認為是新型冠狀病毒感染人體一種替代途徑。[107][110]因此研究者指出,當新型冠狀病毒入侵人體後,由於hACE2本身在結腸細胞中的表達與人體免疫、調節病毒性感染正相關,會因被病毒下調表達而活化腎素-血管緊張素系統(RAS)。[126]由於RAS和人體血壓等關鍵體徵有關,hACE2不但對冠狀病毒有介導作用,也會進一步導致人體免疫力下降。[126]同時,因為hACE2在上呼吸道上皮細胞中會被IFN標記為干擾素刺激基因(ISG),SARS-CoV-2可以上調hACE2的表達來增強感染。[113]
冠狀病毒普遍被認為在細胞質進行複製和轉錄,其中只有它的RdRp是完全保守的。[127]對SARS-CoV的一項研究顯示,RdRp的一種聚合酶nsp12起到了組成病毒的蛋白激酶的作用,其中其他兩種nsp7和nsp8則被推測用於和nsp12共同組成更穩定的結構。[128]現認為,nsp12作為RdRp的催化亞基,核心功能在於參與病毒複製的過程。[128][129]在nsp7和nsp8兩個輔因子的幫助下,nsp12可以更好的與RNA模版結合。nsp8分子會通過nsp7介導,構象進行變化,隨後形成產物RNA向上游退出路徑上的結構性平台,從而協助nsp12。[129]其他研究發現,SARS-CoV-2和SARS-CoV病毒中的這一結構都具有其他病毒如套式病毒的NiRAN特徵結構域,RdRp的N端則發現一個獨特的β髮夾結構域。[128][130]研究利用電鏡對這一結構顯微達到2.9Å的解像度,指出SARS-CoV-2和HCV的ns5b聚合物進行對比後,可能可以解釋抗病毒藥物瑞德西韋的效應分子在抑制RdRp時的作用機制。[130]現有的研究指出,瑞德西韋在使用中摻入RdRp第一個複製的鹼基對,從而可以終止RNA鏈的延長。[131]另一方面,在病毒進行複製過程中,有多聚蛋白pp1a和pp1b的參與,它們的蛋白水解主要依賴於3CLpro。這類蛋白酶與RdRp同為藥物靶點之一。[132]
對SARS-CoV-2感染細胞的轉譯組和蛋白組分析顯示,人體內多條細胞通路的蛋白質水平都發生顯著變化。其中,與RNA修飾或碳代謝有關的蛋白水平顯著上升,而與膽固醇代謝相關的蛋白水平則顯著下降。[133]根據現在的病毒學模型及臨床測試顯示,SARS-CoV-2病毒會入侵以肺為主的器官,也有發現它會直接攻擊外周免疫器官並導致多種細胞死亡。[134]免疫熒光法分析顯示,病毒可在淋巴結的CD169+巨噬細胞中發現,但無法在CD3+ T細胞或B220+ B細胞中發現。這一研究猜測病毒抗原誘導了Fas的加強,並因此介導了淋巴細胞減少症的產生。[134]
除人類外,貓和狗等寵物也會成為SARS-CoV-2的宿主,另外多種用於構造傳染模型的動物如老鼠、雪貂、倉鼠等都可以被感染。[135][136][137]其中,雪貂的主要臨床徵狀為體溫升高以及急性支氣管炎。[136]有研究發現,貓科動物也可以被感染,且具有飛沫傳染的能力。[135][138]目前的研究發現,狗、雞、鴨等動物難以檢測到高濃度的病毒粒子,表明SARS-CoV-2在它們身上的複製能力相對弱於人類和其他動物。[135]
在包括狗、倉鼠等動物中所檢測到的SARS-CoV-2序列與在人群中傳播的病毒序列相比沒有差異。[137][139]現有研究支持動物之間的傳染以及人向動物的單向傳染,而沒有證據證明兩者之間具有雙向傳染的能力。[140]
印度在六月發生首例亞洲獅感染後病死的事件。[141]
SARS-CoV-2與相關病毒株的系統發生樹[142][143] :
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
SARS-CoV 79% | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

SARS-CoV-2病毒進入人體後,會引起先天免疫系統的免疫應答。其中,免疫系統會在病毒複製過程中介入並抑制病毒的傳播,包括會產生特異性抗體等。[92][151]對抗體的識別和使用可以幫助治療COVID-19患者。[151]
SARS-CoV-2進入人體後,有研究者指出它會活化CD4+ T淋巴細胞,成為Th1輔助細胞。Th1分泌出顆粒白血球-巨噬細胞集落刺激因子(GM-CSF)導致IL6高表達的炎性因子CD14和CD16的出現,加速肺炎發展。對患有COVID-19的患者進行觀察發現,他們的肺部呈現出大量炎性細胞浸潤現象,研究猜測Th1在進入肺循環後會起到免疫破壞作用,導致肺功能障礙乃至臨床死亡。[152]而通過單細胞轉錄組測序,也可發現由於SARS-CoV-2感染主要為上皮和巨噬細胞亞群,導致肺泡巨噬細胞減少顯著,炎性單核白血球和嗜嗜中性顆粒白血球增加並改變了殺傷性CD8+ T細胞的比例。[153]
通過對免疫微環境的觀察可發現,具有不同程度臨床徵狀的COVID-19患者的免疫學表現也極為不同。[153][154]來自重症患者的BALF表明,FCN1+巨噬細胞逐漸增多並取代了原有的肺泡巨噬細胞,且其中mDCs和pDCs的相對比例較輕中症患者更低。單核白血球來源的巨噬細胞具有相對較高的炎症性,並產生出如IL-1β、6、8等炎性細胞因子。[154]相反的,輕症患者體內會活化更高水平的CD8+ T細胞,從而產生更多的免疫效應分子:XCL1、ITGAE、CXCR6以及ZNF683。[153]CD8+ T細胞在輕症患者體內已知作用有細胞活化、遷移和上調細胞因子相關途徑的基因;在重症患者體內則具有轉譯啟動、細胞穩態以及核苷酸代謝等作用。[154]被SARS-CoV-2感染的人類通常是因為細胞因子風暴的出現而進入重徵狀態,其中已經患有糖尿病的患者出現嚴重的併發症而死亡的幾率相較普通COVID-19患者有顯著差異。[13][155]有研究建議,糖尿病與人體對病毒的免疫能力密切相關,包括人體先天免疫系統以及相關的心肺功能健康程度。[156]一項研究指出,其他如IAV、HKU9-1等多種病毒的複製以及免疫細胞對能量的需求都造成人體內葡萄糖代謝水平的增強。[157]此研究認為,血糖水平和炎性細胞因子的水平呈正相關關係,其中起到關鍵作用的是轉錄因子IRF5。研究建議,抑制合成UDP-GlcNAc的OGT酶和IRF5可以提高人體對包括SARS-CoV-2在內的病毒免疫效率。[157]
對病人的臨床分析顯示,血型對於病毒對人體的易感程度有影響。[158]這一研究採納對SARS-CoV的分析,比較在2019年爆發的疫情中的病人血型,認為A型血相對於其他血型如O型血普遍會使得SARS-CoV-2相關風險增加。[158][159]在其他的病例報告中,有發現人體針對SARS-CoV-2的免疫反應相似於普遍的季節性流感。報告稱,在病患血液中發現ASC、TFH、CD4、8以及免疫球蛋白IgM、IgG,在臨床徵狀消除一周後依舊有顯著的免疫反應。[160]對部分病例的追蹤報告顯示,儘管在出現COVID-19徵狀初期就產生了特異性免疫球蛋白IgG抗體,患者體內的病毒可共存長達50天。研究者認為天然免疫作用很重要,建議使用cGAMP等免疫刺激劑加速清除SARS-CoV-2。[161]其他有研究對COVID-19康復患者體內的血清進行分析後發現,針對病毒RBD蛋白結合性IgG抗體在實驗室環境下也無法有效阻斷病毒和宿主細胞的結合。[162]

人體對冠狀病毒的先天免疫信號轉導的機制是保守的,因此由於SARS-CoV-2與其他冠狀病毒的較高的同源性暗示它與宿主的互相作用類似於其他冠狀病毒。[163]SARS-CoV-2進入人體後,免疫系統會利用模式識別受體(PRR)來活化相關通路。經PRR活化,下游信號傳遞會導致細胞因子的分泌,其中IFN-I和IFN-III是最重要的免疫感應通路。[164]現有研究認為SARS-CoV-2相對於SARS-CoV對IFN-I更敏感,但相關的ISG還沒有被查明。[165][166]儘管淋巴細胞抗原6複合物位點E(LY6E)具有促進多種病毒入侵的表型,新的研究認為IFN誘導的LY6E對SARS-CoV-2起到了相反的作用。[167][168]研究認為,LY6E保護了初始B細胞以及樹狀細胞,防止了免疫細胞的喪失,從而維護抗病毒基因通路。因此,LY6E被懷疑是人體內抗SARS-CoV-2的關鍵機制,會干擾病毒膜融合的過程。[168][169]
針對免疫系統的IFN分泌,SARS-CoV-2有類似於SARS-CoV的免疫感應逃避機制。[163][170]對IFN的抑制使得受病毒感染程度不一的病人體內也可以檢測出不同程度的IFN表達。[171]
人體的免疫應答機制應對如SARS-CoV-2等RNA病毒有兩個途徑,分泌干擾素(IFN)以及趨化因子,分別用於抑制病毒增殖和召集白血球攻擊病毒。[172]包括常見的流感病毒及SARS-CoV在內,病毒會同時抑制干擾素和趨化因子的分泌。[173][174]SARS-CoV-2在這方面與SARS-CoV具有不同的表現,它僅抑制干擾素的信號通路,實驗顯示趨化因子的分泌並沒有受到如SARS-CoV一般的抑制。[165]對宿主樣本的檢測發現,經過SARS-CoV-2的感染後,IFN-I等干擾素的表達被顯著抑制,而IL-6、CCL2、8等趨化因子表達不受影響的在升高。這一發現指出,SARS-CoV-2在增殖過程中吸引越來越多的白血球,從而加速導致細胞因子風暴的發生。[165]而在針對IFN的抑制上,SARS-CoV-2相比SARS-CoV具有更強的抑制力。它的ORF3b基因的突變促成了病毒對IFN-I的更強抑制,從而允許病毒在感染宿主初期具有更快的增殖速度。[175]
有研究採用空間蛋白組學技術對SARS-CoV-2患者的樣本進行分析,繪製了多種免疫檢查蛋白受體的表達。這項研究發現,在具有高病毒載量的區域,PD-L1、CTLA-4和IDO-1蛋白均較低載量區域有更多的表達。這些蛋白具有控制免疫反應,如阻止CD8+ T細胞增生等功能。[176]
有研究者發現,經過冷凍電鏡的觀察,SARS-CoV-2的S蛋白三聚體結構相對緊湊,通過多糖屏蔽表位,有助於病毒免疫逃避。[177]過去的研究顯示,HCoV-NL63和SARS-CoV都可以通過多糖屏蔽S1或S2的抗原表位以逃避人體免疫系統的檢測。[178]研究指出,包裹RNA的核衣殼蛋白會抑制I型IFN的產生,有可能是SARS-CoV-2實現免疫逃逸的機制。[179]後有研究針對病毒進行了特異性糖基化分析,發現SARS-CoV-2的S蛋白上具有超過60個糖基化位點,相比之下HIV只有20-30個、常見流感病毒則為5-11個。[66]另有研究對其中的N-糖進行了分析,通過對比多地的病毒樣本,發現幾乎所有糖基化位點被保存,其中18種與SARS-CoV中也為保守。[67]
人體免疫系統針對病毒轉錄的一種ISG為干擾素誘導蛋白(IFIT),IFIT可藉由與eIF3相結合來抑制病毒的轉錄。[180]對核糖的甲基化可產生包括cap-1和cap-2兩種構架,IFIT就可通過這一特點阻止病毒的轉錄過程。[181]SARS-CoV-2則已經獲取相關甲基轉換酶來生產cap-1和cap-2,從而達到逃避由IFIT1等蛋白組成的免疫功能。[181][163]
在成功感染細胞後,被感染細胞會利用MHC-I分子傳遞資訊給CD8+ T細胞,以協助免疫系統清除受感染細胞。[182][183]SARS-CoV-2中的ORF8基因可針對MHC-I,通過介導MHC-I的降解以達到下調在受感染細胞表面的MHC-I表達,從而避免受到CTL的殺傷。[182]
基於COVID-19的血清樣本橫斷面分析,感染SARS-CoV-2病毒的患者大約在20天後可完全檢測到IgG和IgM抗體。兩種血清的轉換時間大約在發病兩星期後出現,但與患者的臨床徵狀輕重無顯著關聯。[184]對輕症患者的臨床觀察發現,儘管徵狀輕微,病患在一定時間內會呈現高滴度的特異性抗體。研究者結合對其他病毒如MERS-CoV的抗體研究,認為人類體內針對SARS-CoV-2的抗體在到達峰值後會逐漸下降,對短期的再感染有潛在保護作用。[185]除針對SARS-CoV-2而出現的抗體外,人體若曾被其他冠狀病毒感染過,則體內的輔助T細胞可以識別SARS-CoV-2的部分蛋白。[186][187]但現有研究指出,交叉反應的出現不代表不會受到感染。[186]

對中和性抗體的初步研究顯示,患者體內產生的一種抗體可以結合在S蛋白與hACE2的交互面,其抗體表位經檢測為456-FRK-SN-460。[188]更深入的分析發現,特異性IgM抗體主要針對病毒的S蛋白,而特異性IgG抗體則針對S蛋白以及N、ORF1ab蛋白。其中,S1蛋白以及S2ECD蛋白是檢測兩種抗體的較好的標誌物。[189]對抗體和病毒結合結構分析顯示,IgM的抗體表位分佈在S蛋白的表面,而IgG的抗體表位則分佈於S蛋白的表面以及內部。[189]在身體清除病毒的患者體內,特異性IgG抗體的滴度與病毒特異性T細胞數量呈強正相關性。[190]
一項針對SARS-CoV的抗體研究顯示在SARS-CoV的S2亞基中,包含HR2但不包含HR1的免疫原性域在SARS-CoV-2樣本中高度保守。[191][192]研究者將其他幾種病毒,包括RaTG13、MERS-CoV,以及多種流感冠狀病毒229E[193]、NL63[194]、OC43[195]和HKU1[196]加入對比,發現在SARS-CoV與SARS-CoV-2中這段序列的氨基酸同一性最高,達到93%,加入其他病毒的對比後這一數字有顯著下降。[192]另有研究發現,針對SARS-CoV的動物細胞單株抗體(mAB)可識別SARS-CoV-2的S蛋白片段。[192][197]在實驗室環境下,研究針對在COS-7細胞中的SARS-CoV-2分別使用了1G10、2B2、1A9、和4B12四種鼠mAB抗體。結果顯示,SARS-CoV的mAB可以和SARS-CoV-2的S蛋白aa1048-1206產生交叉反應。[192]
現今,已經有多種針對病毒不同蛋白的高中和性的單株抗體被發現,並正在研發應用階段。[198][199][200]有研究發現,在沙士疫情爆發期間感染SARS-CoV的康復患者體內的抗體也可以應對SARS-CoV-2的感染。這一研究指出,由於抗體所對應的結合位點十分保守,因此可以針對變異的病毒毒株也呈現有效的效應子功能。[201]對COVID-19康復患者的中和性抗體測序顯示,儘管有多種抗體可以和SARS-CoV以及MERS-CoV產生交叉反應,識別RBD區域內位點的抗體幾乎沒有交叉反應。[202]
人體經SARS-CoV-2感染後會在體內呈階段性發展,其中已康復患者的血漿因其免疫學特徵可有效治療其他患者。[203]在早期恢復階段,患者體內的CD14+單核白血球比例升高,並具有更高比重的CD14+IL1β+單核白血球。相對於水平較低的CD4+ T細胞,NK細胞則顯著增加。[203]利用單細胞測序等方式,可以在人體內檢測到B細胞受體(BCR)蛋白重排產生的特異性抗體。為針對SARS-CoV-2或類似病毒,CDR3區內編碼有IgH中重組的V(D)J耦合基因段展現出特異性的單克隆狀態。[203][204]由於患者體內單核白血球的IL-1β以及M-CSF分子的高表達暗示了人體免疫系統成功阻斷炎症因子風暴的機制,且TNFSF13、IL-2、4、18會促進特異性BCR的增殖以中和病毒攻擊。[203]
針對SARS-CoV的研究表明,動物模型和人體顯示短期內記憶B細胞和記憶T細胞都具有特異性免疫應答,但只有記憶T細胞的反應可延長至數年。[205][206][207][208]現有的臨床數據以及動物模型顯示,長時間段內再次被SARS-CoV-2感染的可能性較小。[209]由於並非所有感染SARS-CoV-2的患者都具有抗體反應,特異性T細胞的機制被認為參與了這一過程。[186][190][210][211][212]針對沒有檢測出循環特異性抗體的SARS-CoV-2感染者,有研究發現他們體內的記憶T細胞反應明顯,展示了研究樣本具有一定程度的群體免疫。[213]在已感染者體內的活化T細胞表型被發現會同時表達CD38、Ki-67、HLA-DR、PD-L1等,這一特徵與特異性IgG還有低水平的炎性因子相關,這一發現揭示了抑制性受體在受感染初期的免疫活化機能。[110][160][213][214][215]
目前關於新型冠狀病毒的流行病學認識受疫情變化影響,無完全確切的認知。新型冠狀病毒被認為對人群普遍易感。老年人及有基礎疾病者感染後病情較重,兒童及嬰幼兒等人群相對成年人有相似的被感染風險。[216][217][218]現有認知為新型冠狀病毒僅需96個小時左右即可在人呼吸道上皮細胞內被發現,且擁有傳染能力。[17]有研究顯示,在2019-2020年爆發的疫情中,病毒早在2019年12月即出現人傳人的跡象,[219]後有臨床病例研究顯示,因染色體和性激素對先天免疫系統的影響,女性相比男性在相同環境下感染人數可能會更少。[112]英國帝國理工學院根據病例的傳播推算,認為至2020年1月12日,武漢城內即有約1723例患者。[220]在目前認知中,新型冠狀病毒相比於SARS病毒所引發的臨床徵狀一般更輕微但傳播性更強,且潛伏期可能極具有傳播力。[221][222]由於這一個特性,有研究經過建立數學模型發現,在2019年的疫情中可能有超過10%的患者是被無徵狀患者所傳染,研究者擔心這對病毒的流行動力學模型的建立有負面影響。[223]儘管對初期41例病例的研究指出有15%的致死率,疫情經擴散後現有臨床病例顯示新型冠狀病毒的致死率小於SARS病毒的10%-20%和MERS病毒的35%。[50][110]

SARS-CoV-2在疫情爆發期間,會產生多種突變,在GISAID數據庫中被上傳的基因樣本已經超過一萬份。[224][87]同時,在GenBank數據庫中也可以查看完整的病毒編碼。[225]多份對病毒的進化樹的構建納入了包括來自疫情爆發地武漢以及其他洲的如美國、英國、澳洲等地區的病毒序列,並都存有不同的進化簇。[88][226][227]由於SARS-CoV-2屬於RNA病毒,因此頻繁的突變和新分支被認為是正常的。[88]儘管目前研究顯示各大洲的病毒都來源於同一祖先,歐美地區和東亞地區的病毒被歸於不同的分簇。[88][226]其中一項研究發現,在意大利地區的本地感染者和來自中國大陸的被感染遊客之間病毒序列具有明顯差異,補充了對不同地區病毒流行動力學的研究結果。[228]這些研究為估算精確的MCRA和病毒起源地提供了線索,但有研究者認為在其他干擾因素的影響下難以獲得結果。[226]其他研究則分析了呈現不同突變的病毒之間的生理區別,認為在致病性和病毒載量上具有顯著差異。[229]
最新的臨床結果顯示,對11名患者的病毒樣本分析中出現33個突變,其中超過一半是新出現的突變。研究認為,SARS-CoV-2的多樣性在之前被低估,且在複製能力上不同的毒株之間病毒載量的區別可以達到270倍。[229]
因在疫情期間,對基本傳染數的估計無可統一說法,多方估測的R0 指數從1.4-6.4不等,但都認為基本傳染數R0 > 1。根據這一共識,在流行病學的定義下,新型冠狀病毒疫情初期會以指數增長的趨勢形成正態分佈,成為流行病。[230]針對新型冠狀病毒擴散的一項研究對病毒的R0 指數提出不同的傳播率看法,認為需要使用動態傳播的模型,而非傳統的以常數表達的傳染指數。[231]
在疫情爆發初期,基本傳染數據先前預計為1.4到2.5之間[232](另有香港中文大學研究認為基本傳染數為3.30到5.47之間[233])。倫敦帝國理工學院院根據截至2020年1月24日的數據,統計得出基本傳染數中位數為2.6,95%置信區間為2.1-3.5。[220]根據蘭開斯特大學研究人員Jonathan M Read所領導的研究小組於2020年1月28日發表的預印本認為,此病毒的R0 系數為3.11(95%置信度區間(95%CI)為2.39-4.13),在武漢,此傳染係數確定為5.0。[234]而根據西安交通大學Tang Biao領導的研究小組與2020年1月24日所發表的文章認為:R0 系數可能高達6.47。[235]哈佛大學流行病學專家丁亮(Eric Ding)根據各方的公開資訊,估計傳染指數目前介於2.6與2.9之間[236]。
基於至2020年1月22日的所有病例報告,中國疾病預防控制中心的研究者認為R0 係數應當為2.2,95%置信區間為1.4-3.9。[219]世界衛生組織和香港大學的研究者總結了自2019年底疫情成熟開始的兩個個月內的確診病例數據,將R0 係數提升至2.68,95%置信區間則被縮小到2.47-2.86。[237]至2月13日,有研究者總結多篇已發表研究,得知SARS-CoV-2的R0平均值為 3.28,中位數為2.79[238]。其中一名作者Joacim Rocklöv教授指出,SARS-CoV-2傳播能力不亞於SARS-CoV,稱世界衛生組織在當時低估了2019冠狀病毒病的傳染力。[239]
新的研究提出,在疫情爆發過程中,封鎖城市、醫療水平的提高、預防方案的完善等各項要素對流行病動力學模型有很大的影響。[231]對病毒擴散進行動態分析的初步模型顯示,疫情的高峰期將於2020年2月19日到達,與另一由鍾南山團隊通過傳統方式得到的預測相重疊。[240][231]但這一模型反對依靠R0 指數得出的幾種擴散數量統計,認為最終在感染人數於高峰期前緩慢增長,而非指數性增長。[231]與新型冠狀病毒同屬的SARS(即嚴重急性呼吸道綜合症)的R0 係數在3左右。[241]

目前一般認為新型冠狀病毒與蝙蝠冠狀病毒同源,在初步的基因對比中,有研究人員認為穿山甲或為此次新型冠狀病毒潛在中間宿主,[242]另有觀點認為水貂也是一種可能的中間宿主,[243]但多位學者都就當時的觀點評論認為上述的中間宿主只是存在可能性,還需要正式的研究推出後才能進一步確認。[244]
有實驗室對在疫情爆發前一年的中國大陸穿山甲和馬來西亞穿山甲的基因樣本進行了測序,顯示出其體內抗體可與新型冠狀病毒的S蛋白相結合。經對比發現,穿山甲體內存有的冠狀病毒的S蛋白、小包膜蛋白、基質蛋白以及核衣殼蛋白與新型冠狀的蛋白擁有超過90%的同一性。對S蛋白RBD的對比指出,兩者RBD結構除一個氨基酸序列外完全一致。[245]另一項對更早的穿山甲基因進行對比的研究發現,通過高通量基因測序和qPCR檢測,穿山甲組織樣品內附有的冠狀病毒與新型冠狀病毒有極高的相似度。研究者對冠狀病毒構建進化樹後指出,GD/P1L和GD/P2S兩類穿山甲冠狀病毒與人類新型冠狀病毒親緣關係僅次於RaTG13,初步評估認為穿山甲是病毒傳播至人群的宿主之一。[90]同時,其他穿山甲冠狀病毒如GX/P2V、GX/P3B、GX/P4L等也被發現與SARS-CoV-2有相對較近的親緣關係,研究者指出穿山甲種群數量稀少,屬於極危物種,因此穿山甲在傳播過程中的位置尚難以明確。[246]後因多種哺乳動物如貓、狗、竹鼠等動物都具有易感性,有研究者猜測病毒的中間宿主也有可能包括了這些動物中的一員。[247]
在疫情初期,新型冠狀病毒接觸人群的傳播源被認定為是位於武漢的華南海鮮市場,但後續有研究根據疫情進展以及病毒基因溯源分析質疑了這一說法,認為武漢海鮮市場並非最初的暴露源。[248][62]2020年2月下旬,有研究者分析了GISAID平台上的93個病毒基因樣本。對基因組不同變異位點進行分類後,研究發現有與RaTG13相關聯的單倍型為非華南海鮮市場來源的基因,源於海鮮市場的樣本被認為是其衍生的單倍型。[87]這一研究指出,病毒在傳播期間,已經經歷過兩次顯著的種群擴張,可發現基因組內有120個核苷酸發生突變,但無法確定是否是功能性突變。[87]其他對已有基因樣本的分析顯示,自從第一例人群傳播事件開始,沒有其他動物宿主參與疫情的傳播。[249]
研究者通過流行病學模型分析認為,零號病人的出現,最早可以追溯到2019年10月初,也有其他研究傾向於11月下旬。[248][249][250]其他研究對病毒基因進行了進化分析,也認同在2019年10月至12月是病毒最初的爆發時間。[251][252][253]

有研究指出,病毒的主要感染途徑為侵入人體呼吸道上皮細胞。[46]據其他不同研究顯示,新型冠狀病毒可通過呼吸道飛沫(droplet)、飛沫形成的氣凝膠 (aerosol 或稱氣溶膠、懸浮微粒、氣霧)[254][255] 、皮膚接觸或直接接觸帶有病毒的分泌物,經由眼睛、鼻腔、口腔等途徑進入人體。[17][256]目前所見傳染源主要是感染病毒的患者,無徵狀感染者也可能成為傳染源。[17][34][257]除會產生大的病毒顆粒如噴嚏、咳嗽等方式外,SARS-CoV-2也可以通過其他方式被霧化並感染人群。[258]針對醫院環境中的病毒傳播,有研究指出患者在接受插管或進行手術時,會排出病毒並使它滯留在空氣中。[259]
溶於較大液滴中的SARS-CoV-2會通過人觸摸臉部的方式傳染,但多數會沉澱於上呼吸道或被鼻腔的分泌物清除。[258]研究發現,在封閉空間中,單純的呼吸和說話會產生直徑更小的氣溶膠。這一發現建議病毒粒子可以更容易進入肺部,並直接感染肺部內的細胞。[258]儘管消化道接觸病原體也被懷疑有傳染可能,這一途徑未被證實。[218]
對確診攜帶病毒的患者分析指出,人體唾液、淚液、尿液、糞便等樣本中,均發現了有感染能力的病原體。[260][261]在收治感染新型冠狀病毒的患者的定點醫院中,也有研究人員對隔離區內進行多種物體和氣體的採樣,發現部分物體表面以及空氣中,都檢測到了病毒。[262]而世界衛生組織也承認病毒可藉由空氣傳播[263]。
此前有一份研究構建了新型冠狀病毒的擴散模型,其中指出疫情爆發時值春節時期,在預測受感染病患人數時需要納入因春運而造成的出入境人流增多因素。[264]還有研究指出,在對比2019年12月至2020年1月的12份病毒樣本後,認為一代病毒攜帶者的病毒來源最早可能來自2019年11月9日的同一來源,且因傳播性強而使得一代病患人數較多。[265]後期有研究對疫情擴散的規模使用反向的建模方法,提出疫情爆發的初期數據具有不全面性和滯後性。這一研究採納了利用地理區劃分層進行去偏估計的模型,主要通過疫情擴散後的更大的地理區劃來估測疫情爆發地的實際情況,將湖北本地的感染人數推升至8萬人。[266]疫情發展至2020年5月時,美國的疫情擴散最為嚴重。對美國加州洛杉磯縣的病毒擴散調查顯示,至少有三十萬以上的人口都可能被SARS-CoV-2感染,達到近5%的流行病率。[267]也有研究對更小範圍的環境進行傳播動力學分析,病毒在如醫院、超市、居民區等公共環境具有不同程度的氣溶膠傳播風險。[268]其中,在醫院環境內,ICU病房及廁所具有較高程度的病毒粒子聚集;其他環境內,則在超市及醫院門口可檢測到高濃度的病毒。這一研究認為,經由氣溶膠傳播的病毒具有沉降至衣物或地面後經由人員攜帶再於空中揚起的傳播模型。[268]

在更新的研究中發現,二代、三代病毒攜帶者的潛伏周期平均更長,且從出現徵狀至入院的時間經觀察比早期的患者更長,研究者認為在患病早期確診病患並進行隔離治療會更加困難。研究指出,病毒潛伏期平均為5.2天,且每7.4天感染者就會翻倍。[219]另有研究認為翻倍指數只有6.4,中國大陸各個主要城市的疫情爆發時間相較於武漢會滯後7-14天。[219][237]2020年2月9日,由鍾南山帶領的團隊發表了一項新的綜合性研究,將潛伏期的上限擴大至24天,並指出臨床數據支持受新型冠狀病毒的傳染後從放射學和裸眼觀察的角度上均相比SARS和MERS更難在感染初期發現病徵,這增加了病毒的擴散能力。[240]對疫情爆發期間中國大陸地區的回顧性研究顯示,大約80%的被記錄的確診患者是通過未被記錄的病毒攜帶者所感染的。這些不在冊的患者的傳染效率依據IF-EAKF框架下的模型,被認為傳播效率約為在冊傳染者的一半。因此這一研究的研究者指出,無明顯徵狀的患者及患者就診所需的兩個星期滯後時間使得SARS-CoV-2具有非常嚴重的流行潛力,並被和2009年爆發的H1N1疫情所類比。[269]
由於SARS-CoV-2病毒的爆發,促成多個疫情爆發地區施行社交隔離的方式來保障公共安全。[270]中國大陸是疫情最初流行的地區,針對中華人民共和國採取的社交隔離措施的研究發現,社交隔離有效減少7-8倍的人際聯繫。[270]其中,研究針對學校設施的關閉進行了分析,認為主動關閉學校可延遲疫情的擴散,並有效減少高峰期的病毒傳播效率。[270]在這次疫情中,還有研究利用手機的流量數據推測人群的交流範圍並鑑別不同地區的風險程度。[271]這一研究指出了在特定時間段(如春運期間)內的流動模型計算,與前述研究從流行病學角度分析成年人更容易受到感染的結果相符。[270][271]在疫情推移至2020年春季時,有研究認為夏季氣候的炎熱反而會助長病毒的傳染。[272]這一研究分析,對比其他流行病的傳播趨勢,SARS-CoV-2有可能在夏天氣候炎熱、空氣潮濕的時候更容易引發新一波的疫情,處於熱帶等地區的人群也具有更高的風險。[272]
有研究指出,任何病毒在感染人類後,會選擇更高傳染力的方向進行突變,並在沙士疫情中得到了體現。[62][273]研究認為,COVID-19的傳播需要借鑑對SARS-CoV的認知,基於對公開在網絡數據庫中的樣本得知,在疫情原發地中國大陸以外的樣本展示出了頻繁的基因突變。在這一數據支持下,研究認為新型冠狀病毒的進化周期類似SARS-CoV,在2020年2月以後已經進入第二階段,擁有更高的傳播率。[62]在疫情發展期間,主要的RT-PCR檢測利用了病毒的N和Orf1b基因引子來對患者進行核酸確診。相關研究對有徵狀患者不同時期的鼻拭子和咽拭子的病毒載量進行了對比,發現新型冠狀病毒的核酸排出模式與感染流感病毒的患者類似。研究懷疑,無徵狀以及輕徵狀的新冠患者在傳播能力上不輸於有徵狀患者。因此這一研究認為在構建傳播動力學模型時需要納入這一變量,並建議採取與控制沙士疫情不同的防疫策略。[274]對隱性傳播的潛在能力,有學者回顧了中國大陸湖北地區的三萬例病例,認為30-60%的病毒感染者都會成為無徵狀或僅輕微徵狀的病毒攜帶者,有可能導致2019年疫情的再一次爆發。[275]針對意大利地區的一項研究發現當地超過40%的患者均為無徵狀感染者,認為無徵狀感染者因沒有改變生活習慣而增加了病毒感染的範圍,並指出感染者的病毒載量於初期不取決於是否有徵狀。[276]
有研究利用已有的R0 係數對SARS-CoV-2的傳播鏈進行了分析。這一研究中採納的R0 為2.2-2.5,並得出病毒攜帶者感染他人的時間中位點為徵狀出現前的2.3天左右。研究認為,主動採取包括抗病毒藥物等手段可以正面影響病例在治癒前的病毒排出動力學。[277]部分患者在符合出院指標,即無臨床徵狀、PCR檢測陰性的標準下,經過多天的後續隔離,再次PCR檢測結果為陽性,有報告認為,治癒患者依舊擁有傳播病毒的能力。[278]有研究者發現,有患者的PCR測試結果儘管呈陰性,但SARS-CoV-2在肺部組織中依舊有殘留,暗示出院患者具有傳播病毒的潛在風險。[279]
而對病患體內病毒的一項分析指出,人體脫氨酶參與了對SARS-CoV-2轉錄組的RNA編輯。研究指出,調節干擾素信號的ORF6基因的編輯率最高。[92]這一人體免疫系統的感知及抑制機制被認為可以調節病毒在體內的增殖速率。[280]同時,由於在男性血液中hACE2的濃度顯著高於女性,導致男性具有更高的易感性以及重症比例。[281]
新的研究將SARS-CoV-2與其他引發大規模流行病的病毒進行了對比。針對紐約市分別在H1N1以及SARS-CoV-2流行期間的死亡率對比研究指出,儘管在COVID-19流行期間具有更完善的衛生措施,SARS-CoV-2對同期死亡率的影響尤甚於H1N1。[282]

SARS-CoV-2病毒會造成一種感染性疾病COVID-19,由於SARS-CoV-2造成的疫情還在爆發中,現今的臨床多為初步性研究。[283]COVID-19的常見徵狀包括發燒、咳嗽以及呼吸急促,也有部分患者會有咽喉酸痛、肌肉乏力、積痰等徵狀。[19][283]大部分COVID-19病例只會呈現輕微徵狀,只有部分會發展成為病毒性肺炎以及多器官衰竭的重症病例。[109][284]COVID-19病患的臨床死亡率目前普遍處於1-5%區間,這一比率根據不同的治療環境和年齡群體有差異。[285]
COVID-19的傳染依靠病毒為載體,一般會經由咳嗽或噴嚏產生。[286]基於目前的流行病學調查,病毒潛伏期為1-19天,多數患者居於為3-7天內,中位值為5天;少數患者潛伏期則長達19天至24天[240][287][288]、甚至有病例的潛伏期高達27天[289][290]。對COVID-19的標準檢測方式是通過rRT-PCR檢測病例樣本,也可以通過其他途徑(如CT)檢查。[291]
同時,SARS-CoV-2病毒被發現與兒童多系統炎症綜合症(MIS-C)相關聯。這一病症特點為全身性炎症反應,更嚴重會患有多器官功能衰竭,與COVID-19的臨床表現相類似。MIS-C在免疫細胞水平的測試中表現與COVID-19相差無幾,較明顯可用於區分兩者的指標為免疫細胞嗜中性顆粒白血球水平。這一區別也用於區分MIS-C和川崎病[292][293]
公共衛生機構推薦群眾依靠常洗手、保持人際距離、少觸摸臉部來預防感染,同時疑似被感染者可通過戴口罩減少感染他人的幾率。[294][295]現今COVID-19相關的治療方式主要為支持性治療,多種病毒抑制劑還在試驗階段。[295][296][297]

針對感染SARS-CoV-2的病例,需要實時熒光RT-PCR檢測病毒核酸呈陽性才能完全確診。但是在臨床實踐中,不排除測試結果呈虛假的反應的可能出現,應結合流行病學接觸史和臨床特點進行綜合分析。[19]這些確診手段不影響對患有相關徵狀的病患由醫院進行標準的診斷和治療,確診為病毒攜帶者後再會被送至定點醫院進行定向治療。[19][298]對感染新型冠狀病毒的疑似病例進行確診必須採集相關樣本,實時熒光RT-PCR檢測新型冠狀病毒核酸陽性者可以確診。在對呼吸道樣本或血液樣本進行病毒基因測序後,若與已知的新型冠狀病毒高度同源,即為確診病例。[17]若無法通過RT-PCR確診,則臨床上疑似病例須結合流行病學接觸史和影像學檢查結果等臨床特點綜合分析。[17]
RT-PCR測試是現有的對SARS-CoV-2病毒進行檢測的主流方式。[19][299]有研究從效率和成本上就這類方式提出其他替代方式,且指出在臨床實踐中RT-PCR測試針對SARS-CoV-2的劣勢。[279][300]在COVID-19患者感染後期,醫護人員採用RT-PCR測試覆核徵狀消退的患者是否消除體內病毒。有研究發現有些患者依然存在瀰漫性肺泡損傷,其中主要浸潤的免疫細胞只有CD68+ 巨噬細胞、CD20+ B細胞以及CD8+ T細胞。[279]因此,儘管利用鼻拭子樣本進行的測序顯示為陰性,可在病患的肺部組織中發現殘留的病毒存在。這一發現建議,針對患者應當更多使用支氣管肺泡灌洗液為樣本來做PCR,並對已出院的患者跟蹤檢查。[279]
針對RNA病毒,北京大學和清華大學的研究者聯合發表了一種新型確認病人感染新型冠狀病毒的測序手段SHERRY。這種手段通過基於Tn5轉座酶的轉錄組測序,相比傳統的smart-seq2技術有更好的效率,減少了樣本的需求量。新型冠狀病毒是SHERRY首次在臨床上進行應用的對象。[301]
2020年3月12日,瑞士製藥羅氏公司宣佈該公司基於核酸檢測的商業化檢測方法得到了美國食品和藥物管理局(FDA)的緊急使用授權[302]。該測試可以在全自動設備上大量進行,極大地提高了檢測效率。羅氏表示,利用該公司的cobas 6800&8000分子測試系統,可以在24小時之內檢測分別檢測1440,4128個樣本。[303]
針對SARS-CoV-2常用的檢測手段為RT-PCR。[304]有研究認為,現在主要的qRT-PCR檢測耗時從獲取樣本到得出結果超過24小時,因此試圖利用CRISPR技術在實踐中提供更快的檢測。[305]這一研究中開發的DETECTR檢測技術基於Cas12蛋白,由於其試劑的便攜性認為可以用於在實驗室外的地方以提高效率。[305]
| 徵狀 | 百分比 |
|---|---|
| 發燒 | 87.9% |
| 乾咳 | 67.7% |
| 疲勞感 | 38.1% |
| 積痰 | 33.4% |
| 呼吸急促 | 18.6% |
| 肌肉/關節痛 | 14.8% |
| 咽喉酸痛 | 13.9% |
| 頭痛 | 13.6% |
| 寒顫 | 11.4% |
| 噁心嘔吐 | 5.0% |
| 鼻腔堵塞 | 4.8% |
| 腹瀉 | 3.7% |
| 咳血 | 0.9% |
| 眼結膜充血 | 0.8% |
COVID-19患者因病毒特性,會患有病毒性肺炎。大多數患者表現以下呼吸道徵狀為主,常見臨床表現包括發燒、四肢乏力、乾咳等徵狀,其他表現包含咳痰、頭痛、咳血,或腹瀉等等。[110]有部分患者僅表現為低熱、輕微乏力等,無肺炎表現,[35]還有部分患者無任何臨床表現。[107]重症患者多在發病一周後出現呼吸困難和/或低氧血症,值得注意的是重型、危重型患者病程中可為中低熱,甚至無明顯發燒。病毒感染嚴重者,可快速進展出多種併發症包含急性呼吸窘迫綜合症(ARDS)、膿毒症休克、難以糾正的代謝性酸中毒、急性心肌損傷和出凝血功能障礙等。[19][110][218]
根據不同的臨床徵狀,患者可被分為輕型、普通型、重型,以及危重型。[218]輕型患者臨床徵狀輕微,影像學未見肺炎表現。普通型患者具有發熱、呼吸道等癥狀,影像學可見肺炎表現。出現如下徵狀之一的,即可認定為重型患者:呼吸窘迫 RR≥30 次/分;靜息狀態下,指氧飽和度≤93%;動脈血氧分壓(PaO2)/吸氧濃度(FiO2)≤300mmHg[218]。出現如下徵狀之一的,即可認定為危重型患者:呼吸衰竭,且需要機械通氣;出現休克狀態;合併其他器官功能衰竭需要ICU監護治療[218]。
對患者使用胸腔斷層掃描檢查,可觀察到影像學異常。早期患者的肺部會呈現多發小斑片影及間質改變,以肺外帶明顯。經發展後,肺炎患者被觀察到雙肺多發毛玻璃狀影、浸潤影。嚴重者則會進一步發展為次節葉或大葉性肺實變,胸腔積液少見。[45][218]一項放射學研究指出,由於新型冠狀病毒和SARS以及MERS病毒的相似性,至少30%的病患出現急性呼吸窘迫綜合症在意料之中。CT結果顯示,絕大部分患者具有磨玻璃影以及肺部徵狀的雙發性特徵。[306]多數患者的C反應蛋白(CRP)和紅血球沉降率(ESR)升高,降鈣素原正常。嚴重者D-二聚體升高、外周血淋巴細胞進行性減少。[218] 肺外表現主要為急性腎損傷,心肌缺血/梗塞(MI)和心肌炎為表現的心肌損傷,以及高凝血狀態[307]。
現今對COVID-19的病態生理學以及其微觀病變沒有完善的數據,但已有對死亡患者的解剖,展示了COVID-19的多個主要病理學特徵:[308][309][310]
目前,對COVID-19的病理的研究,主要來自於對SARS-CoV和MERS-CoV的理解。由於SARS-CoV-2和兩種病毒的相似性,研究者認為人體主動清除病毒的方式依然依靠免疫應答。[11]通過呼吸道感染SARS-CoV-2後,人體內免疫系統會攻擊病毒,後病毒會隨着氣管深入肺部。[311]在輕症患者中,人體對抗病毒的主要表現為利用I型干擾素、CD4+ Th1細胞和CD8+ T細胞的抗病毒反應。[11]在人體自體免疫反應試圖清除病毒的過程中,白血球釋放趨化因子導致更多免疫細胞攻擊被感染細胞。COVID-19患者體內這一過程會導致肺部積液及膿細胞,引起肺炎的徵狀。[311]重症患者體內的抗病毒反應相對較慢應答,在引起CRS後得到增強。患者體內的淋巴細胞減少的現象被猜測與淋巴細胞的抗病毒反應有直接關係,認為它具有對骨髓的抑制。[11]回顧性研究發現,在SARS-CoV-2病毒傳染的後期階段,患者自感染到出現徵狀的平均時長相比早期延長,被懷疑病毒會演變成為類流感病毒,潛藏在無徵狀患者的體內。[312]
對人體不同器官的ACE2受體表達測序顯示,上呼吸道、肺部、迴腸、心臟、腎臟都是易損器官,有研究認為SARS-CoV-2造成的病毒血症對此有一定影響。[313][314]而在小腸上皮細胞、腎小管細胞、II型肺泡上皮細胞、主動脈平滑肌細胞等細胞內富集hACE2,因此與COVID-19中病患呈現的心臟損傷有關係。[313][315]


SARS-CoV-2感染人群後造成的COVID-19會先呈現上呼吸道徵狀,並引起先天免疫系統的反擊。[316]在無法中和病毒時,病毒會隨氣道進入肺部,感染具有受體的呼吸性細支氣管、肺泡管、肺泡囊等組織。在免疫細胞攻擊被感染細胞時,肺部的氧氣交換功能被干擾,結合肺部積液會形成肺炎的徵狀。[45][311]在感染深入後,甘露聚糖結合凝集素(MBL)通過凝集素途徑活化補體系統,其中起到啟動補體級聯反應的是甘露糖結合凝集素相關絲氨酸蛋白酶2(MASP-2)。補體系統的活化最終會導致慢性或急性的炎症反應,進一步誘導SARS-CoV-2首要入侵器官肺部的急性病變。[179]
相似於因SARS-CoV和MERS-CoV導致的重症患者,COVID-19患者目前常見的致死病因來自於細胞因子釋放綜合症(CRS)。[317]對重症患者進行血液檢查後,可發現在發病早期外周血白血球、淋巴細胞減少,部分患者可以出現肝酶、乳酸脫氫酶(LDH)、肌酶和肌紅蛋白增高;部分危重者可見肌鈣蛋白增高。[218]IL-2、IL-7、IL-10、GCSF、IP10、MCP1、MIP1A以及TNF-α亦高於正常值[110]。
患者由於被SARS-CoV-2感染,被活化的單核白血球、巨噬細胞等會分泌大量包括IL-6在內的炎性因子。[317][318]這一類刺激患者的先天免疫系統的方式被推測與SARS-CoV等同屬病毒有一樣的機制,IL-6可與IL-6R和gp130形成複合體,活化JAK-STAT通路,並引起CRS。[319]被活化CRS的患者體內會大量釋放細胞因子,同時IL-6在另一通路中會與sIL-6R結合,與gp130形成二聚體,利用下游的JAK-STAT3通路活化不表達mIL-6R的細胞。[317]這引起VEGF、MCP-1、IL-8等因子釋放,從而造成細胞因子風暴和急性炎症反應,導致全身血管更為脆弱,引發急性呼吸窘迫症(ARDS)和多器官衰竭。[110][155][317]
在進入重症的COVID-19患者中,很大比例的患者具有不同的心血管損傷如心律不整、血管栓塞、肺血管收縮等。[320][321]
SARS-CoV-2結合的受體ACE2一般情況下會作用於Mas受體,發揮拮抗Ang II/AT1R效應,導致血壓降低、血管舒張並抑制炎症。受感染後由於ACE2的降低,RAS活化後向Ang II/AT1R偏移,從而使得組織擴大損傷。有研究表明,患有糖尿病、高血壓以及心衰的患者有顯著的高ACE2表達水平。[322]對COVID-19患者的心臟損傷的指標被認定為需要體內hs-TNI蛋白水平高於標準範圍上限的P99。[320]在不同的報告中,重症病人體內都檢查出D-二聚體水平的升高,導致血栓的形成。血栓會導致肺動脈栓塞或在進入大腦後引起中風。[320]更常見的則有不同部位如手、腳的缺血徵狀,肺部血管收縮進一步導致患者在沒有呼吸困難的情況下也具有非常低的血氧水平。[321]另有研究指出,COVID-19會造成靜脈血栓栓塞症(VTE)。其中包括呼吸衰竭、中心靜脈置管等因素都認為可能潛在造成VTE。[323]
受病毒感染後,患者有一定幾率在血栓形成後引起大血管中風。[324]血管壁上的炎症驅動了患者體內血栓的形成,由於多位於供血動脈中,會使大腦部分區域供血喪失,引起COVID-19的併發症急性缺血性中風。[325]現有臨床數據顯示,患有糖尿病、高血壓或肥胖的患者更容易向重症發展。[155][156]一般在微血管周細胞中具有高表達的hACE2,在內皮細胞或血管周巨噬細胞中無法檢測到。[326]這類病症導致的血管內皮屏障功能障礙促進了SARS-CoV-2的感染,從而使患者凝血功能失調,引發包括更嚴重的炎症反應、體內各部位形成血栓乃至血栓栓塞。[326]這類患者體表會出現凍瘡樣病變或呈紫紅色的網狀皮膚徵狀。[327]
病患的脾臟在被感染後也會具有不同程度的病變。包括脾臟及淋巴結,其內的CD4+ T細胞和CD8+ T細胞水平顯著下降。其他臨床徵狀包括白髓萎縮、紅髓充血、灶性出血,脾臟內巨噬細胞增生並可見吞噬現象等。[328]
所有的COVID-19患者在入院後,都呈現出不同程度的胰臟、肝臟等器官的損傷。[110]其中部分患者的ALT、AST和TBIL水平有顯著升高,體現出患者肝臟的損傷程度。[110]針對肝臟的研究發現,SARS-CoV-2感染可導致膽管類器官超過三百個基因的表達出現顯著變化。[329]包括CARD8、STK4在內的參與調控細胞凋亡的基因表達被上調,研究認為這會誘發膽管細胞凋亡。其他如膽汁酸轉運體(ASBT)、囊性纖維化跨膜電導調節(CFTR)基因的表達被下調,結合對膽管細胞的屏障功能有影響的Claudin1的表達下調,會導致膽管損傷,誘導肝臟功能衰竭。[329]其他研究對COVID-19患者的全身代謝進行分析,發現三羧酸循環(TCA)中的蘋果酸以及尿素循環(UC)中的氨基甲酸酯磷酸受到SARS-CoV-2的影響,重症患者體內的氨基甲酸酯磷酸鹽水平也顯著下調,說明了COVID-19患者的肝功能障礙。[330]此研究進一步提出,由CD39、73介導的鳥苷一磷酸與COVID-19病症嚴重程度正相關,可從COVID-19的表徵來分析患者的代謝紊亂情況。[330]
儘管SARS-CoV-2在患者腸道內腔會被腸液滅活,有研究認為腸道也可能會被病毒感染且對疾病的發展有影響。[122][313]而由於腸上皮細胞中有高度表達的ACE2,小腸類器官被認為是病毒的靶器官之一。[331]對COVID-19患者的臨床觀察發現,一定比例的病患會出現不同程度的胃腸道徵狀如腹瀉等。[240]通過血清學測試,可檢測到部分病患的胰臟也具有相關損傷。臨床上除腹瀉外,還可能具有厭食等其他重症疾病。[332]因為沒有針對性的影像學檢查,學者認為還不能確定COVID-19患者是否也會包含胰腺炎的結構性表現如胰周滲液、胰腺壞死等徵狀。[333]
受SARS-CoV-2感染後,COVID-19患者的泌尿系統會受到不同程度的損傷。[334][335]男性生殖系統因全身性感染,也會在附睾屏障缺陷的情況下被感染,從而長期影響生殖功能。[336]部分COVID-19患者的泌尿系統會有急性腎衰竭等表現,腎小管的感染也會使尿液帶有具有活性的病毒,可能會經由尿液感染他人。[335]對患有急性腎衰竭的患者進行測驗後可發現,腎小球濾過率較低,而血漿肌酐和尿素水平則較高。部分死亡病例因病毒感染會有急性腎小管壞死,組織內可發現大量病毒抗原。研究指出,調節eGFR水平的治療可有效降低具有相關徵狀患者死亡率,同時降低常見的合併症如高血壓、心力衰竭等對患者的影響。[335]因SARS-CoV-2的感染會導致患者全身局部性炎症,生殖系統也會受到感染。[336]男性生殖系統中的睾丸組織具有免疫豁免的特性,包括SARS-CoV-2病毒在內的多種病毒都可以長時間在生殖系統中存活。臨床檢測顯示,有部分病患的精液等生殖系統分泌物中可檢測到病毒的存在,但在女性體內是否會導致胎兒感染還沒有結論。[336][337]
有多個臨床研究報告了SARS-CoV-2也可以攻擊中樞神經。在多個報告中,不同比例的COVID-19患者有喪失嗅覺、味覺的徵狀。一項病例報告指出從一名患有腦膜炎的患者的腦脊液中探測到了病毒的存在。[338]
SARS-CoV-2可通過眼結膜感染人體,也可因全身病毒性感染擴散至結膜[339]。因此,有醫師認為,基於對其他病毒引起疾病的經驗,如急性結膜炎等徵狀可能是COVID-19的首發或伴發徵狀[340]。
由於對病毒無特效的針對性治療方式,在臨床實踐中以維持患者生命指標為目標進行支持性治療。[35]由中華人民共和國官方更新的診療方案中,除給氧等常規治療方式外,還可以利用霧化α-干擾素、洛匹那韋、利巴韋林等藥物抑制病症加重。[218]對病情危重,有嚴重呼吸窘迫徵狀的病人,ECMO等體外生命維持治療可臨床適用。[35]
一項研究發現,雄激素剝奪療法是一種可能有效的預防病毒感染及治療COVID-19的手段。[341]此前,有研究指出性激素對病毒的感染和死亡風險具有顯著影響。[112]臨床數據顯示,本具有前列腺癌的患者經歷過雄激素剝奪療法後,感染病毒或因感染病毒死亡的比例均極大的低於其他類型的癌症患者。研究認為,由於雄激素具有調節TMPRSS2蛋白的功能,這一療法可以下調TMPRSS2表達,從而達到預防和治療的效果。[341]
較多COVID-19患者具有二型糖尿病,初步的回顧性研究表明二型糖尿病的主要治療藥物二甲雙胍仍可以應用於患有COVID-19的糖尿病患者。儘管二甲雙胍在治療期間的酸中毒頻率與COVID-19的嚴重程度顯著相關,對患者死亡率沒有影響。[342]
COVID-19患者中徵狀較重的一些病例需要在治療中採用機械通氣或其他類似手段來保證患者的正常呼吸功能。[343][344]多種支持性治療手段都有效果,有臨床報告認為利用高流量鼻導管氧療或雙水平氣道正壓通氣可以避免為病人插管。[345]評論認為現有的臨床證據無法證明哪種方式對COVID-19患者更有效,但有醫生更傾向於使用可控制氣凝膠粒子擴散的插管。[344][346]
在病患發展至出現ARDS的階段,吸氧會更加困難。[347]為確保患者在接收足夠濃度的氧氣同時不產生呼吸機相關肺損傷或氣胸徵狀,需要使用具有調節氣壓模式的呼吸機,並採用高呼氣末正壓通氣模式(PEEP)。[348][349]

針對SARS-CoV-2的藥物研發自疫情初期的2020年1月底開始,中國科學院上海藥物研究所與上海科技大學的團隊羅列了已有的30種可能對病毒有效的藥物,其中包括蛋白酶抑制劑因地那韋、沙奎那韋、洛匹那韋等抗病毒藥物。[350]有相關研究者指出,中和患者體內的任何病毒,首選的藥物包括有較高抗原特異性的阻斷性單株抗體。但至2020年4月,仍然沒有對病毒進行特異性預防或對COVID-19進行治療的藥物。[351]針對SARS-CoV-2病毒蛋白的PPI研究顯示多種已被審批的藥物可能有效果,其中包括氯化奎寧、阿奇黴素等。[59]
由於針對COVID-19還沒有任何特效藥,在臨床實踐中的部分用藥屬於同情用藥,包括正在進行針對性臨床試驗的氯化奎寧、羥氯喹等藥物。[352]部分藥物如IL-1受體阻滯劑阿納白滯素(Anakinra)、IL-6受體抑制劑托珠單抗(Tocilizumab)、JAK抑制劑托法替尼(Tofacitinib)本是用於治療風濕病的,有評論認為也可以抑制COVID-19帶來的細胞因子風暴,從而降低重症風險。[353]
一種新型實驗性廣效抗病毒藥物瑞德西韋[註 3]被認為可以有效抑制呼吸道上皮細胞中SARS和MERS病毒的複製。[354][355]據2020年的一項研究顯示,瑞德西韋和干擾素IFNb1-b的聯合用藥對MERS有顯著療效。[356]儘管這一藥物還在針對伊波拉病毒的三期臨床試驗中,有猜測認為它是現今對新型冠狀病毒最理想的藥物。[357]美國被確診的第一例新型冠狀病毒患者在進入重徵狀態後,醫師對他使用了瑞德西韋,經觀察發現呼吸困難的徵狀有顯著改善,不再需要吸氧治療。但是藥物的研發公司和這一病例的主治醫師都表示,這一藥物還未被證明其有效性和安全性,需要進一步的臨床研究。[358][359]針對動物模型的研究顯示,隨瑞德西韋使用劑量的增加,模型(小鼠)的精子濃度和活性都有顯著下降趨勢,因而懷疑這一藥物具有一定的生殖毒性。[360]
氯化奎寧類藥物因對SARS-CoV有一定抑制作用,也被一些研究者認為有可能可以有效抑制由SARS-CoV-2引發的COVID-19患者體內的病毒擴散。[361][362][363]但有研究進行臨床測試後發現,使用更高劑量的病患反而具有相對更高的死亡率。[352][364]高劑量的用藥顯示會提升患者的肌酸激酶水平,QTc間隔延長超過500ms。在對患者的病毒載量進行對比時發現,氯化奎寧藥物無法體現顯著的抑制效果。[352]美國FDA也因此提醒不要使用氯化奎寧或羥氯喹。[365]
| 藥品名稱 | 效果 | 有效範圍 | 備註 |
|---|---|---|---|
| K22 | 抑制病毒的膜融合功能 | 對SARS-CoV及MERS-CoV有效,可能對SARS-CoV-2有效 | [368] |
| 雙鏈核糖核酸活化的細胞凋亡蛋白酶聚合體(DRACO) | 針對病毒dsRNA並引起感染病毒的細胞凋亡 | 具有廣效抗病毒作用,可能對SARS-CoV-2有效 | [369] |
| 霉酚酸(MPA) | 靶向核苷酸以抑制鳥苷一磷酸的合成 | 具有廣效抗病毒作用,可能可以結合IFN-β1b抑制SARS-CoV-2 | [370] |
| 洛匹那韋(Lopinavir) | 抑制3CLpro | 具有廣效抗病毒作用,包括SARS-CoV及MERS-CoV,可能對SARS-CoV-2有效 | [371] |
| 瑞德西韋(Remdesivir) | 終止病毒RNA的轉錄 | 結合IFN-β可以抑制SARS-CoV-2感染 | [356] |
| 利巴韋林(Ribavirin) | 靶向RdRp以抑制RNA合成 | 具有廣效抗病毒作用,包括SARS-CoV及MERS-CoV,低劑量用藥可能對SARS-CoV-2有效 | [371] |
| 加利地韋(Galidesivir) | 靶向RdRp以抑制RNA合成 | 具有廣效抗病毒作用,包括SARS-CoV及MERS-CoV,可能對SARS-CoV-2有效 | [372] |
| 巴南寧(Bananins) | 靶向病毒解旋酶蛋白以抑制解鏈及三磷酸腺苷酶活動 | 具有廣效抗病毒作用,可能對SARS-CoV-2有效 | [373] |
| 芳基二酮酸(ADK) | 靶向病毒解旋酶蛋白以抑制解鏈 | 具有廣效抗病毒作用,包括SARS-CoV及MERS-CoV,可能對SARS-CoV-2有效 | [373] |
| 格瑞弗森凝集素(GRFT) | 靶向病毒S蛋白上的低聚糖以阻止和宿主細胞結合 | 對SARS-CoV及MERS-CoV具有作用,可能對SARS-CoV-2有效 | [374] |
| 阿米洛利(Hexamethylene amiloride) | 靶向病毒包膜蛋白並抑制離子通道 | 對數種冠狀病毒有效,可能適用於SARS-CoV-2治療。 | [375] |
| 親脂性噻唑烷衍生物JL103 | 靶向病毒脂膜,抑制病毒的膜融合 | 在多種病毒上有效,可能對SARS-CoV-2有效 | [371][373] |
| 重組人工干擾素 | 誘導先天干擾素應答以應對病毒抗原 | 具有廣效抗病毒作用,可能對SARS-CoV-2有效 | [371][373] |
| 硝唑尼特(Nitazoxanide) | 誘導先天干擾素應答以應對病毒抗原 | 具有廣效抗病毒作用,可能對SARS-CoV-2有效 | [376] |
| 阿拉泊韋(Alisporivir) | 抑制親環蛋白(CYP)以影響鈣調磷酸酶-T細胞細胞核因子通路 | 具有廣效抗病毒作用,更傾向於冠狀病毒,可能對SARS-CoV-2有效 | [371] |
| 雷帕黴素(Rapamycin) | 抑制激酶資訊傳遞相關的通路以阻止病毒入侵 | 對SARS-CoV及MERS-CoV具有作用,可能對SARS-CoV-2有效 | [377] |
| 伊馬替尼(Imatinib) | 抑制激酶資訊傳遞相關的通路以阻止病毒入侵 | 對SARS-CoV及MERS-CoV具有作用,可能對SARS-CoV-2有效 | [371] |
| 達沙替尼(Dasatinib) | 抑制激酶資訊傳遞相關的通路以阻止病毒入侵 | 對SARS-CoV及MERS-CoV具有作用,可能對SARS-CoV-2有效 | [371] |
由於2019年爆發的疫情影響,SARS-CoV-2病毒感染地區的人群呈現出不同程度的心理變化,有研究認為權力機構和醫療機構應當對病毒、病毒所引起的疾病和受疫情影響的群眾進行考慮,緩解心理壓力。[378]
在2019年爆發的疫情由於持續時間長,有評論認為,全球的醫護人員不是醫院的硬件設施可以24小時運轉,他們的身心健康需要得到關注。評論指出,對在疫情中治療COVID-19患者的醫生和護士,需要提供足夠的家庭支持和心理疏導,這一評論將他們稱為當時「每一個國家最珍貴的資源」。[379]一項針對專門照護COVID-19患者的醫護人員的研究指出,近半具有包括抑鬱、焦慮、失眠等負面情緒,約10-20%的受調查者心理健康風險被評為中度或重度。[380]
SARS-CoV-2於2019年底爆發時,病毒以及它所引發的疾病COVID-19的命名問題引起公眾討論。[381]有學者認為在網絡平台上廣泛傳播的具有污名效應的名稱會帶來現實社會的負面影響,且種族主義等意識形態會以社交平台為媒介放大聲音。[382][383][384]
利用SARS-CoV-2的不同稱呼,包括「中國病毒」(Chinese Virus)、「武漢病毒」(Wuhan Virus)、「冠狀病毒」(Coronavirus)、「新冠病毒」(Novel Coronavirus)等詞,有研究對人群的詞彙使用傾向和潛在心理機制進行了大數據分析。[385][386]這些研究採用了從社交平台Twitter上抓取的相關數據,包括使用的詞彙、賬號年齡、用戶年齡、性別、政治傾向等多個維度的資訊。[385][386]對年齡進行分組後,以使用「中國病毒」等爭議性詞彙的用戶(Controversial,以下簡稱為CD)對比使用「新冠病毒」等非爭議性詞彙的用戶(Non-Controversial,以下簡稱ND)發現,不同年齡段的用戶在詞彙選擇上具有顯著差異。其中,使用ND詞彙的用戶的比例在24歲以下年齡段遠高於使用CD詞彙的用戶。[385]針對性別的對比則發現,具有高粉絲數、好友數、點讚數等數據的用戶更傾向於使用ND詞彙。研究猜測,用戶因其賬戶是一種社會資本,為維護賬號狀態而會採納更謹慎的措辭。[385]另一研究在統計數據的基礎上,配合語言學分析模型,對用戶的四種語言學變量進行了量化對比。[386]其中,使用ND詞彙的用戶在這一模型中展示出更正式、具有邏輯的文本寫作模式,且在表達上具有更多的正面情緒。[386]這一研究針對用戶使用詞彙傾向而體現的心態差異進行了深入的分析發現使用CD詞彙的用戶更傾向於表達憤怒的情感,而ND詞彙使用者更傾向於表達傷感。[386]研究將這些數據和其他數據如不同的報紙、小說及博客等媒體中的文本進行了對比,發現使用CD詞彙的用戶寫作風格類似博客及日常對話等非正式寫作,而使用ND詞彙的用戶寫作風格則類似紐約時報等正式的寫作。[386]
2020年1月30日,一篇有關新型冠狀病毒在流行病學上的病例研究發表於新英格蘭醫學期刊,其中一項發現為德國有可能存在無徵狀傳播者。[387]2月3日,Science期刊刊登了一篇報道質疑了這項內容的準確和可靠性。[388]在報道中指出,德國的公共衛生機構羅伯特·科赫研究所向NEJM致信,指出由於在調查流行病學接觸史時,憑依的僅僅是受到疑似無病症患者感染的患者的描述,卻未證實病患本人的說辭。經調查顯示,這名零號病人屬於已經有明顯徵狀,依靠藥物抑制後在旅行途中感染他人的。有相關學者評論認為,儘管在研究過程中將未完全確認的患者稱為無徵狀病例是有問題的,但是需要理解研究者可能過於緊張,不可能與所有人進行交談,且也非刻意粉飾事實。[388]
2020年1月31日,預印本網站BioRxiv上刊登了一篇討論新型冠狀病毒基因構成的論文。論文稱,在病毒的S蛋白內發現4組和HIV-1基因相似的序列。作者認為這樣的結果在自然中為偶然結果的可能性很小。[389]這篇論文引起針對新型冠狀病毒的多種爭議,包括人工插入基因序列等觀點。哈佛大學的一名教授大衛·劉指出,這篇論文的結論本身就很可疑,缺乏更完善的分析和立論基礎。[390]在論文發表後的數小時內,網頁評論區內多位相關學者對文中提到的基因序列進行了測試。超過十數條評論解釋,利用NCBI的病毒數據庫,以及用於進行序列對比的BLAST程式,不但證明多種冠狀病毒已存有部分一致的HIV基因,且分析認為當HIV的基因序列佔據全數據庫的四分之一時,從病毒學角度上而言非常有可能形成論文指出的基因插入。[389]2月2日,論文作者將論文從網站上撤下,但可繼續查看全文及相關評論。[391]
2020年2月18日,來自八個國家和多個不同科研機構的27名公共衛生領域的科學家於《刺針》上聯合發表聲明,指出對SARS-CoV-2病毒以及其引起的疾病COVID-19的謠言和陰謀論妨礙了疫情相關數據的共享。聲明的簽署人共同指出,他們想要促進科學的論證和團結,邀請更多的科學家加入這份聲明。[392]
|
|
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.