热门问题
时间线
聊天
视角
溴
原子序數為35的化學元素 来自维基百科,自由的百科全书
Remove ads
溴元素化學性質十分活潑,所以不會獨立存在於自然界,存在於無色可溶結晶鹵化鹽,類似於食鹽。雖然在地殼中相對稀少,但溴離子的高可溶性讓它積聚於海洋中。商業上,可輕易的從鹵池中分離溴元素,全球三大溴素生產國分別為美國、以色列、中國[8][9]。
在高溫條件下,有機溴化合物會解離形成自由溴原子,使自由基連鎖反應終止。這個效應讓有機溴化合物成為實用的阻燃劑,每年生產出的溴,過半作為此用途。同樣的性質,大氣中的揮發性有機溴化合物容易被紫外線太陽光分解,成為自由溴原子,造成臭氧層空洞。因此,許多有機溴化合物,例如做為殺蟲劑的溴甲烷,已不再使用。溴化合物仍得以使用於鑽井液、感光底片及工業上有機化合物的反應中間體。
大量的溴鹽是劇毒,因為溶出的溴離子作用,造成溴中毒。然而,溴離子和次溴酸的生物角色最近得以闡明,發現它是人類必需的微量元素。生物性有機溴化合物在海洋生命,例如藻類中的角色,在更早之前便已得知。在藥學上,簡單的溴離子有對中樞神經系統的抑制作用。在由短效藥物取代之前,溴化鹽曾是主要的藥用鎮定劑。它們仍然保有對抗癲癇的優點。
Remove ads
歷史
溴由兩個科學家卡爾·羅威[10]和安東尼·巴拉爾[11]分別在1825年與1826年獨立發現。[12]
1826年,剛剛取得藥劑師學位的年輕化學實驗室助理巴拉爾在蒙彼利埃的鹽沼中的海苔的灰燼中發現了一種棕黃色的液體,這種液體後來得以證明是溴的化合物。那些海苔是用來製備碘的,但其中也含有溴。巴拉爾從有著飽和氯的海苔灰溶液中分離出溴。他發現產物的性質介於氯與碘之間,因此他試著證明該化合物是一氯化碘(ICl),但在失敗後他確信他發現了一個新元素,並把它稱之為rutile(意為紅色),而他的導師約瑟夫·安哥拉達則建議稱之為muride[13],源自拉丁文字muria,意思是鹵水。[11]
卡爾·賈古柏·羅威在1825年從巴特克羅伊茨納赫村裡的水泉中分離出了溴。羅威用了一個有飽和氯的礦物鹽溶液,並用二乙醚提取出了溴。在醚蒸發後,留下了一些棕色的液體。他用此液體作為他工作的樣本申請了一個在利奧波德·格梅林實驗室的職位。由於發現的公開因一些原因被延遲了,所以巴拉爾率先發表了他的結果。[10]
在法國科學家路易斯·尼可拉斯·瓦奎寧和路易斯·賈奎斯·瑟納德與約瑟夫·路易·蓋-呂薩克證實了年輕藥劑師巴拉爾的實驗之後,結論出現在法國科學院的一場演講上,並獲發表在化學紀實上。[14]在他發表的論文中,巴拉爾說他基於安格拉達的建議把新元素的名字從muride改成brôme。其他的說法則認為法國的化學與物理學家蓋-呂薩克基於它蒸氣的獨特氣味建議了這個名稱。[15]溴直到1860年才得以大量製造。
在少數的藥學應用之外,溴的第一個商業應用是用於銀版攝影法。在1840年,發現到用溴製造銀版攝影法用的光敏的鹵化銀在許多地方勝過之前所使用的碘蒸氣。[16]
Remove ads
名稱由來
溴的名稱Bromine來自希臘文bromos(βρῶμος,公山羊的惡臭)[18],日文中便將之意譯為「臭素」。
漢語中的「溴」字,原出處為《荀子·勸學篇》「蘭槐之根是為芷其漸之溴君子不近」。這裡的溴,也做滫,是指臭水。十九世紀徐壽引進西方的化學知識體系,寫著《化學鑒原》時,用溴這個生僻字指稱第35號化學元素,此後溴這個字就有了全新的意義。
特徵
溴的原子序是鹵素中的第三位,在元素週期表中為第17族,是唯一在室溫下呈液態的非金屬元素。元素單質的形式是雙原子分子:Br2。它是黏稠、可流動、幾乎黑色的液體,並在標準溫度和壓力下容易揮發,形成紅色的溴蒸氣(顏色近似於二氧化氮),並且有一股與氯氣相似的惡臭。
溴是一種鹵素,它的活性小於氯但大於碘。溴微溶於水,但對二硫化碳,有機醇類(像甲醇)與有機酸的溶解度佳。它很容易與其他原子鍵結並有強烈的漂白作用。溴像氯一樣,也用在游泳池的維護。
一些特定的溴化合物認為是有可能破壞臭氧層的或是具有生物累積性的。所以許多工業用的溴化合物不再得以生產,被限制,或逐漸淘汰。蒙特利爾議定書提到了一些有機溴化物是需要被逐漸淘汰的。
溴是一種強氧化劑。它會和金屬和大部分有機化合物產生激烈的反應,若有水參與則反應更加劇烈,溴和金屬反應會產生金屬溴鹽及次溴酸鹽(有水參與時),和有機化合物則可能產生磷光或螢光化合物。
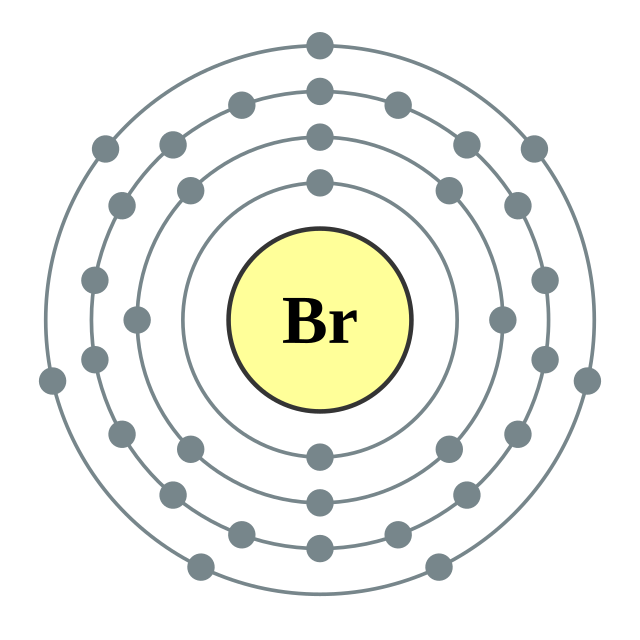
溴的性質近似於氟、氯、碘,但介於氯和碘之間。它的電子組態是[Ar]3d104s24p5,第四也是最外殼層有七個價電子。就像全部的鹵素,它還缺少一個電子才能成為一個完整的八隅體。是強氧化劑,會和許多元素反應以填滿它的外殼層。[19]根據元素週期性,它的電負度介於氯和碘之間(氟:3.98,氯:3.16,溴:2.96,碘:2.66),化學活性比氯低但比碘高。相反地,溴離子的氧化力較碘離子弱但比氯離子強。[19]這些相似性導致氯、溴和碘在早期由約翰·沃爾夫岡·德貝萊納分類為三元組,預見了化學元素週期性的存在。[20][21]它的原子半徑介於氯和碘之間,許多性質也近似氯和碘的中間值,例如第一游離能、電子親合能、分子解離焓、離子半徑和X-X鍵結長度。[19]溴的揮發性導致其高度的侵入性、窒息性和刺激性氣味。[22]
全部四個穩定的鹵素皆有分子間凡得瓦力引力,它們的強度隨著同核雙原子鹵素分子的電子數量增加而增高。因此,溴的熔點及沸點皆在氯和碘之間。也因為鹵素一族的分子量由上而下增加,溴的密度、熔化熱和蒸發熱介於氯和碘之間,雖然因為其雙原子分子結構,它們的蒸發熱皆很低(導致高揮發性)。[19]鹵素的顏色由上而下變深:氟是淡黃色氣體,氯是黃綠色,溴是紅棕色揮發性液體(熔點−7.2℃,沸點58.8℃),碘是有光澤的黑色固體。這個趨勢的形成原因是可受鹵素吸收的可見光波長由上而下增加。[19]針對鹵素的顏色,對溴而言,由於在最高佔用分子反鍵結軌域πg和最低未佔用分子反鍵結軌域σu之間的電子躍遷,[23]它的顏色在低溫變淺,所以固態溴在−195℃時是淡黃色。[19]
就像固態氯和碘,固態溴的晶體屬於斜方晶系,是一種溴分子的層狀晶格。溴分子鍵長為227皮米(近似於氣態溴分子的鍵長228皮米),在同一層溴分子中,Br···Br的距離為331皮米,層間距離為399皮米(溴凡德瓦半徑195皮米)。這個結構代表溴是非常差的電導體,在稍低於熔點下量測的導電度,約為5 × 10−13 Ω−1 cm−1,但比完全量測不出導電度的氯稍好。[19]
在55GPa(約54萬倍大氣壓力)的壓力下,溴從絕緣體轉為金屬。在75GPa,它轉為面心斜方結構。在100GPa,它轉為體心斜方單原子結構。[24]
溴有兩個穩定的同位素:79Br及81Br。自然界中只有這兩種同位素,79Br佔51%,81Br佔49%。兩者皆有3/2-核子自旋,可用於核磁共振,其中81Br較常用。它們近似一比一的分布對用質譜儀分辨含有溴的化合物十分有幫助。其它至少已發現23種放射性同位素存在,[25]不少是核分裂的產物,多因半衰期太短而無法存在於自然界。有幾種來自於核分裂產物的大原子量溴同位素會產生延遲性的中子衰變。所有的放射性溴同位素的半衰期相對來講是比較短的,半衰期最長的是一個中子數不足的同位素。其中,最重要的是80Br(t1/2=17.7分鐘)、80mBr (t1/2=4.421小時)和82Br(t1/2=35.28小時),皆為天然溴元素中子活化產生。[19]最穩定的溴放射性同位素是77Br(t1/2=57.04小時)。比79Br輕的同位素最主要的衰變模式是藉由電子捕獲衰變為硒的同位素;比81Br重的同位素藉由β衰變成氪的同位素;80Br可能藉由前述兩方法衰變成穩定80Se或80Kr。[26]
Remove ads
自然存在形式及製備

溴在自然界中和其他鹵素一樣,基本沒有單質狀態存在。它的化合物常常和氯的化合物混雜在一起,但是數量少得多,在一些礦泉水、鹽湖水(如死海)和海水中含有溴。地球上99%的溴元素以Br-的形式存在於海水中,所以人們也把溴稱為「海洋元素」。由過濾法,溴鹽在海水裡的含量約65 ppm,[27]但它在海裡的濃度比氯小。溴可以在溴含量豐富的鹵井與死海(接近50000ppm)中商業開採。[28][29]

2007年製造的溴接近556,000公噸(價值約25億美元),其中最主要的生產國是美國,以色列與中國。[30][31][32]溴的生產量自1960年代以來已經成長了六倍,美國溴含量最多的地方在哥倫比亞縣與猶尼昂縣。[33]中國的溴來源位於山東省,而以色列的溴則源於死海的水。使用氯氣來處理富含溴的鹵水,在過程中,氯氣氧化溴離子而形成溴分子。
由於溴的商業運用以及很長的保存時間,人們不會刻意的去製備它。但小量的溴可以經由固態溴化鈉與濃硫酸(H2SO4)製備。反應的第一步是製造氣態的溴化氫(HBr),但於此反應條件下,部分的溴化氫會進一步硫酸氧化形成溴分子(Br2)與二氧化硫(SO2)。
或者使用以下歸中反應製備:
使用相似的化合物,如使用稀鹽酸與次氯酸鈉也是可以的。最重要的是,該酸的陰離子(以上述的例子,硫酸根與氯離子)的電負度比溴還大,使取代反應能夠發生。
Remove ads
化學性質

有機化合物要得以溴化有加成反應與取代反應兩種途徑。溴對烯的雙鍵進行電加成,中途產生一個環狀含溴的中間產物。在像二硫化碳之類的無水溶劑裡,反應將產生二溴的產物。舉例來說,它跟乙烯反應將會產生1,2-二溴乙烷,溴也可以對苯酚與苯胺進行加成反應。當用來反應的是溴水時,除了本來會出現的二溴化物外,有少部分的烯會反應成鹵代醇。由於溴的反應是非常的可靠的,所以溴水會拿來做檢測烯類、苯酚與苯胺的檢測試劑。就像其他的鹵素一樣,溴也可以進行自由基反應,舉例來說,烴類在光照下可給溴溴化。
溴,在有催化量的磷的情況下,可以輕易的以溴化羧酸中的α-氫。這個方法稱做赫爾-烏爾哈-澤林斯基反應,是商業製溴乙酸法的基礎。人們通常使用N-溴代琥珀醯亞胺來代替元素態的溴,因為它比較好處理,而且反應也比較溫和且更具選擇性。有機溴化物相對於活性較弱的有機氯化物與較貴的有機碘化物而言,是比較好的選擇。因此,格氏試劑與有機鋰化物通常使用相對應的有機溴化物來製造。
Remove ads
溴是一種氧化劑,它會把碘離子氧化成碘,同時自身還原成溴離子。
溴也會把金屬與類金屬氧化成相對應的溴化物,通常無水的溴與含水的溴比起來活性較低,但無水的溴會與鋁、鈦、汞、銻、鹼土金屬與鹼金屬劇烈的反應。
如果溴是溶解在含水的氫氧化物中的話,溴離子(Br−)將會與次溴酸根(BrO−)一起產生,產生的次溴酸根是溴化物且具有漂白能力的原因。在一些化合物中,次溴酸根的自身氧化還原是定量的,其產生的溴酸根是與氯酸根相當相似的強氧化劑。
過溴酸根無法使用製造過氯酸根的方法-電解來製造,其製造方法是將溴酸根與氟進行反應。
Remove ads
用途
許多種的有機溴化物在工業上有其應用,其中一部份是由溴製備而來,另一部份則是由溴化氫製備而來。而溴化氫則是以在溴中燃燒氫來取得。[7]
加成反應[34]是製備1,2-二溴乙烷的過程,而1,2-二溴乙烷是有機溴化物中製造量最多的。

含溴阻燃劑的重要性與日俱增,當燃燒發生時,阻燃劑會生成氫溴酸,它會干擾在火焰當中所進行的氧化連鎖反應。高活性的氫、氧與氫氧根自由基會與溴化氫反應成活性沒那麼強的溴自由基。[35][36]含溴的化合物可以藉由在聚合過程中加入一些受到溴化的單體或在聚合後加入含溴化合物的方法加入聚合物中。添加四溴雙酚A可以製造聚酯與環氧樹脂,用於印刷電路板(PCB)的環氧樹脂通常都是由阻燃劑製成的,並且在產品縮寫中以FR來表示。(如FR-4與FR-2)溴乙烯可以用來製造聚乙烯、聚氯乙烯與聚丙烯。十溴二苯醚可以添加在已完成的聚合物中。[37]
1,2-二溴乙烷是添加在含鉛汽油中的一種汽油添加劑,它藉由產生揮發性的溴化鉛來移除引擎中的鉛,此類用法在美國佔了1966年全部溴用量的77%,但這種用途在1970年代因為會污染環境而被禁止了。[38]此化合物也曾當作殺蟲用的燻劑,但此種應用也一樣的被禁止了。[32]

溴甲烷曾廣泛用做煙薰土地用的農藥,蒙特婁公約決定到2005年逐漸淘汰這種會破壞臭氧層的化合物。在1991年,估計有35,000公噸的此化合物用來對付線蟲動物、真菌、雜草還有一些土壤的問題。[39][40]

- 鈣、鈉與鋅的溴化物在溴的市場中佔有一席之地,這些鹽類在水裡產生稠密的化合物,可以用來做鑽井液,有時也稱做clear brine fluids。[32][41]
- 溴也可以用來生產溴化植物油,溴化植物油在許多橘子口味的軟性飲料中當作乳劑。於1940年代發現此化合物後,它廣泛地得以使用,直到在1970年代中期,英國與美國限制了它的使用並且研發出了替代用的乳劑。[42]但在1997年美國的軟性飲料仍然可以含有含溴植物油。[43]

生物上的應用

溴在人體中還未找到已知的功能,但有機溴化合物的確自然存在。海中的有機物是有機溴化合物的主要來源,在1999年有超過1600種化合物得以發現。其中最常見的是溴甲烷,海藻估計製造了56,000公噸的此化合物,[44]夏威夷的蘆筍藻所製成的香精油中就含有80%的溴甲烷。[45]一個有名且人類已長時間使用的有機溴化合物是泰爾紫,[44][46]這種含溴的紫色物質存在於一種體型中等的掠食性海蝸牛:腹足綱的紫螺蝸牛之中。這種天然的有機溴化合物直到1909年才由保羅·弗里德蘭德所發現。[47]大部分自然界中的有機溴化合物是由溴化過氧化酶所產生的。[48]
安全與法規
元素狀態的溴是有毒且有刺激性的,其蒸氣有強烈腐蝕性,能破壞橡膠。因為溴是一種氧化劑,它不能與大部分的有機或無機化合物穩定的共存,所以輸送溴時需要謹慎,通常是使用內襯著鉛的鋼製桶子,並以堅固的金屬架支撐。
當某些特定的含溴離子化合物在酸性環境下與高錳酸鉀混合時,會產生淡棕色的溴霧,它聞起來像是漂白水,並且對黏膜有很強的刺激性以及催淚性。一旦有人暴露於其中,應該立即移動至有新鮮空氣的地方,如果出現了某些症狀,那麼必須以藥物治療。
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




![{\displaystyle {2\,\mathrm {Br} {\vphantom {A}}^{-}{}+{}\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}2\,\mathrm {Cl} {\vphantom {A}}^{-}{}+{}\mathrm {Br} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/878691f0b411c4ea0f506d74cbd7dbc8a813e798)
![{\displaystyle {\mathrm {NaBr} {\mskip {2mu}}(\mathrm {s} ){}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}{\mskip {2mu}}(\mathrm {aq} ){}\mathrel {\longrightarrow } {}\mathrm {HBr} {\mskip {2mu}}(\mathrm {aq} ){}+{}\mathrm {NaHSO} {\vphantom {A}}_{\smash[{t}]{4}}{\mskip {2mu}}(\mathrm {aq} )}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/5f926e282ca306dd167e61744788f2e8cc17a38a)
![{\displaystyle {2\,\mathrm {HBr} {\mskip {2mu}}(\mathrm {aq} ){}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}{\mskip {2mu}}(\mathrm {aq} ){}\mathrel {\longrightarrow } {}\mathrm {Br} {\vphantom {A}}_{\smash[{t}]{2}}{\mskip {2mu}}(\mathrm {g} ){}+{}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{2}}{\mskip {2mu}}(\mathrm {g} ){}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\mskip {2mu}}(\mathrm {l} )}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/25fd1aae84325c74134f39032a2ef542c26398a2)
![{\displaystyle {2\,\mathrm {HBr} {\mskip {2mu}}(\mathrm {aq} ){}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{\mskip {2mu}}(\mathrm {aq} ){}\mathrel {\longrightarrow } {}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\mskip {2mu}}(\mathrm {l} ){}+{}\mathrm {Br} {\vphantom {A}}_{\smash[{t}]{2}}{\mskip {2mu}}(\mathrm {g} )}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/fe3c9644113337d187562fa1136191db65355124)
![{\displaystyle {5\,\mathrm {Br} {\vphantom {A}}^{-}{}+{}\mathrm {BrO} {\vphantom {A}}_{\smash[{t}]{3}}{\vphantom {A}}^{-}{}+{}6\,\mathrm {H} {\vphantom {A}}^{+}{}\mathrel {\longrightarrow } {}3\,\mathrm {Br} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/e878ce67b5f29bc6d96a606322306c2064984ec8)
![{\displaystyle {\mathrm {Br} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {I} {\vphantom {A}}^{-}{}\mathrel {\longrightarrow } {}2\,\mathrm {Br} {\vphantom {A}}^{-}{}+{}\mathrm {I} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ec758806827fd38a448d04fd55675446964a85ae)
![{\displaystyle {3\,\mathrm {BrO} {\vphantom {A}}^{-}{}\mathrel {\longrightarrow } {}\mathrm {BrO} {\vphantom {A}}_{\smash[{t}]{3}}{\vphantom {A}}^{-}{}+{}2\,\mathrm {Br} {\vphantom {A}}^{-}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8a5d0649e74c5d34486c94a4e3b211c502571f38)
![{\displaystyle {\mathrm {BrO} {\vphantom {A}}_{\smash[{t}]{3}}{\vphantom {A}}^{-}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}\mathrm {F} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {BrO} {\vphantom {A}}_{\smash[{t}]{4}}{\vphantom {A}}^{-}{}+{}2\,\mathrm {HF} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/5cf65b8bf7bf08a6a44e585bba16c52f1694e0a4)
![{\displaystyle {\mathrm {C} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{4}}{}+{}\mathrm {Br} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {CH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {BrCH} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Br} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/f6e5be91e2c2e80327649b6c34849ba683bd22ef)